乳腺癌组织中人乳头状瘤病毒与Rb、P53蛋白表达、预后的相关性分析
郑 文, 郑建云, 刘 冰, 孙斌斌, 王海玉
(西安医学院第一附属医院病理科, 西安 710077; *通讯作者,E-mail:22843094@qq.com)
乳腺癌组织中人乳头状瘤病毒与Rb、P53蛋白表达、预后的相关性分析
郑 文*, 郑建云, 刘 冰, 孙斌斌, 王海玉
(西安医学院第一附属医院病理科, 西安 710077;*通讯作者,E-mail:22843094@qq.com)
目的 探讨人乳腺癌及乳腺良性病变组织中的人乳头状瘤病毒(HPV16/18)感染和Rb、P53蛋白表达与人乳腺癌发生发展及预后的关系。 方法 采用免疫组织化学SP法检测108例乳腺癌组织、54例乳腺纤维腺瘤及其周边正常乳腺组织HPV16/18,Rb、P53蛋白表达,分析其 HPV16/18与Rb、P53蛋白表达、预后的相关性。 结果 108例乳腺癌组织中HPV16/18、P53、Rb蛋白的阳性表达率分别为57.40%,37.03%,82.41%,均显著高于正常组及纤维腺瘤组(P<0.001),HPV16/18与P53蛋白的表达呈负相关(r=-0.503,P<0.001),而与Rb蛋白表达无相关性(P>0.05)。HPV16/18、P53阳性与阴性患者2年内的生存率差异有明显统计学意义(P<0.05),而Rb阳性与阴性患者2年内的生存率差异无明显统计学意义(P>0.05)。 结论 HPV感染可能通过对P53蛋白的降解从而促进乳腺癌的发生、发展,并影响其预后,HPV感染可能是乳腺癌的高危因素之一。
乳腺癌; HPV 16/18; Rb; P53; 相关性
20世纪初,肿瘤疾病在全球的发病率尚比较低,而随着社会、经济、环境的发展与改变,近年来肿瘤疾病的发病率呈明显上升趋势,而致残率、致死率也显著上升,目前恶性肿瘤疾病已经成为危害人类生命安全的主要疾病之一[1]。在女性人群中肿瘤疾病主要为乳腺癌、大肠癌及肺癌,其中乳腺癌占到女性恶性肿瘤发病的第一位,已经成为危害女性生命健康的主要肿瘤疾病之一,因此加强乳腺癌的筛查、防治就显得格外重要。
目前,随着临床医学技术的快速发展,人们对于乳腺癌的生物学特征已经比较了解,在临床治疗方面也开始推广应用靶向治疗方案,但是对于乳腺癌的发病机制尚不清楚,大部分学者认为可能与环境、遗传、理化等因素有关。20世纪90年代,著名医学者Band等[2]在实验中发现人乳头状瘤病毒16(human papilloma virus,HPV16)可诱导体外正常人乳腺导管上皮细胞永生化,从而为HPV可能诱发乳腺癌提供重要的理论依据。相关研究文献[3]报道,在女性宫颈癌疾病中也检测出HPV病毒,且已经被公认为是引发宫颈癌的主要致病因素,这也促使我们猜想HPV可能也是引发乳腺癌的关键性因素。在本文研究中,将深入分析乳腺癌患者组织中的HPV感染与P53、Rb蛋白表达与人乳腺癌发生发展及预后的关系,旨在为后期临床深入研究提供参考。
1 资料与方法
1.1 研究对象
研究中随机抽取西安医学院第一附属医院2014-02~2015-12间手术切除乳腺癌组织108例,乳腺纤维腺瘤组织54例及其癌旁正常乳腺组织作为对照。研究对象年龄在30-64岁,平均年龄为48.3岁;经临床检测显示,其中肿瘤直径在5 cm以上者为21例,2-5 cm者79例,<2 cm者为8例。按照美国AJCC发布的《乳腺癌分期》(第6版)判定,其中Ⅰ期3例(2.78%),Ⅱ期41例(37.96%),Ⅲ期64例(59.26%);按照病例类型,选取对象主要为浸润性导管癌、浸润性小叶癌、神经内分泌癌或合并癌。
1.2 入选及排除标准
1.2.1 入选标准 ①有完整的病理学资料;②原发性乳腺癌患者并接受改良根治术;③接受50 Gy常规放射及CAF或TAC化疗;④患者均有可供分析的病理组织切片。
1.2.2 排除标准 ①患有其他类型的恶性肿瘤或者影响生命安全的其他疾病;②乳腺癌病情出现复发或者转移者;③在参与本研究前1个月内接受抗病毒治疗者。
1.3 治疗方法
所有研究对象均接受改良根治术,术后给予常规TAC(环磷酰胺、多西他赛)或CAF(氟尿嘧啶、环磷酰胺)化疗,常规放射治疗主要采取直线加速器,照射剂量DT:50 Gy/25次/5周,具体放射野及靶区主要参考《肿瘤放射治疗学》相关标准,放射治疗一般根据患者病情给予4个或者6个疗程常规剂量的全身放疗,之后根据患者免疫组化检验结果给予靶向或者内分泌治疗。
1.4 实验方法
1.4.1 实验仪器及试剂 实验主要仪器:TKY-QPB轮转病理切片机、BD174221-切片漂烘温控仪、电热恒温培养箱、病理图像分析系统、Luminex 200多功能流式荧光点阵仪、MJ PCR基因扩增仪、冰箱、微波炉、电子显微镜。
实验主要试剂:DNA 提取试剂盒、HPV核酸分型检测试剂盒、鼠抗人视网膜母细胞瘤抑癌基因蛋白单克隆抗体、鼠抗人 P53 单克隆抗体、PV-6000聚合物免疫组化检测试剂、DBA 显色剂、伊红染液、苏木精染液、柠檬酸缓冲溶液、磷酸盐缓冲溶液、中性树胶。
1.4.2 病理组织标本制备 采集所有患者的乳腺癌病理组织标本并经甲醛固定、石蜡包埋处理,使用切片机行连续性切片(厚度控制在4 μm,数量8张);切片贴附于多聚赖氨酸玻片上,于60-70 ℃烤箱中烘烤60 min。备HPV-DNA提取及免疫组化检测。
1.4.3 Rb、P53检测方法 采用SP法,即用型抗体p53和Rb切片均需作微波抗原修复,免疫组化染色操作步骤按说明进行。
1.4.4 HPV16/18 DNA提取及检测方法 DNA快速抽提纯化试剂盒购于宝生物工程(大连)有限公司。将组织切片放入EP管中,经过加热、离心并乙醇沉淀后提取HPV-DNA,提取到的DNA样品经紫外分光光度计读取计算,琼脂糖凝胶电泳(AGE)检测后拍照记录图谱。
1.4.5 实验结果判读 免疫组化染色结果判读。肿瘤细胞核细胞计数选取棕色的颗粒,每个标本选取5个视野进行检测,依据阳性细胞的着色强度、所占百分比等结果进行判读,其中:①着色强度。褐色或者棕褐色为3分,黄色或深黄色为2分,淡黄色为1分,无着色为0分。②阳性细胞百分比。百分比≥76%为4分,51%-75%为3分,26%-50%为2分,6%-25%为1分;≤5%为0分。两种判读方法分数相加,结果<2分为阴性,2-3分为弱阴性,4-5分为中度阳性,6-7分为强阳性。
1.5 统计学方法
应用SPSS统计学软件对所得数据进行χ2检验、秩和检验和 Spearman 等级相关分析, 以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺良、恶性病变HPV16/18、P53及Rb的表达
P53、Rb蛋白阳性定位于癌细胞核内, 灶状或弥漫分布(见图1-3)。HPV16/18、P53及Rb表达在乳腺瘤组织中远高于乳腺纤维腺瘤及正常组织(P<0.001,见表1)。
2.2 乳腺癌患者HPV16/18与P53、Rb表达的相关关系
108例乳腺癌组中HPV16/18、P53、Rb三种蛋白表达的相关关系见表2。在62例HPV16/18阳性的乳腺癌组中, P53阳性10例(16.13%),而在46例HPV16/18阴性患者中P53阳性为30例(65.22%)。经统计学处理,HPV16/18阳性组中P53蛋白的阳性表达率显著低于HPV16/18阴性组(P<0.001)。乳腺癌组中HPV16/18阳性表达与P53蛋白的表达呈负相关(r=-0.503,P<0.001)。但HPV16/18阳性表达与Rb蛋白的表达无明显相关性(P>0.05)。
表1 HPV16/18、P53及Rb在乳腺癌、乳腺纤维腺瘤及纤维腺瘤旁正常乳腺组织中的表达 例(%)
Table 1 Expression of HPV16/18,P53,Rb protein in breast fibroadenoma,its corresponding adjacent normal breast tissues and breast carcinoma cases(%)

组织表达nHPV16/18表达P53表达Rb表达-+-+-+乳腺癌1084662(57.41)6840(37.03)1989(82.41)乳腺纤维腺瘤544014(25.92)540(0) 522(3.70)腺瘤旁正常乳腺组织54504(7.41)540(0) 540(0)
乳腺癌组与纤维腺瘤组、 腺瘤旁正常乳腺组各指标相比,P<0.001
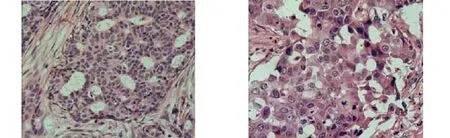
HE×200 HE×400 图1 乳腺癌组织HE染色 Figure 1 HE staining of breast cancer tissues
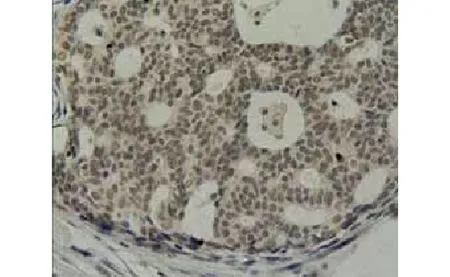
图2 乳腺癌组织Rb蛋白阳性表达 (×200)Figure 2 Positive expression of Rb protein in breast cancer tissues (×200)
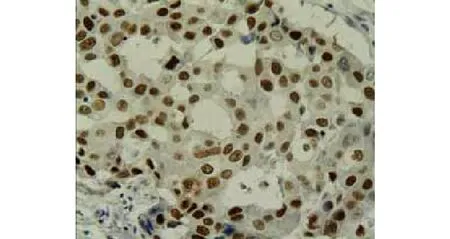
图3 乳腺癌组织P53蛋白阳性表达 (×400)Figure 3 Positive expression of P53 protein in breast cancer tissues (×400)
表2 HPV16/18蛋白的表达与P53、Rb的相关性
Table 2 Expression of HPV16/18 protein and its correlation with Rb and P53

HPV16/18表达nP53蛋白Rb蛋白+-rP+-rP+621052-0.5030.0015012-0.8540.581-463016397
2.3 乳腺癌病理组织中HPV感染与预后关系
本研究中的108例原发性乳腺癌患者经6-24个月随访,平均随访时间14.8个月,随访率达到100%。随访结果显示:108例乳腺癌患者死亡23例,其中HPV16/18阳性者死亡21例(生存率66.13%),阴性者死亡2例(生存率95.65%);P53阳性者死亡5例(生存率87.50%),阴性者死亡41例(生存率39.71%)。从随访数据中可见,HPV16/18阴性、P53阳性患者2年生存率明显高于HPV16/18阳性、P53阴性的患者,差异有统计学意义(P<0.05)。而Rb阳性与阴性患者2年生存率比较,差异无统计学意义(P>0.05)。
表3 HPV16/18、Rb、P53阳性与阴性患者2年生存率比较分析
Table 3 Comparison of 2-year survival rate between HPV16/18,Rb,P53 positive and negative patients
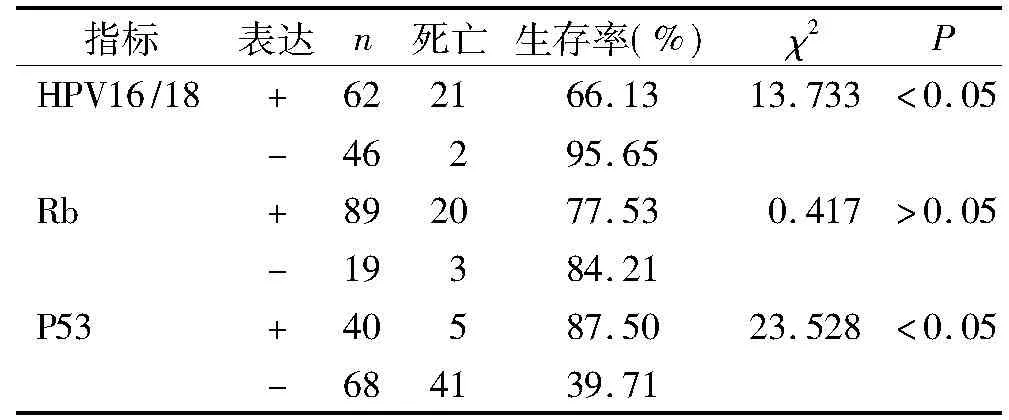
指标表达n死亡生存率(%)χ2PHPV16/18+622166.1313.733<0.05-46295.65Rb+892077.530.417>0.05-19384.21P53+40587.5023.528<0.05-684139.71
3 讨论
在关于乳腺癌与HPV关系研究中,著名医学者Band等[2]在乳腺上皮细胞转染HPV转化基因中实现了永生化,在一定程度上激发了人们对于乳腺癌候选病毒研究的兴趣。相关文献资料显示,在恶性乳腺癌病变组织中高危型HPV(即:HPV16,18,33,35)阳性达到0-87%,而这些数据在不同地区、不同国家相关文献报道中均可见[4,5],同时也提出HPV阳性患者出现乳腺癌的风险明显偏高。
3.1 HPV在乳腺癌中的表达及其临床意义
乳腺癌发病是一个多基因、多阶段、多步骤过程,当乳腺中的正常细胞在转变为癌细胞过程中会发生多次细胞DNA损伤,同时出现细胞周期调节异常。乳腺细胞DNA损伤可能与环境、病毒、遗传或放射线等因素影响相关。人乳头状瘤病毒主要的传播途径是人类的性行为,而宫颈癌、生殖道尖锐湿疣等妇科疾病均与HPV存在相关性,而乳腺作为女性重要的第二性征器官,与人类的生殖活动存在密切的相关性,因此乳腺也比较容易感染HPV[6]。目前,临床调查显示乳腺感染HPV主要是通过血液或者淋巴系统、手触及乳头皮肤致感染乳腺组织。1990年,著名学者Band等[2]在研究中提出了乳腺癌病变可能与HPV病毒感染有关,而两者之间的相关性至今也是很多学者研究的课题。
在临床实验中,赵江涛等[7]研究证实,在人乳腺上皮细胞中HPV16 E6蛋白表达可导致野生型p53的缺失。翟怡等[8]在乳腺癌研究中重点针对HPV 16中的E6,E7基因及与肿瘤抑制基因PRB、p53之间的相关性,学者在对不同生长阶段(即:早期、晚期)的乳腺上皮细胞进行细致研究,发现HPV E6、E7基因可以靶向作用于PRB、p53,并导致乳腺上皮细胞出现永生化,同时也提出其他几种关联亚型基因,而这些细胞则可能是引发乳腺癌的主要前期因素。王崇杰等[9]转导人乳腺上皮细胞株与HER-2,产生一种新的细胞株,最后发现HPV16 E6蛋白能使新的细胞株出现HER-2的高表达。韦思羽等[10]在研究中选取HPV16的E6转基因鼠为研究对象,研究结论证实HPV16 E6基因小鼠发生了乳腺肿瘤。上述学者研究成果证实,HPV16中的E6蛋白可上调或者下调抑癌基因,以此来促使乳腺细胞的永生化,这为研究乳腺癌与HPV之间的相关性提供了依据。本研究所选取的108例原发性乳腺癌患者病理组织标本HPV16/18阳性者为62例,阳性率为57.41%,显著高于乳腺纤维腺瘤组和正常对照组,这表明HPV有助于乳腺癌肿瘤的进展,并且主要是通过其E6、E7两种病毒癌基因蛋白的作用,而影响宿主细胞周期复制调节蛋白的调控。在预后方面,乳腺癌HPV阴性患者的2年生存率高于阳性患者,这些研究结果提示高危型HPV在乳腺癌中高表达,并促进乳腺癌的进展,此类患者预后差。
3.2 Rb基因在乳腺癌中的表达及与HPV相关性分析
在促癌因素作用于机体之后,机体内的抑癌基因同时也会发挥作用,主要是预防细胞转化为恶性。在1942年,相关学者就提出了“抑癌基因”概念,而直到1986年才第一次在实验中成功分离出第一个抑癌基因—Rb基因(即:视网膜母细胞瘤基因)[11]。虽然,Rb基因最开始是从视网膜母细胞瘤中分离出来的,但是在后期研究中在多种其他肿瘤中都能检测到,如软组织肉瘤、肺癌、乳腺癌、成骨肉瘤等。长期研究发现,抑癌基因的作用是诱导终末分化、程序性死亡、触发衰老、保持基因稳定等,而相关报道[12]发现Rb基因表达在调控乳腺癌细胞周期方面具有重要作用,其可以有效控制细胞由G1期转化为S期,并对细胞的生长产生负调节作用,也就是说当细胞分裂后Rb蛋白就会被磷酸化,以至于失活,以此促使细胞转化为S期;而当细胞分裂成多个子细胞后,其再经过磷酸化促使子细胞一直处于G1期。
Sterner等[13]研究提出, HPV E7蛋白与Rb结合后导致Rb对E2F抑制位点上的解除,E2F被释放。高危HPV感染的细胞中,Rb抑癌基因功能的失活导致G1期阻滞、凋亡、修复和S期复制起始准许调控精确功能的丧失,使得感染的细胞获得了准许连续和延长重复复制的能力而不管是否有DNA的损伤。本实验检测108例乳腺癌患者病理组织,发现Rb蛋白阳性表达率达到82.41%,与良性乳腺疾病病理组织及正常对照组相比明显偏高,这表明乳腺癌发病与Rb蛋白阳性表达存在相关性,但本研究结论未证实HPV感染与Rb之间存在明显相关性,却体现了乳腺癌发生与Rb基因功能缺失存在一定关联性,本研究中也证实在108例乳腺癌组织中Rb阳性者89例,阴性者19例,阳性与阴性患者的生存率分别为77.53%,84.21%,说明Rb蛋白不是影响预后的重要指标,其与预后严重程度无明显相关性。
3.3 p53基因在乳腺癌中表达及与HPV的相关性
p53基因作为一种抑癌基因与人类50%的肿瘤有关,目前发现的有肝癌、乳腺癌、膀胱癌、胃癌、结肠癌、前列腺癌、软组织肉瘤、卵巢癌、脑瘤、淋巴细胞肿瘤、食道癌、肺癌、成骨肉瘤等,扰乱正常的细胞生长周期。P53正常功能的丧失,最主要的方式是基因突变,而突变后的p53基因转变为癌基因在细胞中存在,引起细胞恶性增殖[14]。当细胞DNA发生损伤之后,P53蛋白阻止异常DNA复制,为DNA修复提供时间;如果异常DNA修复失败,P53蛋白则诱发该细胞凋亡;如果p53基因发生突变后则对细胞增殖周期完全失去控制能力,最终导致细胞癌变[15]。因此p53作为抑癌基因在抗肿瘤细胞癌变的过程中具有关键性作用。
长期临床研究[16,17]发现,HPV早转录区的E6蛋白对抑癌基因p53的正常表达产生一定影响,且促进肿瘤病症的发生、发展,而当P53蛋白出现突变或与癌蛋白结合则会失去活性,且后期产生的突变型p53基因的产物则不具有抑癌作用,反而还会促进肿瘤发生、发展[18-20]。众所周知,野生型的P53蛋白的半衰期是极短的,在很多癌变组织中所检测的p53蛋白基本上都是属于突变型,从理论角度来讲,HPV感染与P53蛋白表达应该呈正相关性[21]。而我们的研究结果表明在乳腺癌组织中P53蛋白表达的阳性率为37.03%;在62例HPV16/18阳性组中P53阳性率为16.13%(10/62),而在46例HPV16/18阴性组中P53阳性率为65.22%(30/46),乳腺癌患者中HPV16/18 DNA阳性组P53蛋白呈低水平表达,而在HPV16/18 DNA阴性组中P53蛋白呈高水平表达。乳腺癌患者中HPV16/18阳性表达与P53蛋白的表达呈负相关(r=-0.503),说明被HPV感染的乳腺癌细胞中抑癌基因p53表达降低,由此我们认为乳腺癌的发生发展可能与HPV感染以及p53基因失活有关。
淋巴结的转移情况是医学界公认的影响乳腺癌预后的重要因素,而癌组织中的P53蛋白表达可作为评估乳腺癌预后的又一指标[22],但是从本实验的预后结果中看出,P53阴性患者的2年生存率为39.71%,相对于阳性患者生存率(87.50%)明显偏低,提示P53蛋白低表达可以作为临床判断乳腺癌预后不良的因子使用。
4 结论
综上所述,在乳腺癌组织中HPV感染与P53蛋白的表达存在相关性,二者共同参与乳腺癌的发生、发展,而HPV感染与Rb蛋白的表达无明显相关性。在预后方面,HPV感染的乳腺癌患者预后差,而P53蛋白高表达的乳腺癌患者预后好, Rb蛋白不是影响预后的重要指标,其与预后严重程度无明显相关性。深入研究HPV与恶性肿瘤生物学行为的关系,将有助于揭示正常组织细胞恶变及肿瘤浸润、转移的发生机制,并有可能提前对HPV病毒的感染进行有效的预防,为治疗乳腺癌提供了一种新的思路。
[1] Jemal A,Siegel R,Ward E,etal.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225-249.
[2] Brand V,Zajchowski D,Kulesa V,etal.Human papilloma virus DNAs immortalize human mamary epithelial cells and reduce their growth factor requirements[J].Droc Natl Acad Sci USA,1990,87(1):463-437.
[3] O’Toole SA,McNeil CM,Morey AL,etal.C-Myc gene amplification is associated with a poor prognosis in invasive ductal carcinoma[J].Pathol J RCPA,2010,42:S89-S90.
[4] Antonsson A,Spurr TP,Chen AC,etal.High prevalence of Human Papillomaviruses in fresh frozen breast cancer samples[J].J Med Virol,2011,83(12):2157-2163.
[5] Baltzell K,Buehring GC,Krishnamurthy S,etal.Limited evidence of human papillomavirus in breast tissue using molecular in situ methods[J].Cancer,2012,118(5):1212-1220.
[6] de Cremoux P,Thioux M,Lebigot I,etal.No evidence of human papillomavirus DNA sequences in invasive breast carcinoma[J].Breast Cancer Res Treat,2008,109(1):55-58.
[7] 赵江涛,胡大为.120例乳腺癌中ER、PR、P53、HER-2、TOPⅡ表达及临床意义[J].川北医学院学报,2012,27(3):213-215.
[8] 翟怡,梨莉,王新美,等.Survivin、VEGF和P53在乳腺癌组织中的表达及相关性研究[J].中国现代普通外科进展,2009,12(2):102-105.
[9] 王崇杰,高海东,王磊一,等.乳腺癌病人高危型人乳头状瘤病毒感染临床研究[J].中国实用外科杂志,2009,29(3):229-231.
[10] 韦思羽,冯震博.HER-2基因在乳腺癌研究的进展[J].当代医学,2010,16(15):14-15.
[11] Ioachim EE,Malamou-Mitsi V,Kamina SA,etal.Immunohistochemical expression of Bcl-2 protein in breast lesions: correlation with Bax,p53,Rb,C-erbB-2,EGFR and proliferation indices[J].Anticancer Res,2000,20(6B):4221-4225.
[12] Mammas IN,Sourvinos G,Giannoudis A,etal.Human papilloma virus(HPV)and host cellular interactions[J].Pathol Oncol Res,2008,14(4):345-354.
[13] Sterner JM,Dew-Knight S,Musahl C,etal.Negative regulation of DNA replication by the retinoblastoma protein is mediated by its association with MCM7[J].Mol Cell Biol,1998,18(5):2748-2757.
[14] Xu R,Feiner H,Li P,etal.Differential amplification and overexpression of HER-2/neu.P53 ,MIBI,and estrogen receptor/ progesterone receptor among medullary carcinoma,a typical medullary carcinoma,and high-grade invasive ductal carcinoma of breast[J].Arch Pathol Lab Med,2003,127(11):1458-1464.
[15] 汪小霞,孟刚,李丽,等.乳腺癌中EZH2和p53蛋白表达及其临床意义[J].临床与实验病理学杂志,2015,3(5):273-276.
[16] 杨周亮,徐元成,周杏元.乳腺癌组织中转录抑制因子增强子和p53蛋白表达与临床病理特征及预后的关系[J].全科医学临床与教育,2015,6(4):619-622.
[17] Poelman SM,Heimann R,Fleming GF,etal.Invariant P53 immunostaining in primary and recurrent breast cancer[J].Eur J Cancer,2004,40(1):28-32.
[18] Varna M,Bousquet G,Plassa LF,etal.TP53 status and response to treatment in breast cancers[J].J Biomed Biotechnol,2011,201(1):284-584.
[19] 包刚,杨德启,周波,等.新辅助化疗对乳腺癌组织中雌激素、孕激素受体及P53和Cerb-2表达的影响[J].中华医学杂志,2007,87(40):2843-2845.
[20] Dookeran KA,Dignam JJ,Ferrer K,etal.p53 as a marker of prognosis in African-American women with breast cancer[J].Ann Surg Oncol,2010,17(5):1398-1405.
[21] Bai J,Ma M,Cai M,etal.Inhibition enhancer of zeste homologue 2 promotes senescence and apoptosis induced by doxorubicin in p53mutant gastric cancer cells[J].Cell Prolif,2014,47(3):211-218.
[22] 任占平,石喆,杜娟,等.乳腺癌组织中HPV16 18E6及p53 MCM7蛋白的表达及意义[J].中国肿瘤临床,2008,35(6):327-331.
Correlation between human papilloma virus and expression of HPV, Rb and P53 and its prognosis in breast carcinoma
ZHENG Wen*, ZHENG Jianyun, LIU Bing, SUN Binbin, WANG Haiyu
(DepartmentofPathology,FirstAffiliatedHospitalofXi’anMedicalUniversity,Xi’an710077,China;*Correspondingauthor,E-mail: 22843094@qq.com)
ObjectiveTo investigate the correlation between human papilloma virus(HPV16 and HPV18) infection and Rb, P53 protein expression and the prognosis in breast cancer.MethodsSP immunohistochemistry was employed to detect the expression in 108 cases of breast cancer, 54 cases of breast fibroadenoma and its corresponding adjacent normal breast tissues, and the correlations between HPV16/18 and Rb and P53 expression, prognosis were analyzed.ResultsThe positive expression rate of HPV16/18,P53 and Rb in 108 cases of breast cancer was 57.40%, 37.03% and 82.41%,respectively, higher than those in normal breast tissues and breast fibroadenoma(P<0.001). The expression of HPV16/18 was negatively correlated with the expression of P53 (r=-0.503,P<0.001), but not correlated Rb protein expression(P>0.05). The 2-year survival rate was statistically significant between patients with positive and negative HPV16/18,P53(P<0.05), but not statistically different between Rb positive and negative patients(P>0.05).ConclusionHPV16/18 may promote the carcinogenesis of breast cancer by degradation of P53 protein. HPV16/18 infection may be a high risk factor of breast cancer.
breast cancer; HPV16/18; Rb; P53; correlation
西安医学院附属医院科研项目(XYFY2013-11)
郑文,女,1985-10生,硕士,住院医师,E-mail:22843094@qq.com
2016-07-22
R737.9
A
1007-6611(2016)11-1026-06
10.13753/j.issn.1007-6611.2016.11.017

