男性不育患者精液中金黄色葡萄球菌对其精子活动力的影响
余亮亮
宁波市中医院(315010)
·临床研究·
男性不育患者精液中金黄色葡萄球菌对其精子活动力的影响
余亮亮
宁波市中医院(315010)
目的:探究金黄色葡萄球菌对男性不育患者精子活动力的影响。方法:选取本院收治的男性不育患者121例,分离精液,提取非重复金黄色葡萄球菌50株,根据精子检测分析仪器检查其对精子功能的影响,筛选菌株,并检测其毒力基因。本中心体检正常男性50例为对照组。结果:121例男性不育患者精液中分离的50菌株中,20株金黄色葡萄球菌能够造成精子的活力降低(精子制动阳性组),余30株为精子制动阴性组。精子制动阳性组精子活力前各运动(PR)(20.82±2.66%)、PR+非前向运动(NP)(26.39±2.19%)与精子制动阴性组(50.99±1.06%、60.51±2.13%)及对照组(51.46±1.45%、60.78±2.34%)相比较低(P<0.05)。精子制动阴性组精子活力PR、PR+NP与对照组相比未见差异(P>0.05)。精子制动阳性组精子中毒力基因scn(50.00%)高于精子制动阴性组(20.00%)(P<0.05)。scn影响患者精子活动能力的系数为0.6269(95%CI0.3723~0.8638,P=0.0083)。结论:金黄色葡萄球菌感染男性泌尿系统后,可导致精子活动能力降低,其原因可能与毒力基因scn有关。
不育;精子;金黄色葡萄球菌
不育症困扰着不育人群,探究原因并解决不育问题,是当下临床工作的重点内容之一[1]。金黄色葡萄球菌是医院感染中较多见的致病菌,多引发肺炎、局部化脓感染及败血症等多种全身性疾病,该菌株能够经过各种途径躲避患者机体的自身免疫功能,并在体内大量存活与增殖[2]。其致病性多与其细胞中产生的各种毒力因子存在联系,且毒力因子的分布是该菌株生存的必要条件。近年来,经研究发现金黄色葡萄球菌的增殖与感染,将导致男性生殖系统疾病,并对精子活力产生影响[3]。为进一步研究金黄色葡萄球菌对男性不育患者精液中精子活动力的影响,本文对此进行研究。
1 资料与方法
1.1 菌株的来源
选取2014年3月~2016年3月本院收治的男性不育患者121例,分离精液提取金黄色葡萄球菌50株(根据VITEK60微生物分析仪器鉴定菌株并确认)。精子制动阴性菌株来源于浙江省临床检验中心。该项研究经医院伦理委员会批准,所有患者均自愿参与研究,且已签署知情同意书,依从性较好。两组在年龄、治疗方法等一般资料上均无差异(P>0.05),具有可比性。
1.2 仪器与试剂
研究试剂:Sigma公司生产Earle平衡盐溶液,Oxoid公司生产哥伦比亚培养基,宝生物公司生产PRC试剂盒,华大基因公司生产扩增引物。研究仪器: MICRPTIC公司生产精子辅助分析系统,梅里埃公司生产VITEK60微生物全自动分析仪,赛飞医学仪器公司生产Makler精子计数板。
1.3 精液的收集及处理
随机收集本院体检中心正常24~31岁男性精液标50份本(对照组),参与精液采集的志愿者在采集精液前3~5d禁欲,采集标本时做好尿道口、外阴及手部皮肤常规消毒,以手淫方式采集精液放于清洁且干燥的广口瓶内,置于37℃的水浴箱中,液化处理30min,筛选符合正常标准的精液标本,离心去浆,调至浓度为30×106/ml备用。
1.4 精子活力及菌株毒力基因检测
将研究中采集50株菌株放于LB培养液中,以150r/min于37℃环境中离心震荡18h后,以5000r/min速度离心处理15min,取上层清液备用;选取20μl离心处理后的清液与等量正常精液混合均匀,在37℃中孵育30min,取10μl滴孵育后的标本滴于Makler精子计数板内,检测精子的质量,采用世界卫生组织(WHO)检测精子质量标准,将其活动能力分为不活动(IM)、非前向运动(NP)、前向运动(PR)三级,PR、PR+NP为精子质量良好;分别观察精子制动阴性菌株与不育男性患者精液中提取的金黄色葡萄球菌对精子正常活动功能的影响。采用PRC试剂盒检测毒力基因,设计好备用引物,以琼脂糖凝胶电泳检测PCR产物。
1.5 观察指标
①统计与观察对照组与精子阴性、阳性制动组之间精子活动能力的区别,并记录分析。②对精子制动阴性、阳性两组菌株中hlb、hlg、hld、eta、sea、seb、tst、scn、clfA、icaA、cna、fnbA毒力因子检出率进行统计,并对比主要致病因子编码基因。
1.6 统计学处理
2 结果
2.1 菌株对精子活动能力影响
男性不育患者精液中分离的50菌株中,20株金黄色葡萄球菌能够造成精子的活力降低(精子制动阳性组),余30株未造成精子活力降低(精子制动阴性组)。精子制动阳性组精子活力PR、PR+NP与精子制动阴性组及对照组相比较低(t1=56.0275、54.8737;P1=0.0000、0.0000。t2=3.4921、56.5367;P2=0.0000、0.0000),而精子制动阴性组与对照组相比未见差异(t=1.5435、5.1265;P=0.1267、0.6071)。见表1。
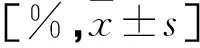
表1 各组精子活动能力比较
2.2 菌株毒力基因检测
毒力基因scn在精子制动阳性组精子中比例(50.00%)高于精子制动阴性组(20.00%)(P<0.05)。其余未见差异(表2)。scn影响患者精子活动能力的回归系数为0.6269,自由度为1,95%CI 0.3723~0.8638,P=0.0083。

表2 不同组菌株毒力基因检测结果比较[例(%)]
3 讨论
男性患者生殖系统感染直接累及前列腺、附睾等组织或器官,引发局部组织炎症性反应状态,使精子的生成、发育以及逐渐成熟的过程受到影响,从而影响精子的存活能力与运动能力,对男性身体造成严重损害[4]。经临床研究表明[5],约15%男性不育症发病原因与金黄色葡萄球菌感染有关。本研究显示,男性不育患者精液中分离的50株金黄色葡萄球菌中,20株能够造成精子的活力降低,精子活力PR、PR+NP均低于精子制动阴性组及阴性对照组。精子中毒力基因scn在精子制动阳性组中较高。目前临床报道表明[6],金黄色葡萄球菌的致病因素一般包括凝集素、补体抑制剂、杀白细胞素与多种溶血素等,多种毒力因子在疾病发生与发展的过程中起到了极其显著的作用,探讨金黄色葡萄球菌的致病因素与精子活力之间的联系,是诊断与治疗男性不育患者的重要依据。
临床研究中发现,金黄色葡萄球菌病原微生物感染所引发的精子活力降低,其发病机制多集中于以下几点:①病原微生物通过配体、受体结合等途径,菌株外表的菌毛结构可与男性患者精子外表糖脂、糖蛋白等物质结合,造成精子的大量聚集,进而使其运动能力降低等[7];②菌株内的某些毒力基因分泌、表达产生的蛋白质损伤患者的生殖道,对精子产生严重影响,脂多糖、内毒素等均可引起生殖道的损伤[8];③金黄色葡萄球菌感染生殖系统后,其引发的炎症反应,将直接损害精子的存活与运动能力。本研究中对毒力基因检测后表明,菌株中产生毒素的毒力基因种类繁多,有hlb、hlg、hld、eta、sea、seb、tst、scn、clfA、icaA、cna、fnbA等12种,与以往相关研究不同的是,本次研究菌株中产生毒素的毒力基因主要以scn为主,检出率较高。这是由于金黄色葡萄球菌对精子的损伤的作用机制可能与scn编码机制有关,scn是菌株产生的小分子类蛋白质,作用在于活化补体作用,促进级联反应,对感染病灶中补体的聚集产生阻碍作用,是菌株通过感染宿主的免疫功能防线,并得以在宿主机体中生长、增殖与分化,对患者的机体造成十分严重的影响[9-10]。金黄色葡萄球菌能够逃离机体免疫功能的杀伤效果,又可以催发炎症反应,使精液的质量与精子的活力受到严重影响[11]。炎症反应过程中,巨噬细胞、白细胞的产生,能够将大量的细胞因子释放到血液中,男性患者生殖系统炎症状态的促进因子受到介导作用,不断增值与分化,从而加重炎症状态[12]。机体发生炎症反应后,体内的氧化应激水平与活性氧不断提高,生殖系统受到影响,氧化物质与抗氧化物质失衡,代谢出现障碍,是诱发男性患者不育的主要因素之一[13]。
除此之外,男性精子活动能力的改变,是一个相对复杂的变化过程,是诸多因素作用下的结果。本次研究中,检出金黄色葡萄球菌的同时,不能排除其他细菌感染的可能,然而不论是患者自身内在感染,还是研究过程中携带菌感染,在自然生殖或人工辅助生殖过程中均能产生恶劣影响[15]。本研究对影响患者精子活动能力的因素分析采用回归分析,得出scn影响患者精子活动能力的系数为0.6269,可见在未检出scn基因的金黄色葡萄球菌中,也有导致精子活动能力降低的因素,还有待进一步研究。
综上所述,男性患者泌尿系统感染金黄色葡萄球菌后,其精子活力大大下降,其影响因素主要为毒力基因scn。
[1] 李小四,叶建中,马传玲,等.金黄色葡萄球菌对不育症患者精子活力的影响及其毒力基因谱特征[J].中华泌尿外科杂志,2014,35(5):363-367.
[2] Bachir BG,Jarvi K.Infectious,inflammatory,and immunologic conditions resulting in male infertility[J].Urol Clin North Am,2014,41(1):67-81.
[3] 刘冰,马栋,毛鹏飞,等.氧化应激损伤在男性不育症中的影响[J].中华男科学杂志,2014,20(10):927-931.
[4] 马刚,陈肖东,乜春城,等.2814例不孕男性不同年龄段精液分析参数比较[J].中国性科学,2015,24(5):94-96.
[5] Jalali M, Hemadi M, Saki G, et al. Study of spermatogenesis fetal testis exposed noise stress during and after natal period in rat[J].Pak J Biol Sci,2013,16(19):1010-1015.
[6] 岑拾贵,何莉,郎梅春.137例男性不育患者精液细菌培养及药敏分析[J].实验与检验医学,2016,34(1):113,114.
[7] Boguen R,Treulen F,Uribe P,et al.Ability of Escherichia coli to produce hemolysis leads to a greater pathogenic effect on human sperm[J].Fertil Steril,2015,103(5):1155-1161.
[8] 王中兴,刘浩,吴丽娟,等.男性不育症患者中常见病原体感染对精液参数的影响[J].生殖医学杂志,2016,25(4):364,367.
[9] 李斌,杨旭,叶建中,等.男性不育患者精液中金黄色葡萄球菌及其毒力基因对精子制动活性研究[J].中华男科学杂志,2015,21(10):881-886.
[10] 胡坚,李维娜,刘刚.男性不育症患者精液细菌学感染及耐药性分析[J].牡丹江医学院学报,2013,34(6):54,57.
[11] Cervinkova D,Babak V,Marosevic D,et al.The role of the qacA gene in mediating resistance to quaternary ammonium compounds[J].Microb Drug Resist,2013,19(3):160-167.
[12] 叶建中,尉骁,李小四,等.男性泌尿生殖道感染患者分离的金黄色葡萄球菌耐药性及耐消毒剂基因流行特性研究[J].中华男科学杂志,2014,20(7):630-636.
[13] 李文郎,唐恒锋,吴爱成,等.男性不育患者精液细菌感染对精液常规指标及动态学参数影响[J].中国微生态学杂志,2013,25(6):699-701.
[14] 李金丽,熊露,胡雅君,等.精液常规检验在男性不育诊疗中的应用评价[J].国际检验医学杂志,2015,36(6):736,737.
[15] 肖金生,张玲,刘芳,等.厦门地区332例男性不育患者精液常规结果分析[J].中国优生与遗传杂志,2012,20(11):113-114.
[责任编辑:董 琳]
The effect of staphylococcus aureus in semen on the sperm motility of infertile men
YU Liangliang
ChineseTraditionalMedicineHospitalofNingboCity, 315010
Objective: To explore the effect of Staphylococcus aureus on sperm motility of infertile men. Method: 121 infertile male patients were randomly selected from Chinese Traditional Medicine Hospital of Ningbo City, and 50 staphylococcus aureus strains were separated from semen of the 121 patients. Sperm function was detected with sperm detection analysis instrument, strains were screened and virulence genes were detected. Result: Among 50 patients with strains separated from the sperm, 20 patients with staphylococcus aureus strains had sperm motility decreased were in sperm immobilization positive group, and the other 30 patients with staphylococcus strains was in sperm immobilization negative group. Sperm motility PR(20.8 ± 2.7%) and (26.4 ± 2.2%) of patients in sperm positive group were lower than those of patients in sperm negative group(PR (51.0 ± 1.1%), PR + NP (60.51 ± 2.1%)) and those of patients in negative control group (PR (51.5 ± 1.5%), PR + NP (60.8 ± 2.3%)), the difference had statistically significant (P<0.05). There was no significant difference in sperm motility between patients in sperm negative group and patients in negative control group (P>0.05). Sperm virulence gene SCN of patients in sperm positive group (50.0%) was significant higher than that of patients in sperm negative group (20.0%), the difference had statistically significant (P<0.05). The coefficient of sperm motility of patients with SCN was 0.63 (95%CI0.37-0.86,P=0.01), which was the main factor affected the sperm motility of the patients. Conclusion: Staphylococcus aureus infection in urinary system of male patients can reduce sperm mobility, and virulence genes SCN of staphylococcus aureus maybe the reason.
Infertility; Sperm; Staphylococcus aureus
2016-07-18
2016-07-30
10.3969/j.issn.1004-8189. 2016.09

