来曲唑治疗男性少弱精子症的临床研究
田芙颖 刁瑞英 镇万华 蔡学泳 黄 健 李火金 段永刚
深圳市第二人民医院,深圳大学第一附属医院生殖医学中心(518035 )
·临床研究·
来曲唑治疗男性少弱精子症的临床研究
田芙颖 刁瑞英 镇万华 蔡学泳 黄 健 李火金 段永刚*
深圳市第二人民医院,深圳大学第一附属医院生殖医学中心(518035 )
目的:探讨应用芳香化酶抑制剂—来曲唑治疗男性少弱精子症的临床效果 。方法:选择精子浓度<5.0×106/ml,睾酮(T)<10.4 nmol/L, T与雌二醇(E2)比值(T/E2)<0.1的男性不育患者100例,随机分为两组,每组50例。来曲唑组应用来曲唑2.5mg, 1次/d。对照组给予十一酸睾丸酮胶囊40mg,2次/d,疗程均为3个月。每个月进行1次肝肾功能检查,从开始至结束时每月对患者血激素水平和精液参数进行评估。结果:治疗前后比较,来曲唑组E2水平降低、T水平升高,精子浓度、精子活动率、精子正常形态率和存活率明显提高(均P<0.01),对照组则无显著性变化。来曲唑组有效精子总数(TFSF)平均增加33.4%,对照组则稍有增加(2.1%),两组差异具有统计学性意义(P<0.05)。 结论:对于少弱精子症患者应用芳香化酶抑制剂—来曲唑有助于提高T水平、T/E2值和精液参数。
芳香化酶抑制剂;来曲唑;睾酮/ 雌二醇;少弱精子症
近年来,芳香化酶抑制剂在辅助生殖技术中应用越来越广泛[1]。芳香化酶抑制剂通过对芳香化酶抑制作用而抑制雌醇分泌,在一定范围内具有降低雌激素(E2)和升高睾酮(T)的作用。经深圳市第二人民医院(深圳大学第一附属医院)医学伦理委员会的批准,本研究对比观察使用来曲唑进行治疗少弱精子症的临床效果。
1 资料与方法
1.1 研究对象
本中心自2012年8月~2015年8月按照WHO第五版精液检测标准,选择精子浓度<5.0×106/ml、T<10.4 nmol/L及T/E2<0.1的男性不育患者100例为研究对象。对象平均年龄30(25~40)岁,平均婚龄2(1~5)年,无成功生育史。将对象随机分为两组各50例。对象排除泌尿男科相关疾病、急慢性传染病、重要脏器疾病、精神或神经性疾病、使用免疫制剂、吸毒或重度吸烟嗜好者,无性功能障碍,染色体分析结果正常。
1.2 方法
治疗前测定两组对象身高、体重、睾丸容积,性生活后3~7d检查精液常规,并抽血检测卵泡刺激素(FSH)、黄体生成素(LH) 、泌乳素(PRL)、E2、T水平,以及肝、肾功能。来曲唑组口服来曲唑2.5mg/d,疗程3个月;对照组口服十一酸睾丸酮胶囊40mg,2次/d,疗程3个月。每个月进行1次精液常规、激素水平和肝肾功能检查。
1.3 观察指标
1.3.1 体重指数(MBI) 测量患者身高和体重,计算MBI(kg/m2)。
1.3.2 睾丸容积 根据美国默沙东医药有限公司提供的睾丸测量子(12粒体积不同状的椭圆形硬物(依次标注为1,2,3......,分别代表睾丸相应容积)判定睾丸容积;正常范围15~25ml,<12ml为睾丸发育不良或萎缩。
1.3.3 激素测定 采用放射免疫法检测血清FSH、LH、PRL、E2和T水平。
1.3.4 精液的检测 采用WHO第五版精液检测标准作为精液质量的判断依据,并以有效精子总数[TFSF,精子总数(×106)×精子活动率(%)×正常形态精子(%)]评估精子数量和质量[2]。
1.4 统计学方法
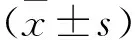
2 结果
2.1 一般情况
两组对象全部完成临床观察。治疗前两组对象MBI、睾丸容积、激素(E2、T、T/E2、FSH和LH)水平以及精液量、精子浓度和精子的活动率等比较,均无统计学差异(P>0.05)。见表1、2。
2.2 治疗后激素和精液质量水平变化
治疗后两组比较,激素水平(FSH、LH、E2、T和T/E2)差异有统计学意义(P<0.05)。来曲唑组精子浓度、精子活力均较治疗前有提高(P<0.05),对照组则无明显增加,TFSF来曲唑组平均增加33.4%,对照组平均增加2.1%,两组差异有统计学意义(P<0.05)。来曲唑组中4例(8%)精液参数没有提高。见表2。
2.3 副作用
治疗后来曲唑组有2例第1个月末血清谷草转氨酶轻度增高,发生率4%(2/50),第2个月检查时为正常范围;4例性欲减退,发生率8%(4/50),未给予特别处理,通过改善饮食,徒步锻炼,充足睡眠得到缓解,未出现勃起功能障碍和其他器官系统的并发症。

表1 两组治疗前后生殖激素水平变化

表2 两组治疗前后精液质量分析指标变化
3 讨论
国内报道不孕症的发病率占育龄夫妇的12.5%,其中30%~40%为男方原因,少弱精症为男性不育的常见原因[3]。在男性不育诊断中经相关检查并排除先天性畸形、免疫、内分泌、感染、损伤及精索静脉曲张等多种病因后,患者的精子浓度,活动力和存活率明显低于正常者,即特发性少弱精子症占有相当大的比例[4]。而近20年以来随着工业化的发展,人们生活方式的改变和周围环境的污染,人类的精子数量也在迅速下降,该病发病率逐年增加,然而药物治疗效果欠佳。结合临床实际,对于精子浓度<5.0×106/ml、T<10.4 nmol/L和T/E2<0.1的男性不育患者,笔者尝试使用芳香化酶抑制剂—来曲唑治疗。因为精子的浓度、活动率与男性不育密切相关,而精子的生成与T的水平密切相关,本研究发现直接补充T不能获得理想的临床效果。鉴于国内外目前的研究,E2参与男性性腺发育和生育调节,并在男性诸多生理和病理过程中发挥作用。芳香化酶抑制剂通过抑制芳香化酶从而抑制E2的产生和升高T水平。T/E2的平衡是哺乳动物和人类正常性发育和繁殖必不可少的条件,在睾丸中这种平衡的维护是通过内分泌和旁分泌因子的调节而涉及芳香化酶的活性。正是通过这种因子的调节维持睾丸内内源性的T水平,保持睾丸的正常生精功能[5]。
芳香化酶是微粒体细胞色素P450酶,是雌激素合成过程中的关键酶[6],它主要存在于卵巢、大脑、脂肪、乳房等组织中,它能作用于不同组织中特异性的雄激素底物,产生不同活性的雌激素[7-8]。目前研究发现,芳香化酶抑制剂—来曲唑促进排卵的机制主要通过中枢和外周两种途径:抑制芳香化酶活性阻碍了雄激素向雌激素的转化,雌激素水平的下降解除了对下丘脑-垂体-睾丸轴(卵巢轴)的负反馈抑制,致内源性促性腺激素分泌增多,刺激睾丸精原细胞发育,积聚的雄激素刺激多种分泌因子的表达,并同时作用于睾丸的支持细胞,使其分泌大量雄激素结合蛋白与大量T相结合,睾丸内高浓度T环境,使精子的成熟和生成增加,同时增加了FSH受体对支持细胞的表达,也促进了精子的发育[6]。
本研究结果提示,在男性生理范围内的血浆E2水平变化与垂体LH水平显著的相关。应用芳香化酶抑制剂降低E2浓度会导致LH、FSH水平升高,T浓度升高。虽然FSH的释放主要受抑制素的调控,但是循环中E2对男性雄激素水平影响很大,E2水平升高,T水平降低,T/E2比值降低,精子浓度减少和活动率明显降低是少弱精子男性不育临床特征[9-10]。早期研究表明服用芳香化酶抑制剂或补充T对精子的浓度和活力有一定积极作用,然而本研究表明单独使用T并不能改善精子的浓度和质量。相比服用芳香化酶抑制剂,或服用他莫昔芬后,T/E2比值降低而增加妊娠率[11-12]。
本研究显示,治疗后E2水平降低,T水平和T/E2比值均增高。由于E2浓度降低,解除了E2对雄激素水平的影响,精子浓度有所增加;同时TFSF在来曲唑组治疗后有所增加。有研究认为,来曲唑阻断了雄激素向雌激素的转化,睾丸内部雄激素水平升高,提高了睾丸支持细胞对FSH受体的表达,增加睾丸细胞对FSH的敏感性,FSH作用的加大同时也降低生精过程对FSH的需求[13]。雌激素水平的下降,解除了其对下丘脑-垂体-睾丸的负反馈作用,致内源性FSH和LH水平较治疗前基础状态也有所升高,刺激生精细胞发育成熟增加,同时本研究证实来曲唑组较对照组升高T效果明显。本研究发现;一些患有严重少精子症(精子浓度<5.0×106/ml,T<10.4 nmol/L,T/E2值<0.1),正常的促性腺激素浓度的男性内分泌失调是可用来曲唑治疗,而单独服用十一酸睾酮并不能有效提高T水平和精子参数。而应用芳香化酶抑制剂可提高T水平和T/E2值,提高精子参数,其作用机制是相似的。本组疗效观察优越于使用T或其他药物制剂[13-14]。
本组研究的设计原理是基于男性生精过程和精子的成熟周期在3个月左右,药物剂量采取小剂量,避免较大剂量对体内激素水平和激素调节机制的影响。应用芳香化酶抑制剂主要适用于因T/E2值偏低所致少弱精子症的男性不育患者,药物和合适剂量的选择,是促进机体组织细胞内源性激素代谢和获得治疗效果的重要因素,有待继续探讨。长期服用芳香化酶抑制剂是否对男性有害,对于药物的副作用和并发症目前尚没有相关报道,但是绝经后乳腺癌妇女服用芳香化酶抑制剂会有骨质疏松的风险,胆固醇水平轻微增加[15]。本组研究中少数患者有肝功能轻度异常,或有性欲减退现象,尚未发生勃起功能障碍。由于本研究周期短暂,未发现有骨质疏松临床表现或者胆固醇水平增加的病例。同时,治疗后妊娠情况尚不能统计。因此,临床上应用芳香化酶抑制剂对少弱精子症治疗的效果和用药安全性仍需要进一步深入研究[16]。
[1] Casper RF, Mitwally MF. Use of the aromatase inhibitor letrozole for ovulation induction in women with polycystic ovarian syndrome[J]. Clin Obstet Gynecol, 2011, 54(4): 685-695.
[2] Gregoriou O, Bakas P, Grigoriadis C, et al. Changes in hormonal profile and seminal parameters with use of aromatase inhibitors in management of infertile men with low testosterone to estradiol ratios[J]. Fertility and Sterility, 2012, 98(1): 48-51.
[3] 黄宇峰.男性诊断学.上海:第二军医大学出版社,1999:2.
[4] 江鱼.男子不育症诊断和治疗进展[J].中国男科学杂志,2000,14(1):53-54.
[5] 刘志洪,卢一平.芳香化酶抑制剂在男科领域的应用现状[J].实用医院临床杂志,2014,4: 33-40.
[6] Stocco C. Aromatase expression in the ovary: hormonal and molecule regulation[J]. Steroids, 2008, 73(5): 473-487.
[7] Mukherjee S, Sharma S, Chakravarty BN, et al. Letrozole in a low-cost in vitro fertilization protocol in intracytoplasmic sperm injection cycles for male factor infertility: a randomized controlled trial[J]. J Hum Reprod Sci, 2012, 5(2): 170-174.
[8] Simpson ER. Models of aromatase insufficiency[J]. Semin Reprod Med, 2004, 22(1): 25-30.
[9] Pitteloud N, Dwyer AA, DeCruz S, et al. Inhibition of luteinizing hormone secretion by testosterone in men requires aromatization for its pituitary but not its hypothalamic effects: evidence from the tandem study of normal and gonadotropin-releasing hormone-deficient men[J]. J Clin Endocrinol Metab, 2008, 93(3): 784-791.
[10] Raven G, de Jong FH, Kaufman JM, et al. In men, peripheral estradiol levels directly reflect the action of estrogens at the hypothalamo-pituitary level to inhibit gonadotropin secretion[J]. J Clin Endocrinol Metab, 2006, 91(9): 3324-3328.
[11] Vandekerckhove P, Lilford R, Vail A, et al. Clomiphene or tamoxifen for idiopathic oligo/asthenospermia[J]. Cochrane Database Syst Rev, 2000, (2): CD000151.
[12] Clark RV, Shenns RJ. Treatment of men with idiopathic oligozoospermic infertility using the aromatase inhibitor, testolactone. Results of a double blinded, randomized, piacebo-oontrolled trial with crossover[J]. J Androl, 1989, 10(3): 240-247.
[13] 黄燕平,陈向锋,平萍,等.外源性雄激素补充治疗男性不育:推荐还是屛弃[J].中国计划生育与妇产科学杂志,2015,1:18-21.
[14] Saylam B, Efesoy O, Cayan S. The effect of aromatase inhibitor letrozole on body mass index, serum hormones, and sperm parameters in infertile men[J]. Fertil Steril, 2011, 95(2): 809-811.
[15] Breast Intermational Group (BIG) 1-98 Collaborative Group, Thuerlimann B, Keshaviah A, et al. A comparison of letrozole and tamoxifen inpostmenopausal women with early breastcancer[J]. N Engl J Med, 2005, 353(26): 2747-2757.
[16] Schlegel PN. Aromatase inhibiyors for male infertility[J]. Fertil Steril, 2012, 98(6): 1359-1362.
[责任编辑:张 璐]
Clinical study of aromatase inhibitor letrozole to treat oligoasthenospermia of male patients
TIAN Fuyin, DIAO Ruiying, ZHEN Wanhua, CAI Xueyong, HUANG Jian, LI Huoji, DUAN YongGang*ShenzhenSecondPeople'sHospital,TheFirstAffiliatedHospitalofShenzhenUniversity, 518035*Correspondingauthor:yonggangduan@hotmail.com
Objective: To explore the clinical effect of aromatase inhibitor letrozole to treat oligoasthenospermia of men. Method: 100 male infertile patients with sperm concentrations (<5.0×106/ml), testosterone (10.4 nmol/L), and testosterone / estradiol (< 0.1) were randomly divided into two groups, 50 patients in each group. The treatment group took 2.5 mg letrozole once day and the control group was given testosterone undecanoate (40mg, Bid). Both groups took drugs for 3 months. Function of liver and kidney tests were performed every month, and the serum hormone levels and semen parameters were also evaluated every month from the study beginning to the end. Result: The level of estradiol of patients in the treatment group was decreased significantly, whereas testosterone level, the concentration of sperm sperm motility, normal sperm morphology and sperm vitality increased significantly compared with the pretherapy (P<0.01). However, the significant difference of patients in control group cannot be detected. In treatment group, Total functional sperm fraction (TFSF) count increased by an average of 33.4%, but that in control group had increased average 2.1%, which had significant difference (P<0.05). Conclusion: For treating Oligoasthenospermia of infertility patients, aromatase inhibitor letrozole is helpful to increase the level of testosterone, testosterone/estradiol and sperm parameters.
Aromatase inhibitor; Letrozole; Testosterone; Estradiol; Oligoasthenospermia
广东省自然基金项目(2014A030313652)
2015-10-21
2016-08-13
10.3969/j.issn.1004-8189. 2016.09
*通讯作者:yonggangduan@hotmail.com

