腺病毒转染新生及成年鼠内耳细胞的研究
舒易来陶永李文妍陈正一李华伟
·论著·
腺病毒转染新生及成年鼠内耳细胞的研究
舒易来1,2陶永2李文妍1,2陈正一2李华伟1
目的 探讨腺病毒携带目的基因Cre和Oct4导入新生和成年小鼠转染内耳细胞的可行性,为内耳基因治疗提供可行性研究。方法 采用纳升级显微操作系统,经耳蜗中阶显微注射携带基因编辑基因Cre和绿色荧光蛋白(GFP)基因的5型重组腺病毒悬液于新生鼠(P1)和成年鼠,并以腺病毒携带Oct4基因转染入成年鼠内耳,注射4 d后取双侧耳蜗标本做基底膜铺片,观察GFP和Oct4表达情况。结果 新生鼠组:术后第4 d见耳蜗底圈62﹪和中圈54﹪支持细胞表达GFP。成年鼠组:术后第4天可见耳蜗底圈96﹪和中圈51﹪内毛细胞表达GFP,底圈72﹪和中圈40﹪支持细胞表达GFP。31﹪内毛细胞和43﹪支持细胞表达Oct4。未注射耳未见GFP和Oct4表达。结论 显微注射腺病毒携带目的基因Cre和Oct4可高效导入新生鼠及成年鼠内耳并表达,可用来研究内耳基因功能和基因治疗。
腺病毒科; 耳蜗; 内耳; 基因疗法
据2006年我国第二次残疾人抽样调查显示,我国听力残疾人达2 780万,并且还在不断增加[1]。耳聋可大致分为3种类型:传导性耳聋、感音神经性耳聋和混合性耳聋。感音神经性耳聋是由于耳蜗Corti氏器毛细胞、听神经、听传导径路或各级神经元受损害,致声音的感受与神经冲动传递障碍。因噪音、耳毒性药物、遗传、感染和自身免疫性疾病等引起的毛细胞丢失或毛细胞、支持细胞等功能缺失引起的感音神经性耳聋占很大一部分,哺乳动物的耳蜗毛细胞在死亡后不能再生。目前上百种基因突变所致的遗传性耳聋的治疗是助听器和人工耳蜗植入,但并不理想。
随着越来越多的内耳感觉细胞决定基因和因子被发现和突变基因的发现,关于毛细胞再生和遗传性耳聋基因治疗的研究取得了一定进展。一系列研究发现为耳聋的治疗带来了希望,但仍然充满了挑战。所以需要发现和研究新的基因来解决毛细胞再生[2-9]。上百种基因突变引起遗传性耳聋,目前以基因治疗的手段在原位恢复听觉是有前景的途径,但用于临床仍然需要解决很多问题[10-17]。依靠构建转基因模型来研究相关内耳基因费时费力,所以迫切需要新的方法来高效的研究大量的内耳基因功能。
目前在内耳基因治疗中的载体分为病毒性载体和非病毒性载体两类。病毒性载体有腺病毒(adenovirus,Ad)、腺相关病毒(adeno-associated virus,AAV)、单纯疱疹病毒(herpes simplex virus,HSV)、逆转录病毒和慢病毒等。其中最常用的是腺病毒和腺相关病毒。笔者团队以及其他学者前期研究了AAV在新生鼠和成年鼠内耳中的表达[18-19]。腺病毒可以感染非分裂和分裂细胞;高效、迅速地传递和表达基因;易于增殖和纯化、滴度高;为研究各基因功能常用的载体。国内外学者以小鼠、豚鼠圆窗膜、中阶等的路径注射腺病毒,报道其感染耳蜗内细胞不一[19-24]。
Cre-LoxP小鼠是常用的基因研究系统,一条常用的途径是通过腺病毒携带Cre重组酶(Cre)局部注射来实现。多潜能性干细胞可以通过加入包括Oct4在内的4种因子从鼠成纤维细胞中得到,Oct4被证实在维持胚胎干细胞方面可能更据主导地位[25]。由于腺病毒转染效率和转染细胞受多方面因素影响,在研究毛细胞再生以及遗传性耳聋基因治疗时,需要对载体腺病毒转染内耳细胞做一系统的研究。本研究采用纳升水平的导入系统,将携带Cre和绿色荧光蛋白(green fl uorescent protein, GFP)标记(Ad-Cre-GFP)或携带Oct4(Ad-Oct4)的5型腺病毒局部注射入新生和成年小鼠内耳,研究其对内耳细胞的转染特点。
材料与方法
一、材料
1.实验动物:本实验采用CBA/CAJ出生后1 d新生鼠(P1)及6 ~ 8周成年的小鼠,按两个年龄段随机分组,即在两年龄段各注射Ad-Cre-GFP 4只。另外一组成年鼠注射Ad-Oct4,各组动物均以右耳作为手术耳,非手术耳作为空白对照。实验小鼠来源于美国Charles River动物中心,符合美国医用动物使用标准。
2.主要试剂和器材:4﹪多聚甲醛、EDTA、Triton X-100均来自美国Sigma公司;麻醉药xylazine、ketamine 分别来自美国VEDCO、Ketaset公司;Ad-Cre-GFP悬液购买自美国Baylor College of Medicine;Ad-Oct4悬液来自哈佛医学院;免疫组化抗体:Rabbit anti-Oct4(Invitrogen,USA)、Myosin7a Rabbit Polyclonal antibody (Proteus Biosciences,USA)、Sox2(Y-17)goat polyclona IgG(Santa Cruz Biotechnology,USA)、DAPI(Sigma,USA);二抗均来自美国Molecular Probes;动物显微手术器械和解剖器械来自于美国Fine Science Tools;玻璃微电极、纳升级显微注射系统来自美国WPI;手术显微镜来自德国Zeiss。
二、方法
1.新生鼠内耳显微注射:所有手术器械经高温高压消毒后烘干。新生鼠采用冰麻,麻醉后,术区以碘伏消毒,取左侧卧位,在手术显微镜下,以显微剪于耳后剪开皮肤,分离下颌下腺、胸锁乳突肌和下颌下腺,暴露耳蜗,以已连接玻璃微电极的纳升级显微操作系统吸取约400 nl Ad-Cre-GFP悬液,以连接的玻璃微电极尖端轻轻刺破耳蜗(玻璃微电极尖端的大小约为15 ~ 20 μm),共注射约200 nl。消毒后把小鼠置于37℃保温袋复温,待其苏醒。
2.成年鼠内耳显微注射:所有手术器械经高温高压消毒后烘干。给予xylazine(20 mg/kg)和ketamine(100 mg/kg)腹腔注射麻醉,麻醉后备皮,取俯卧位颈部垫高,头偏右侧。术中以37℃保温袋保温。术区以碘伏消毒,在手术显微镜下,以眼科剪于耳后剪开皮肤,分离暴露胸锁乳突肌和下颌下腺后,挑开听泡,扩大后暴露镫骨动脉。在底圈以细针轻轻磨除蜗壁。以纳升级显微操作系统,以玻璃微电极刺破耳蜗侧壁韧带,注射Ad-Cre-GFP或Ad-
Oct4约322 nl悬液。注射完毕后停留约5 min后拔出玻璃微电极尖,缝合切口。
3.内耳标本铺片的制作:术后第4天处死动物,迅速取出听泡,于解剖显微镜下暴露耳蜗,刺破圆窗膜,并将镫骨轻推入前庭池以打开前庭窗,然后将耳蜗置于4﹪多聚甲醛磷酸盐缓冲液中4℃避光固定过夜,成年鼠标本则于10﹪EDTA脱钙2 ~ 3 d,之后在解剖显微镜下分离出椭圆囊和基底膜。
4.免疫组化:对基底膜和椭圆囊分离后铺片染色,毛细胞以Myo7a染色标记,支持细胞以Sox2染色标记,细胞核以DAPI染色,详细染色方法参照文献[5]。
5.细胞计数:整个耳蜗基底膜分底圈、中圈、顶圈,把底圈最底处定义为0﹪,顶圈最顶处定义为100﹪,那么25﹪周围区域代表底圈,50﹪周围区域代表中圈,75﹪周围区域代表顶圈。计数200 μm的长度的基底膜。在激光共聚焦图像中计算每一段中表达GFP或Oct4的毛细胞、支持细胞数比例。
结 果
一、耳蜗解剖基本情况
术后耳蜗大体改变:术后4 d取材时见中耳腔清洁、干净,成年组未见中耳及内耳炎症、出血等反应。固定后在荧光显微镜下观察,Ad-Cre-GFP组的术耳的基底膜有GFP明显表达,而未注射耳未见GFP表达。
二、新生鼠内耳毛细胞、支持细胞GFP的表达在腺病毒显微注射后的P1小鼠组,椭圆囊、耳蜗的毛细胞、支持细胞均成活。在Ad-Cre-GFP注射组,椭圆囊的支持细胞和毛细胞未见明显GFP表达,而耳蜗的支持细胞见GFP表达。耳蜗底圈62﹪和中圈54﹪支持细胞表达GFP(图1a,b,c)。在未注射耳,耳蜗及椭圆囊均未见GFP表达(图1d)。
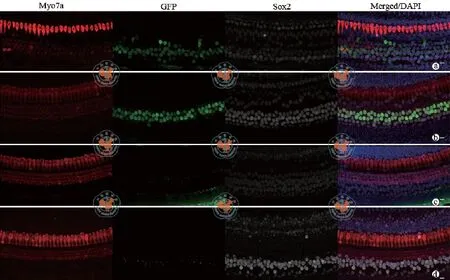
图1 新生鼠注射Ad-cre-GFP在耳蜗表达结果 (免疫组化染色× 630)
三、成年鼠内耳毛细胞、支持细胞GFP和Oct4的表达
在成年鼠组,在Ad-Cre-GFP注射后,可见相对注射部位的底圈和中圈的外毛细胞缺失或部分缺失,所有的内毛细胞、支持细胞以及椭圆囊的毛细胞均未见缺失。耳蜗底圈96﹪和中圈51﹪内毛细胞表达GFP,底圈72﹪和中圈40﹪支持细胞表达绿色荧光蛋白(图2a,b)。在Ad-Oct4小组,31﹪内毛细胞和43﹪支持细胞表达Oct4(图3)。未注射耳未见GFP或Oct4表达(图2c,图3b)。
讨 论
腺病毒靶细胞种类多,导入效率高,携带的
目的基因表达迅速,能感染分裂或不分裂的细胞,在基因治疗研究领域备受重视,应用比较广泛。本研究经中阶途径注射腺病毒,在P1的小鼠中,GFP主要表达在支持细胞,在成年小鼠中,GFP的表达也主要是支持细胞,但在内毛细胞也有高效表达,未发现有前庭毛细胞和支持细胞的转染。这说明不同年龄段腺病毒对耳蜗毛细胞的转染略有不同,这可能和毛细胞的成熟程度、形态等有关。

图2 成年鼠内耳注射Ad-Cre-GFP在耳蜗表达结果 (免疫组化染色×630)
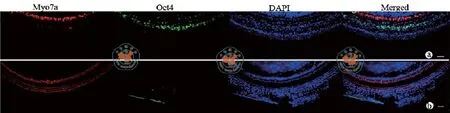
图3 成年鼠内耳注射Ad-Oct4在耳蜗表达结果 (免疫组化染色×400)
学者们对其在内耳研究中的应用进行了一些研究。Staecker等[26]报道通过圆窗膜路径的方法以腺病毒为载体转染入外淋巴液后,目的基因表达在螺旋神经节以及耳蜗和前庭的感觉细胞。国内不少学者也进行了相关研究。韩朝等[24]以豚鼠耳蜗侧壁钻孔中阶入路转染携带GFP的腺病毒,发现可以感染听器的支持细胞和血管纹缘细胞等。徐延军等[23]经小鼠耳后入路圆窗膜显微注射途径转染携
带GFP的腺病毒,发现耳蜗底回基底膜及螺旋神经节上目的基因有表达。于子龙等[22]发现腺病毒介导的LacZ基因在内耳组织中的表达至少可持续3周,其中在螺旋神经节细胞表达稳定,Corti器、前庭囊斑、壶腹嵴的毛细胞等也有较强的表达。
本研究以纳升水平的显微操作导入系统,精确的控制导入量和导入速度,使得手术对内耳的损伤尽量减少到最小,验证了腺病毒携带Cre或Oct4能高效的转染耳蜗支持细胞和内毛细胞,表达迅速,并且在手术后的新生鼠的模型上未见有外毛细胞缺失,在各年龄段其可用于后期的关于耳蜗毛细胞再生研究的基因治疗中,对于新生鼠,可用于遗传性耳聋的基因治疗的模型。大量的学者报道,以中阶或是圆窗膜路径转染目的基因,高频区会有听力损失,相对应注射部位有不同程度的外毛细胞的缺失[3-5,10],这与实验中的成年鼠注射后结果相一致。新生鼠所有的毛细胞均没有缺失,这可能和以下几方面有关:(1)毛细胞尚未发育成熟,对外界的创伤不敏感;(2)新生鼠手术不需要打洞,无明显淋巴液漏;(3)使用了纳升水平的显微操作导入系统,精确的控制导入量和导入速度。
显微注射腺病毒携带目的基因Cre和Oct4均可高效导入新生鼠及成年鼠内耳并表达,可高效的用来研究内耳基因功能和耳聋基因治疗。
1 第二次全国残疾人抽样调查办公室. 第二次全国残疾人抽样调查主要数据手册[M] . 北京: 华夏出版社, 2007 .
2 Zheng JL, Gao WQ. Overexpression of math1 induces robust production of extra hair cells in postnatal rat inner ears[J]. Nat Neurosci, 2000, 3(6):580-586.
3 Yamamoto N, Tanigaki K, Tsuji M, et al. Inhibition of Notch/RBP-J signaling induces hair cell formation in neonate mouse cochleas[J]. J Mol Med (Berl), 2006,84(1):37-45.
4 Doetzlhofer A, Basch ML, Ohyama T, et al. Hey2 regulation by FGF provides a Notch-independent mechanism for maintaining pillar cell fate in the organ of Corti[J]. Dev Cell,2009,16(1):58-69.
5 Sage C, Huang M, Karimi K, et al. Proliferation of functional hair cells in vivo in the absence of the retinoblastoma protein[J]. Science, 2005, 307(5712):1114-1118.
6 Weber T, Corbett MK, Chow LML, et al. Rapid cell-cycle reentry and cell death after acute inactivation of the retinoblastoma gene product in postnatal cochlear hair cells[J]. Proc Natl AcadSci U S A, 2008, 105(2):781-785.
7 Liu Z, DearmanJA, CoxBC, et al. Age-dependent in vivo conversion of mouse cochlear pillar and Deiters' cells to immature hair cells by Atoh1 ectopic expression[J]. J Neurosci, 2012, 32(19):6600-6610.
8 Yang SM, Chen W, Guo WW, et al. Regeneration of stereocilia of hair cells by forced Atoh1 expression in the adult mammalian cochlea[J]. PloS One, 2012, 7(9):e46355.
9 Kelly MC, Chang Q, Pan A, et al. Atoh1 directs the formation of sensory mosaics and induces cell proliferation in the postnatal mammalian cochlea in vivo[J]. J Neurosci, 2012, 32(19):6699-6710.
10 Akil O, Seal RP, Burke K, et al. Restoration of hearing in the VGLUT3 knockout mouse using virally mediated gene therapy[J]. Neuron, 2012, 75(2):283-293.
11 Askew C, Rochat C, Pan B, et al. Tmc gene therapy restores auditory function in deaf mice[J]. SciTransl Med, 2015, 7(295): 295ra108.
12 Chien WW, Isgrig K, Roy S, et al. Gene Therapy restores hair cell stereocilia morphology in inner ears of deaf whirler mice[J]. MolTher, 2016,24(1):17-25..
13 Yu Q, Wang Y, Chang Q, et al. Virally expressed connexin26 restores gap junction function in the cochlea of conditional Gjb2 knockout mice[J]. Gene Ther, 2014, 21(1):71-80.
14 Lentz JJ, Jodelka FM, Hinrich AJ, et al. Rescue of hearing and vestibular function by antisense oligonucleotides in a mouse model of human deafness[J]. Nat Med, 2013, 19(3):345-350.
15 Maeda Y, Fukushima K, Nishizaki K, et al. In vitro and in vivo suppression of GJB2 expression by RNA interference[J]. Hum Mol Genet, 2005, 14(12):1641-1650.
16 Zuris JA, Thompson DB, Shu YL, et al. Cationic lipid-mediated delivery of proteins enables effi cient protein-based genome editing in vitro and in vivo[J]. Nat Biotechnol, 2015, 33(1):73-80.
17 Li M, Tao Y, Shu Y, et al. Discovery and characterization of a peptide that enhances endosomal escape of delivered proteins in vitro and in viv[J]. J Am Chem Soc, 2015, 137(44):4084-4093.
18 Shu Y, Tao Y, Wang Z, et al. Identifi cation of adeno-associated viral vectors(AAV)that target neonatal and adult mammalian inner ear cell subtypes[J]. Hum Gene Ther, 2016, 27(9):687-699.
19 Kilpatrick LA, Li Q, Yang J, et al. Adeno-associated virus-mediated gene delivery into the scala media of the normal and deafened adult mouse ear[J]. Gene Ther, 2011, 18(6):569-578.
20 Raphael Y, Frisancho JC, Roessler BJ. Adenoviral-mediated gene transfer into Guinea pig cochlear cells in vivo[J]. Neurosci Lett, 1996, 207(2):137-141.
21 Luebke AE, Steiger JD, Hodges BL, et al. A modifi ed adenovirus can transfect cochlear hair cells in vivo without compromising cochlear function[J]. Gene Ther, 2001, 8(10):789-794.
22 于子龙, 韩德民, 林晨, 等. 内耳转基因表达的实验研究[J]. 中华耳鼻咽喉科杂志, 2003, 38(5):340-342.
23 徐延军, 胡吟燕, 翟所强, 等.耳后入路圆窗膜显微注射小鼠耳蜗基因转染新途径的研究[J].听力学及言语疾病杂志, 2009, 17(3):279-282.
24 韩朝, 迟放鲁, 黄一波, 等.两种内淋巴给药方式对豚鼠耳蜗功能和形态的影响[J]. 中华耳鼻咽喉头颈外科杂志, 2009, 44(4):329-334.
25 Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126(4):663-676.
26 Staecker H, Li D, O'Malley BW Jr, et al. Gene expression in the mammalian cochlea:a study of multiple vector systems[J]. ActaOtolaryngol, 2001, 121(2):157-163.
Study on adenovirus-infected inner ear cells in newborn and adult mouse
Shu Yilai1,2, Tao Yong2,Li Wenyan1,2, Chen Zheng-Yi2, Li Huawei1.1Department of Otolaryngology-Head and Neck Surgery, Eye and ENT Hospital, Shanghai Medical College, Fudan University, Key Laboratory of Hearing Medicine, National Health and Family Planning Commission, Shanghai 200031, China;2Department of Otolaryngology, Harvard Medical School and Eaton-Peabody Laboratories, Massachusetts Eye & Ear Infirmary, Boston, MA, 02114, USA
Objective To investigate the feasibility of target gene transfer into the inner ear cells of neonatal and adult mice by adenovirus vectors, so as to provide basis for gene therapy of inner ear. Methods Adenovirus vector 5 carrying GFP linked to a genome editing gene Cre recombinase (Ad-Cre-GFP) was injected into inner ear cells of neonatal (p1) and adult mice through nano-liter grade micro-operating system by cochleostomy.The Adenovirus vectors carrying Oct4 gene(Ad-Oct4) was administered into inner cells of another adult mice group. After 4 days of injection, bilateral cochlea was harvested for whole-mount membrane was sectioned into slices. Immunofluorescence was used to observe the expression of target protein. Results In neonatal(P1) cochleae injected with Ad-Cre-GFP, GFP expression was detected in 62﹪ of supporting cells in the base circle and 54﹪ of supporting cells in middle circle after 4 days of injection. In adult mice, GFP was expressed in 72﹪and 40﹪ supporting cells at base and middle circle of cochlear respectively. 96﹪ and 51﹪ inner hair cells was found expressing GFP at base and middle circles respectively. In addition, Oct4 was detected in 31﹪ inner hair cells and 43﹪supporting cells after Ad-Oct4 injection. No GFP and Oct4 expression was observed in the control ears. Conclusion Our study indicate that micro-injection of adenovirus into both neonatal and adult mouse inner ears can achieve efficient exogenous gene transfer, which has great potential in inner cell gene therapy and inner ear gene function study.
Adenoviridae; Cochlea; Inner ear; Gene therapy;
2016-08-09)
(本文编辑:李少 婷)
10.3877/cma.j.issn.2095-1221.2016.05.007
国家自然科学基金(NSFC81300824);上海市浦江人才资助项目(15PJ1401000)
200031 上海,复旦大学附属眼耳鼻喉科医院耳鼻喉头颈外科 国家卫计委听觉医学重点实验室1;02114 波士顿,哈佛大学医学院麻省眼耳医院耳鼻喉头颈外科2
李华伟,Email:hwli@shmu.edu.cn
舒易来,陶永,李文妍,等.腺病毒转染新生及成年鼠内耳细胞的研究[J/CD].中华细胞与干细胞杂志:电子版, 2016, 6(5):302-306.

