人脐带间充质干细胞对肝移植术后缺血性胆管炎的疗效观察
张英才曾凯宁傅斌生张彤汪国营张彤陈良刘畅彭延文姜楠易述红张剑汪根树李华张琪杨扬陈规划
·论著·
人脐带间充质干细胞对肝移植术后缺血性胆管炎的疗效观察
张英才1曾凯宁1傅斌生1张彤1汪国营1张彤1陈良1刘畅2彭延文2姜楠1易述红1张剑1汪根树1李华1张琪2杨扬1陈规划1
目的 探讨人脐带间充质干细胞(MSC)治疗肝移植术后缺血性胆管炎(ITBL)的安全性和初步疗效。方法 选取中山大学附属第三医院2013年1月至2014年12月期间12例肝移植术后ITBL患者,每例患者通过外周静脉输注6次MSC(1.0×106/kg)。从第1次MSC输注开始,所有患者随访至少随访48周。观察与MSC输注相关的短期和长期不良事件。通过肝功能等检测,评估MSC治疗ITBL的初步效果。患者治疗前后肝功能数据的比较采用单向方差分析。结果 随访到2015年3月截至,平均随访时间为(20.1±4.2)个月。除1例出现自限性发热(37.6℃)外,未发现与MSC相关的不良事件,无患者死亡和移植物丢失。与治疗前基线比较,12例患者总胆红素在20周评估时有7例(58.3﹪)好转,3例稳定(25.0﹪)和2例(16.7﹪)恶化;在48周评估时有7例(58.3﹪)好转,2例(16.7﹪)稳定和3例(25.0﹪)恶化(F = 2.917,P = 0.068)。结论 MSC在肝移植患者应用是安全可行的,初步结果提示其对ITBL患者具有较好的短期治疗效果,有望成为治疗ITBL新的治疗手段。
间质干细胞; 脐带; 胆管炎; 肝移植
缺血性胆管炎(ischemic-type biliary lesions,ITBL)是指肝移植术后移植肝非吻合技术性的胆管树破坏、狭窄或梗阻,不伴动脉血栓,ABO血型不符及原发性硬化性胆管炎等[6]。ITBL是肝移植术后最难处理的胆道并发症,也是导致移植物丢失的主要原因之一。ITBL的发生率在不同的研究差别很大,从1﹪~ -26﹪不等[1-5],原因可能是不同的研究对ITBLs诊断标准不同有关。ITBL的治疗目前缺乏规范标准,药物(熊去氧胆酸、抗生素),通过内镜或介入的胆汁引流和手术(部分肝切除,肝肠引流)等治疗对部分均有一定的疗效。但是这些传统治疗手段效果甚微,超过50﹪的患者最终需要行再次肝移植[7-8]。由于间充质干细胞(mesenchymal stem cells,MSC)具有强大的免疫调节[9-17]和促进组织修复[18-24]等生物学特性,而ITBL发病的主要机制是胆管缺血和免疫损伤导致的胆管破坏。因此本研究探讨利用人脐带来源的间充质干细胞(umbilical cord-derived mesenchymal stem cells,UC-MSC)治疗肝移植术后ITBL的安全性和可行性,并初步评估其疗效。
资料与方法
一、患者基本信息
此临床研究已通过中山大学附属第三医院伦理委员会审核同意,在ClinicalTrials.gov的注册编号为:NCT02223897。选取中山大学附属第三医院肝脏外科从2013年1月至2014年12月行肝移植的患者12例,男性11例,女性1例,平均年龄(47.3± 10.1)岁,术后均出现ITBL的时间为(45.2±22.6)d,乙肝肝硬化9例,丙肝肝硬化2例,乙肝合并酒精性急性肝衰1例。所有患者均签署了知情同意书,患者的基本情况见表1。入选标准包括:(1)18~70岁;(2)首次肝移植;(3)术后胆道造影明确诊断为ITBL;(4)愿意参加此项研究并签署知情同意书。排除标准包括:(1)存在未控制的感染;(2)供受体ABO血型不符;(3)术后出现肝动脉血栓形成;(4)原发疾病为恶性肿瘤或原发性胆汁性肝硬化;(5)未能完成随访计划。
表1 TBIL、γGT和ALP水平在UC-MSC治疗前后的比较(± s)
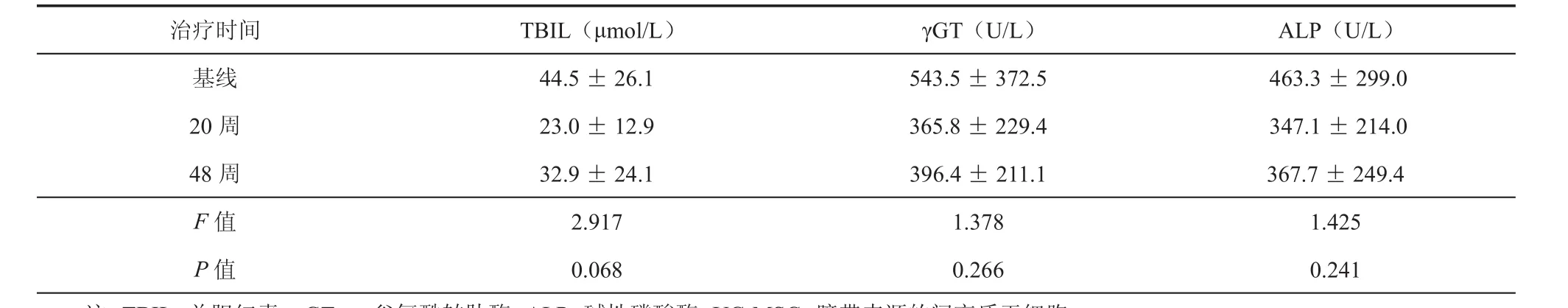
表1 TBIL、γGT和ALP水平在UC-MSC治疗前后的比较(± s)
注:TBIL:总胆红素;γGT:γ-谷氨酰转肽酶;ALP:碱性磷酸酶;UC-MSC:脐带来源的间充质干细胞
治疗时间TBIL(μmol/L)γGT(U/L)ALP(U/L)基线44.5 ± 26.1543.5 ± 372.5 463.3 ± 299.0 20周23.0 ± 12.9365.8 ± 229.4 347.1 ± 214.0 48周32.9 ± 24.1396.4 ± 211.1367.7 ± 249.4 F 值2.9171.3781.425 P 值0.0680.2660.241
二、UC-MSC的获取和输注
脐带取自中山大学附属第三医院产科正常足月产健康婴儿。取脐带之前签署由本院伦理委员会批准的患者知情同意书。脐带的处理和UCMSC的准备均在我院生物治疗中心符合GMP标准的干细胞实验室进行。干细胞的分离、培养、扩增方法详见文献报道[25-26]。在脐带获取后和UCMSC输注前均严格质量控制,包括细菌、真菌培养和病毒监测(包括HBV、HCV、HIV和 人CMV)。所有ITBL患者均应用病原体检测阴性的第四代UC-MSC。每个患者共接受6次UC-MSC输注,时间点分别为入组后的1,2,4,8,12和16周。每次细胞数为1.0×106/kg并溶于100 ml生理盐水通过外周静脉输注。UC-MSC输注前1周的肝功能指标做为基线资料。
三、患者随访
所有患者在胆管造影明确诊断为ITBL后,给与熊去氧胆酸、腺苷蛋氨酸和前列腺素E等药物处理,同时予UC-MSC治疗,输注后至少随访48周以上。观察UC-MSC输注相关的短期和长期不良反应。在第20周和48周时通过肝功能检测评估
MSC治疗ITBL的初步效果。
四、统计学分析方法
采用SPSS 20.0统计学软件进行分析。年龄、随访和肝功能指标等采用± s表示。患者治疗前后肝功能数据的比较采用单向方差分析。以P < 0.05为差异有统计学意义。
结 果
一、UC-MSC输注的安全性
所有细胞治疗都非常关注安全性问题。UCMSC输注后短期不良事件可能包括发热、过敏反应、血栓形成和低血压等。12例患者总共72次细胞输注,仅1例患者在第3次输注细胞3 h后出现自限性发热(37.6℃),无需药物干预下4 h后发热完全消退。没有观察到过敏反应和低血压现象。同样,在整个随访期间也没有观察到长期不良事件的发生(新发肿瘤和机会性感染)。
二、肝功能检测
本研究选择胆道酶学指标包括总胆红素(total bilirubin,TBIL),γ-谷氨酰转肽酶(γ-glutamyl transferase,γGT)和碱性磷酸酶(alkaline phosphatase,ALP)水平的变化来评估UC-MSC治疗肝移植术后ITBL的治疗效果。与基线水平比较,12例患者肝功TBIL在20周评估时有7例好转,3例稳定和2例恶化;在48周评估时有7例好转,2例稳定和3例恶化。γGT和ALP水平也在治疗前后也具有类似的结果。
三、移植物存活
所有患者随访到2015年3月截至,平均随访时间为(20.1±4.2)个月。所有患者随访至少1年以上,未出现患者死亡或移植物丢失。
讨 论
MSC的免疫调节和促进组织再生的生物学特性已经被大量动物移植模型所证实,但是干细胞在临床器官移植的转化应用上经验有限[13-14,16-17]。在临床肝移植领域,目前尚未见MSC为基础的细胞治疗。本研究目的是明确MSC应用于肝移植术后患者的安全性和可行性,及评估MSC治疗肝移植术后ITBL的疗效。本研究没有选择骨髓或其他患者自体组织来源的MSC,而是选择异体脐带来源的MSC,是因为本研究的12例患者均感染了HBV或(和)HCV,造成患者自体来源的MSC扩增后均可能携带病原体,输注后存在二次感染的风险;脐带来源MSC取材容易,来源广泛,伦理争议较少,且MSC是低免疫原性的干细胞(不表达HLA-DR,低表达HLA-ABC),不易发生排斥反应。在这项研究中,12例ITBL患者,每人共6次通过静脉输注MSC,未发现有过敏反应、低血压和静脉血栓形成等不良反应。仅有1例出现自限性发热(37.6℃)。总体而言,肝移植术后患者输注MSC具有较好的耐受性。另外,MSC治疗的中远期不良事件也是特别需要关注的,尤其在器官移植患者。因为过度的免疫抑制和MSC在体内可能存在的异常转分化,理论上可引起机会性感染和新发恶性肿瘤。有趣的是,有几项研究发现MSC在调节抗炎反应的同时,可同时增强抗微生物的自然免疫能力[27-30]。Reinders等[13]报道了6例肾移植术患者应用MSC治疗,其中3例出现MSC输注相关的机会性感染。同样是肾移植术后患者,国内谭建明教授[14]的团队报道的结果则相反,他们发现与对照组(没有用MSC)比较,MSC治疗组的机会性感染发生率明显下降。另外,另一个MSC治疗引起的忧虑是可能增加新发恶性肿瘤的风险。MSC可以通过可溶性细胞因子促进肿瘤生长和降低对肿瘤免疫监测的能力[31-32],这种免疫抑制能力在器官移植受者具有特别的意义,因为这类患者相比其他人群更容易出现恶性肿瘤。基于这点考虑,这项研究只纳入原发疾病为良性终末期肝病的患者。通过超过一年的随访,所有入选病例未发现MSC输注相关的机会性感染和新发恶性肿瘤。某种程度而言,MSC应用于肝移植术后患者是安全的。
本研究还通过监测肝功胆道酶学(包括TBIL、γGT和ALP)初步评估了MSC治疗ITBL的效果。与基数资料对比,20周时TBIL、γGT和ALP水平分别在75.0﹪(9/12)、91.7﹪(11/12)、75.0﹪(9/12)患者出现了下降,仅有2例患者病情出现恶化。在48周时,胆道酶学指标也有改善,但有3例患者病情出现恶化。最重要的是在中位随访时间达到20月以上时,未发现患者死亡和移植物丢失。因此,MSCs治疗在短时间内(20周)具有较好的效果,但是长期效果如何尚待观察。下一步拟招募66例肝移植术后出现ITBLs的患者,开展一项前瞻性对照试验,从而能从更大样本量上评估UC-MSCs治疗ITBLs的长期安全性和有效性。
1 Sanchez-Urdazpal L, Gores GJ, Ward EM, et al. Ischemic-type biliary complications after orthotopic liver transplantation[J]. Hepatology, 1992, 16(1):49-53.
2 Mocchegiani F, Vincenzi P, Lanari J, et al. Immunological risk factors in biliary strictures after liver transplantation[J]. Ann Transplant, 2015, 20:218-224.
3 Nakamura N, Nishida S, Neff GR, et al. Intrahepatic biliary strictures without hepatic artery thrombosis after liver transplantation: an analysis of 1,113 liver transplantations at a single center[J]. Transplantation, 2005, 79(4):427-432.
4 Langrehr JM, Schneller A, Neuhaus R, et al. Etiologic factors and incidence of ischemic type biliary lesions (ITBL) after liver transplantation[J]. Langenbecks Arch Chir Suppl Kongressbd, 1998, 115:1560-1562.
5 Heidenhain C, Pratschke J, Puhl G, et al. Incidence of and risk factors for ischemic-type biliary lesions following orthotopic liver transplantation[J]. Transpl Int, 2010, 23(1):14-22.
6 张英才, 刘剑戎, 许世磊, 等. 一种新型诊断和治疗肝移植术后缺血型胆道病变模式的研究[J]. 中华移植杂志:电子版, 2014, 8(4):6-10.
7 Verdonk RC, Buis CI, Porte RJ. Biliary complications after liver transplantation: A review[J]. Scand J Gastroenterol, 2006, 41(243):89-101.
8 Karimian N, Westerkamp AC, Porte RJ. Biliary complications after orthotopic liver transplantation[J]. Curr Opin Organ Transplant, 2014, 19(3):209-216.
9 Aggarwal S, Pittenger MF. Human mesenchymal stem cells modulate allogeneic immune cell responses[J]. Blood, 2005, 105(4):1815-1822.
10 Krampera M, Glennie S, Dyson J, et al. Bone marrow mesenchymal stem cells inhibit the response of naive and memory antigen-specifi c T cells to their cognate peptide[J]. Blood, 2003, 101(9):3722-3729.
11 Franquesa M, Hoogduijn MJ, Baan CC. The impact of mesenchymal stem cell therapy in transplant rejection and tolerance[J]. Curr Opin Organ Transplant, 2012, 17(4):355-361.
12 Reinders ME, Bank JR, Dreyer GJ, et al. Autologous bone marrow derived mesenchymal stromal cell therapy in combination with everolimus to preserve renal structure and function in renal transplant recipients[J]. J Transl Med, 2014, 12:331.
13 Reinders ME, De Fijter JW, Roelofs H, et al. Autologous bone marrowderived mesenchymal stromal cells for the treatment of allograft rejection after renal transplantation: results of a phase I study[J]. Stem Cells Transl Med, 2013, 2(2):107-111.
14 Tan J, Wu W, Xu X, et al. Induction therapy with autologous mesenchymal stem cells in living-related kidney transplants: a randomized controlled trial[J]. JAMA, 2012, 307(11):1169-1177.
15 Franquesa M, Hoogduijn MJ, Reinders ME, et al. Mesenchymal stem cells in solid organ transplantation (MiSOT) fourth meeting: lessons learned from first clinical trials[J]. Transplantation, 2013, 96(3):234-238.
16 Perico N, Casiraghi F, Introna M, et al. Autologous mesenchymal stromal cells and kidney transplantation: a pilot study of safety and clinical feasibility[J]. Clin J Am Soc Nephrol, 2011, 6(2):412-422.
17 Peng YW, Ke M, Xu L, et al. Donor-Derived mesenchymal stem cells combined with Low-Dose tacrolimus prevent acute rejection after renal transplantation: a clinical pilot study[J]. Transplantation, 2013, 95(1):161-168.
18 Prodromidi EI, Poulsom R, Jeffery R, et al. Bone marrow-derived cells contribute to podocyte regeneration and amelioration of renal disease in a mouse model of Alport syndrome[J]. Stem Cells, 2006, 24(11):2448-2455.
19 Kadner A, Hoerstrup SP, Tracy J, et al. Human umbilical cord cells: a new cell source for cardiovascular tissue engineering[J]. Ann Thorac Surg, 2002, 74(4):S1422-S1428.
20 Corrao S, La Rocca G, Lo Iacono M, et al. New frontiers in regenerative medicine in cardiology: the potential of Wharton's jelly mesenchymal stem cells[J]. Curr Stem Cell Res Ther, 2013, 8(1):39-45. 21 López Y, Lutjemeier B, Seshareddy K, et al. Wharton's jelly or bone marrow mesenchymal stromal cells improve cardiac function following myocardial infarction for more than 32 weeks in a rat model:a preliminary report[J]. Curr Stem Cell Res Ther, 2013, 8(1):46-59.
22 Santos Nascimento D, Mosqueira D, Sousa LM, et al. Human umbilical cord tissue-derived mesenchymal stromal cells attenuate remodeling after myocardial infarction by proangiogenic, antiapoptotic, and endogenous cell-activation mechanisms[J]. Stem Cell Res Ther, 2014, 5(1):5.
23 Du T, Cheng J, Zhong L, et al. The alleviation of acute and chronic kidney injury by human Wharton's jelly-derived mesenchymal stromal cells triggered by ischemia-reperfusion injury via an endocrine mechanism[J]. Cytotherapy, 2012, 14(10):1215-1227.
24 Song M, Heo J, Chun JY, et al. The paracrine effects of mesenchymal stem cells stimulate the regeneration capacity of endogenous stem cells in the repair of a bladder-outlet-obstruction-induced overactive bladder[J]. Stem Cells Dev, 2014, 23(6):654-663.
25 张英才, 杨扬, 杨卿, 等. 人脐带间充质干细胞对脂肪肝大鼠肝脏缺血再灌注损伤的保护作用. 中华普通外科杂志[J]. 2011, 26(3): 241-245.
26 Deng Y, Yi S, Wang G, et al. Umbilical cord-derived mesenchymal stem cells instruct dendritic cells to acquire tolerogenic phenotypes through the IL-6-mediated upregulation of SOCS1[J]. Stem Cells Dev, 2014, 23(17):2080-2092.
27 Plock JA, Schnider JT, Schweizer R, et al. Are cultured mesenchymal stromal cells an option for immunomodulation in transplantation?[J]. Front Immunol, 2013, 4:41.
28 Hall SR, Tsoyi K, Ith B, et al. Mesenchymal stromal cells improve survival during sepsis in the absence of heme oxygenase-1: the importance of neutrophils[J]. Stem Cells, 2013, 31(2):397-407.
29 Mei SH, Haitsma JJ, Dos Santos CC, et al. Mesenchymal stem cells reduce inflammation while enhancing bacterial clearance and improving survival in sepsis[J]. Am J Respir Crit Care Med, 2010, 182(8):1047-1057.
30 Alagesan S, Griffi n MD. Autologous and allogeneic mesenchymal stem cells in organ transplantation: what do we know about their safety and effi cacy?[J]. Curr Opin Organ Transplant, 2014, 19(1):65-72.
31 Bernardo ME, Fibbe WE. Mesenchymal stromal cells: sensors and switchers of infl ammation[J]. Cell Stem Cell, 2013, 13(4):392-402.
32 Leuning DG, Reinders ME, De Fijter JW, et al. Clinical translation of multipotent mesenchymal stromal cells in transplantation[J]. Semin Nephrol, 2014, 34(4):351-364.
Umbilical cord-derived mesenchymal stromal cells transfusion for ischemic-type biliary lesions after liver transplantation:a phase I study
Zhang Yingcai1, Zeng Kaining1, FU Binsheng1, ZhangTong1, Wang Guoying1, Chen Liang1, Liu Chang1, Peng Yanwen1, Jiang Nan1, Yi Shuhong1, Zhang Jian1, Wang Genshu1, Li Hua1, Zhang Qi2, Yang Yang1, Chen Guihua1.1Liver Transplant Center of the Third Affiliated Hospital of Sun Yat-sen University, Organ Transplantation Research Center of Guangdong Province, Guangzhou 510630, China;2Biotherapy Centre of the Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
Objective To evaluate the safety and efficacy of umbilical cord-derived mesenchymal stem cells (UC-MSC) transfusion for patients with ischemic-type biliary lesions (ITBLs) after liver transplantation. Methods From Jan. 2013 to Dec. 2014, 12 recipients developed ITBLs after liver transplantation in our hospital were recruited in this trial. Patients receive six doses of UC-MSCs (about 1.0×106MSCs per kilogram body weight) through peripheral intravenous infusion. Liver function tests were performed to evaluate the progress of ITBLs. Adverse events and graft survival were also observed up to 48 weeks after MSCs transfusion. All data were analyzed by paired sample t-test. Results No significant MSCs-related adverse events and no graft loss were observed during the trial except that fever(37.6℃) was found in one case. Improved, stable and worse outcomes of biliary enzyme index were observed in 58.3﹪ (7/12), 25.0﹪ (3/12) and 16.7﹪ (2/12)
Mesenchymal stromal cells; Umbilical cord; Cholangitis; Liver transplantation
2016-05-23)
(本文编辑:陈媛媛)
10.3877/cma.j.issn.2095-1221.2016.05.003
国家863项目(2012AA02A600);国家自然科学基金(81300365、81370555、81370575、81570593);广东省自然科学基金研究团队项目(2015A030312013);广东省科技计划项目(2015B020226004);广州市科技计划项目-健康医疗协同创新重大专项(158100076, 201400000001-3);中山大学5010计划(2014006)
510630 广州,中山大学附属第三医院肝脏外科暨肝移植中心 中山大学器官移植研究所 广东省器官移植研究中心1,细胞-基因治疗转化医学研究中心2
张琪,Email:kee_kee@126.com;杨扬,Email:yysysu@163.com
patients at 20 weeks, and 58.3﹪ (7/12), 16.7﹪ (2/12) and 25.0﹪ (3/12) patients at 48 weeks after MSC transfusion. Conclusion The UC-MSC transfusions in liver transplant recipients with ITBLs are clinically safe and effective in the short term and may become a promising therapeutic agent for patients with ITBLs after liver transplantation.
张英才,曾凯宁,傅斌生,等. 人脐带间充质干细胞对肝移植术后缺血性胆管炎的疗效观察[J/CD].中华细胞与干细胞杂志:电子版, 2016, 6(5):280-283.

