脉络丛上皮细胞及其神经保护作用
赵世君孙保亮李月春王宝军徐宁
·综述·
脉络丛上皮细胞及其神经保护作用
赵世君1孙保亮2李月春1王宝军1徐宁3
将神经营养因子和生长因子注射到脑损伤区域治疗神经系统变性病和急性脑损伤被证实有效,因此向脑损伤区域移植能够持续释放治疗因子的细胞可能成为一种新兴的治疗脑损伤的方法。脉络丛上皮细胞(CPECs)是构成脉络丛的主要结构成分,不仅参与合成脑脊液和构成血脑脊液屏障,而且能够分泌多种生物活性肽,包括神经营养因子,生长因子以及转运蛋白等。因此移植CPECs可能成为神经系统疾病具有前景的治疗方法。大量的文献已经证实,不管是体外研究还是在体水平,CPECs治疗能够促进神经元生长和增殖,对多种神经系统疾病产生疗效,具有神经保护作用。本文将对CPECs的神经保护作用做一综述,便于今后更好开展工作。
脉络丛; 上皮细胞; 神经生长因子类; 移植
临床实践中神经系统疾病具有难治性的特点,不论是急性发作的脑血管病,还是神经系统慢性变性疾病,有效的治疗方法捉襟见肘。这是因为中枢神经系统本身结构特殊,与血液等体液环境之间存在屏障结构,处于相对隔离的区域,因此一般药物难以通过血脑屏障进入中枢系统而达到治疗作用;而且构成中枢神经系统的神经元再生能力差,使得神经功能的重建更加困难。因此建立一种有效的治疗神经系统疾病的方法,一直是科学家努力的方向。神经修复学是近年兴起的一门新兴学科,以中枢神经可修复理论为基础[1],而细胞移植治疗可能成为该学科的核心的技术,2016年发表了《中国神经修复细胞治疗临床应用指南》,为神经系统疾病的细胞治疗提出临床上的理论指导[2],细胞移植治疗神经系统疾病成为极具前景的治疗方法。
脉络丛是中枢神经系统的一部分,位于脑室,居于整个系统的中心位置。脉络丛上皮细胞(choroid plexus epithelial cells,CPECs)是脉络丛主要的结构和功能成分,发挥多种生理功能,且可能参与多种神经系统疾病的病理过程[3-7]。因此随着对脉络丛及其上皮细胞研究的深入,CPECs替代治疗或补偿治疗成为可能,现将CPECs与神经保护方面的研究做一回顾,期望能为今后更好地开展这
方面工作提供帮助。
一、CPECs概述
(一)脉络丛上皮的基本结构
在脑室系统内室管膜上皮细胞,微血管和间质共同构成脉络组织,然后反复分支成丛突入脑室,簇集形成脉络丛[8]。构成脉络丛的室管膜上皮细胞与脑室壁的室管膜上皮细胞在结构与功能上存在差异,因此这部分室管膜上皮细胞称为CPECs。CPECs是脉络丛的主要结构成分,此外还含有富含有窗毛细血管的基质[9](图1)。CPECs具有多种转运通道因此具有转运功能,而且富含线粒体及吞饮小泡。上皮细胞顶端具有微绒毛,主要的功能是分泌脑脊液。相邻上皮细胞的顶端形成紧密连接,是血脑脊液屏障的主要结构,仅可通过分子量较小的物质。(图2)
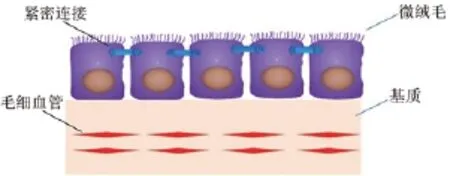
图1 脉络丛主要结构
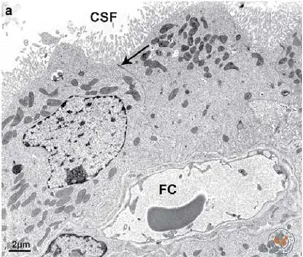
图2 鼠脉络丛电镜结构[10]
(二)CPECs的生理功能
脉络丛的主要功能是分泌脑脊液,发挥功能的主要成分是CPECs。一般认为70﹪~ 85﹪的脑脊液由脉络丛产生。CPECs的结构特征决定血液中的离子或分子是主动运输,水是被动运输。脑脊液先经过血管内皮细胞的窗孔和细胞间隙进入基质,再经过CPECs侧面和底面进入上皮细胞,再由胞质内的小泡将其送到细胞顶端的微绒毛。CPECs分泌时,微绒毛内的吞饮小泡破裂将这些物质排入脑室,形成脑脊液[11]。
中枢神经系统内存在三大屏障,血-脑屏障,血-脑脊液屏障,脑脊液-脑屏障。CPECs及其紧密连接是构成血脑脊液屏障的主要结构基础,通过机械阻挡,异生性溶解,主动运输机制发挥屏障作用。水,气体,脂溶性物质可以从血液中自由进入脑脊液,大分子物质,离子等不能直接进入脑脊液。
近年提出脑-脑脊液神经体液通路,是指由脑脊液中介的神经体液通路,属于神经体液调节的一部分[12]。主要结构基础是接触脑脊液的神经元、室管膜细胞及脑-脑脊液屏障的选择性。CPECs属于特化的室管膜上皮细胞,具有内分泌功能,参与这条通路。CPECs含有多种受体[13](表1),可以接受各种因子的调控;同时在CPECs中发现多种生物活性多肽[13],包括神经营养因子(表2),可以分泌到脑脊液中,对自身或邻近的靶细胞,或通过脑脊液循环到达远端的靶细胞产生作用,起到自分泌或旁分泌的生理功能。

表1 脉络丛上皮细胞含有的受体及其配体
研究认为侧脑室壁上的室管膜和室管膜下的区域是干细胞的来源[14],CPECs作为这些结构的延伸,同样具有显著的神经再生能力。Li等[15]证明,CPECs在脑卒中鼠模型中发生增殖和分化。大鼠大脑中动脉结扎后,溴脱氧尿苷免疫反应性增加(作为神经细胞核抗原),胶质纤维酸性蛋白免疫反应性也增加,这些反应提示细胞发生了增生与分化。移植研究也表明,当CPECs移植到中枢神经系统的损伤区域,CPECs具有分化的能力。Kitada等[16]从绿色荧光蛋白转基
因小鼠分离得到CPECs,并把它移植到同种鼠类制造的脊髓损伤模型。1周后,免疫组化提示,绿色荧光蛋白阳性移植细胞呈现出对神经胶质酸性蛋白阳性反应。2周后,免疫电镜显示,绿色荧光蛋白阳性移植细胞(对神经胶质酸性蛋白呈现出免疫组化反应阳性)包含了大量神经丝束(一种星形胶质细胞的形态学结构),并与宿主细胞接触,这个结构和生物学特性是星形胶质细胞所有。此外,CPECs在缺血性损伤后表现出自我修复的能力,因为CPECs能够分泌多种生长因子和多肽,而且CPECs上具有的多种生长因子受体,通过旁分泌和自分泌的机制,损伤在营养因子的作用得到恢复[17]。

表2 脉络丛上皮细胞含有多肽
此外,CPECs还具有解毒功能,中和有毒物质,防御急性中毒损伤;还能监视大脑的免疫和化学状态,以及调节脑脊液与大脑之间的物质交换,使得大脑所处的细胞外环境稳定等功能。
二、CPECs的原代培养与鉴定方法
CPECs的原代培养始于20世纪70年代[18]。最初体外CPECs及细胞系的培养多应用于毒理学的研究[19-20]。目前应用于神经系统疾病模型的CPECs主要来源于鼠,因此本文主要介绍鼠CPECs的原代培养与鉴定。
(一)CPECs的原代培养
1.分离与培养:动物实验中多选择成年鼠采集脉络丛组织。成年鼠脉络丛组织发育成熟,结构较致密,采集后需要链蛋白酶或胰蛋白酶进一步消化组织以分离细胞。在培养过程中,主要混杂的细胞有血细胞和成纤维细胞,血细胞不贴壁,经过2次换液后,红细胞基本消失;而成纤维细胞贴壁时间早于CPECs约6 ~ 12 h[21],因此可以根据这种贴壁速度的差异去除成纤维细胞,但容易损失上皮细胞。去除这两种细胞可以得到高纯度的CPECs。细胞长成一般需要7到14 d。
也有文献报道[22]选用出生1 d的新生鼠,容易得到高纯度的原代细胞。首先因为新生鼠脉络丛组织较疏松,仅需要机械分离而不需要酶消化组织,避免了细胞污染或损伤;其次,新生鼠脉络丛组织混杂的细胞特别少,不需要特意去除成纤维细胞液就可以得到纯度高的原代细胞;再次,新生鼠CPECs活性高,容易成活及增殖。但是缺点是新生鼠发育不完全,脉络丛组织少,取材难。
2.培养液:目前普遍使用的培养液配制方案为:89﹪改良杜氏伊格尔培养基,加上10﹪的胎牛血清,并含有1﹪的青霉素和链霉素和10 mg/ml的内皮生长因子。
(二)CPECs的鉴定
在中枢神经系统中甲状腺素转运蛋白在CPECs特异性表达,含量特别丰富[23-25],因此实验中常使用甲状腺素转运蛋白抗体进行免疫组织化学染色作为CPECs鉴定的方法(图3)。此外还可以通过HE染色以及电子显微镜观察CPECs形态学特点。
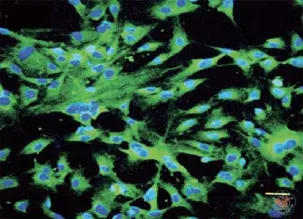
图3 免疫组织化学法显示原代培养的CPECs[22]
三、脉络从上皮细胞与神经保护
CPECs发挥多种基本的生理功能,维持神经系统处于相对的稳态,提示CPECs具有神经保护功能。关于CPECs神经保护的研究目前仅限于在实验室,临床上尚未开展。本文就CPECs与神经保护的研究分为体外研究和在体研究两部分进行介绍。
(一)体外实验
体外培养的CPECs具有显著的神经保护功能。Kimura等[26]将大鼠海马神经元与CPECs共培养,观察海马神经元的生长和存活情况,经过比较得出结论,CPECs与星
形胶质细胞一样能够明显促进海马神经元突起的生长,维持神经元的存活。免疫组织化学分析发现CPECs表达层粘连蛋白和纤连蛋白,这些分子有助于海马神经突起的延伸;在细胞表面检测到神经元细胞黏附分子和神经元钙粘蛋白,这些分子分布于海马神经元突起与施万细胞和轴突与轴突之间,有助于海马神经突起向CPECs细胞表面延伸而得以生长。此外,研究者发现海马神经元能够在CPECs的条件培养基(CPECs被乙醇灭活)中短暂生长并存活,考虑可能是因为CPECs分泌的神经营养因子及细胞膜表面的分子促进了海马的生长。因为研究已经证实,CPECS可以分泌多种神经营养因子[27-30]。
Kimura等[26]没有对条件培养基(培养CPECs的上清液)做更深入的研究,因此之后有科学家做了进一步工作。Watanabe等[31]将幼鼠的海马神经元培育在CPECs的条件培养基中得到良好的生长。对培养基的成分经过仔细分析,发现能够促进神经细胞存活的主要是分子量大于50 kDa的多肽或蛋白,而不是微小的化学物质。并且鉴定出4种CPECs含有的生长因子。该研究在体外更进一步证实CPECs的神经保护作用。
Aliaghaei等[32]的体外实验进一步证实了CPECs强大的神经保护作用,并探讨了保护机制。以嗜铬细胞瘤类神经元细胞模拟神经元并给予双氧水造成氧化应激损伤,给予条件培养基干预,结果显示可以明显抑制氧化损伤引起的细胞凋亡。首先从细胞形态学观察,治疗组嗜铬细胞瘤类神经元细胞轴突明显生长,认为是CPECs条件培养中含有的物质起到主要作用,一是层粘连蛋白和纤连蛋白为轴突的延伸提供支撑作用,二是一些细胞因子如甲状腺素转运蛋白[33]、脑源性神经营养因子、胶质细胞源性神经营养因子、神经生长因子、成纤维细胞生长因子2和血管内皮生长因子可以起到营养细胞,促进细胞轴突延伸的作用,并且反转录聚合酶链式反应证实在CPECs中存在上述因子mRNA的表达。其次,众所周知核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是细胞防御多种应激损伤的关键转录因子,是诱导II相酶基因表达的必需调节因子,该研究用蛋白质印迹(western blotting)等方法鉴定认为CPECs发挥抗氧化应激损伤的主要机制,主要是激活了Nrf2/ 抗氧化反应原件(antioxidant response elements,ARE)通路,Nrf2在应激状态下易位进入细胞核,激活ARE相关因子,如γ谷氨酸半胱氨酸能够对抗活性氧簇的毒性作用,阻止自由基的产生(图4)。同时CPECs的分泌物也增加了超氧化物气化酶和谷胱甘肽的活力,提高了抗氧化损伤的能力。此外结合对抗凋亡因子Bcl2和促凋亡因子Bax和caspase-3的检测结果,也证实了CPECs的抗凋亡作用。
(二)CPECs在动物模型的应用
体外实验证实了CPECs具有神经保护作用,因此CPECs在动物模型的应用引起科学家的兴趣。在体实验研究主要借助移植方法。同种移植应用在脑卒中,神经系统变性疾病等动物模型,显示出良好的神经保护作用。有时为了避免或减轻移植引起的免疫排斥反应,尤其在异种移植之间,可借助藻酸盐胶囊化CPECs,实现异种间移植,也发挥出CPECs的神经修复功能。
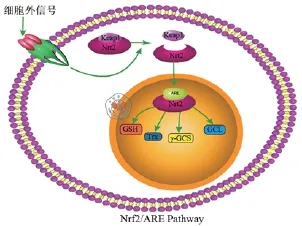
图4 Nrf2/ ARE通路
1.对脊髓损伤的保护作用及机制:Ide等[34]首次成功地将CPECs移植到脊髓损伤模型,显示出明显的神经修复能力,这也是CPECs移植的首次尝试。将CPECs移植到受损伤的脊髓后索,观察到CPECs在损伤区域生存良好,而且损伤的脊髓细胞发生明显的轴突生长,而且这种良性的作用能持续10个月之久。该团队的另一个发现如上述提到,CPECs还具有分化成为胶质细胞的能力,这对于脊髓功能的重建具有意义。
最近Kanekiyo等[35]将CPECs应用到脊髓挫伤模型当中,同样观察到CPECs移植后促进了脊髓轴突的再生,改善了脊髓功能。作者认为CPECs可能通过分泌某些分子物质进入脑脊液,促进了损伤脊髓轴突的再生,同时也阻止了脊髓损伤后的神经变性。
2.对缺血性脑卒中的保护作用及机制:脉络丛在脊髓模型移植的成功,引起科学家的注意。Borlongan等[36]将鼠CPECs胶囊化后移植到鼠MCAO(大脑中动脉阻塞)模型当中,治疗组梗塞面积明显缩小,神经功能损伤程度也小于对照组,显示出CPECs显著的抗缺血,脑保护作用。这是CPECs首次应用于脑卒中模型,并且取得了良好的治疗作用。该团队几乎在同时做了另一项研究,将猪的脉络丛细胞胶囊化后移植到鼠MCAO模型,同样缩小了梗塞面积,改善了神经功能,这为异种之间的移植开启新的希望。关于脑保护的机制,作者认为脉络丛细胞可以分泌多种具有治疗作用的物质,如神经营养因子,生长因子等,具有对抗脑缺血的作用。
另一项CPECs应用在脑卒中的研究同样证实,CPECs具有抗急性脑缺血的作用,减少了神经元的死亡,并且对发
病机制做了更进一步的探讨。借助免疫组织化学法、PCR等技术,认为CPECs移植后促进了抗凋亡因子的表达,如CREB和bcl-2水平明显增高,并且抑制了促炎因子IL-1和TNF-α以及氧化应激因子iNOS的表达,通过以上途径抑制神经元凋亡,发挥脑保护作用[37]。
3.对神经系统变性疾病的保护作用及机制:CPECs移植对急性脑血管病显现出神经保护作用,对于神经系统变性疾病,如阿尔茨海默病,亨廷顿病(huntington Disease,HD)等,科学家也在尝试脉络丛细胞在这些疾病模型中的作用。Borlongan等[38]首次将猪的CPECs胶囊化后移植到鼠HD模型,在治疗组当中喹啉酸诱导的纹状体梗塞面积明显缩小,体重和运动功能均有改善,作者认为可能是CPECs分泌的营养性因子发挥了神经保护作用,因为之前的研究显示向HD模型投递神经营养因子具有改善HD症状的疗效[39]。之后该团队还做了一系列的动物实验[40-41]将猪的脉络丛胶囊化后移植到猴HD模型,或是将鼠的脉络丛胶囊化后移植到鼠HD模型,同样显示了脉络丛的保护作用,更进一步证明了CPECs对HD模型的神经修复功能。
阿尔茨海默病也是常见的神经系统变性病,临床上对于该疾病的治疗缺乏有效的手段。Aliaghaei等[42]将CPECs移植到阿尔茨海默病模型探讨对其的影响。结果显示治疗组认知功能明显好转,因为CPECs移植到海马损伤区域后抑制了神经炎性反应,提高了抗氧化应激能力,从而减少了海马神经元的凋亡,改善了模型的认知功能。免疫组织化学等方法鉴定神经胶质细胞以及其增生和迁移等反应,显示Aβ诱导海马损伤后神经胶质细胞增生反应变弱,小胶质细胞的迁移反应变少,这提示神经炎性反应被抑制,有利于神经细胞的再生,因为有文献报道CPECs分泌的生长因子如转化生长因子-β,可以通过清除Aβ抑制胶质细胞的增生和迁移[43]。测定氧化还原酶活性增加,提示CPECs提高了抗氧化损伤的能力,作者还认为CPECs分泌的生长因子,如NGF与Nrf2/ARE通路及其下游的因子存在相互联系,发挥抗氧化损伤作用[44]。此外还有文献证实脑源性神经营养因子,VEGF,和NGF在除Nrf2之外的通路中调节氧化应激反应,发挥抗氧化损伤功能[45-47]。利用蛋白免疫印迹法同时证实,Caspase-3在治疗组表达减少。对凋亡细胞的原位末端标记法鉴定也证实治疗组海马神经元凋亡明显减少。
目前,不论是CPECs的体外实验,还是移植到动物模型的实验,均能够证实脉络丛细胞具有神经保护作用。但是其神经修复的机制目前的研究还不够充分和具体,今后应该把握目前先进的实验室技术,对CPECs在促进神经再生,抗凋亡,抗氧化应激,抗炎等方面的分子机制做详细的研究。此外,关于人脉络丛细胞研究的相关资料较少,今后也可以开展脉络丛细胞在细胞水平或模型中的应用研究,为脉络丛细胞的临床应用提供基础理论。相信随着对CPECs更加细致,深入的研究,对于其在临床的应用将成为可能,为神经系统疾病的治疗带来新的希望。
1 黄红云,Hari Shanker Sharma.神经修复学:一个新的充满希望的神经科学和医学前沿学科[J/CD].中华细胞与干细胞杂志:电子版, 2015, 5(1):65-66.
2 中国医师协会神经修复学专业委员会.中国神经修复细胞治疗临床应用指南(2015年版)[J/CD].中华细胞与干细胞杂志:电子版, 2016, 6(1):1-7.
3 Emerich DF, Skinner SJ, Borlongan CV, et al. The choroid plexus in the rise, fall and repair of the brain [J]. Bioessays, 2005, 27(3):262-274.
4 Ferrand-Drake M. Cell death in the choroid plexus following transient forebrain global ischemia in the rat[J]. Microsc Res Tech, 2001, 52(1):130-136.
5 Preston JE. Ageing choroid plexus-cerebrospinal fluid system[J]. Microsc Res Tech, 2001, 52(1):31-37.
6 Serot JM, Béné MC, Faure GC. Choroid plexus, ageing of the brain, and Alzheimer's disease[J]. Front Biosci, 2003, 8:s515-s521.
7 Engelhardt B, Wolburg-Buchholz K, Wolburg H. Involvement of the choroid plexus in central nervous system infl ammation[J]. Microsc Res Tech, 2001, 52(1):112-129.
8 王玮, 赵小贞. 中枢神经功能解剖学 [M] . 北京: 科学出版社, 2013: 233.
9 Benarroch EE. Choroid plexus-CSF system Recent developments and clinical correlations[J]. Neurology, 2016, 86(3):286-296.
10 Scott DE, Kozlowski GP, Sheridan MN. Scanning electron microscopy in the ultrastructural analysis of the mammalian cerebral ventricular system [J]. Int Rev Cytol, 1974, 37(0):349-388.
11 芮德源, 陈立杰. 临床神经解剖学[M]. 北京: 人民卫生出版社, 2007: 511.
12 Skipor J, Thiery JC. The choroid plexus-cerebrospinal fluid system: undervaluated pathway of neuroendocrine signaling into the brain[J]. Acta Neurobiol Exp (Wars), 2008, 68(3):414-428.
13 Chodobski A, Szmydynger-Chodobska J. Choroid plexus:Target for polypeptides and site of their synthesis[J]. Microsc Res Tech, 2001, 52(1):65-82.
14 Chiasson BJ, Tropepe V, Morshead CM, et al. Adult mammalian forebrain ependymal and subependymal cells demonstrate proliferative potential, but only subependymal cells have neural stem cell characteristics[J]. J Neurosci, 1999, 19(11):4462-4471.
15 Li Y, Chen JL, Chopp M. Cell proliferation and differentiation from ependymal, subependymal and choroid plexus cells in response to stroke in rats[J]. J Neurol Sci, 2002, 193(2):137-146.
16 Kitada M, Chakrabortty S, Matsumoto N, et al. Differentiation of choroid plexus epeadymal cells into astrocytes after grafting into the pre-lesioned spinal cord in mice[J]. Glia, 2001, 36(3):364-374.
17 Johanson CE, Palm DE, Primiano MJ, et al. Choroid plexus recovery after transient forebrain ischemia: role of growth factors and other repair mechanisms[J]. Cell Mol Neurobiol, 2000, 20(2):197-216.
18 Nathanson JA. Beta-adrenergic-sensitive adenylate cyclase in secretory cells of choroid plexus[J]. Science, 1979, 204(4395):843-844.
19 Zheng W, Zhao Q, Graziano JH. Primary culture of choroidal epithelial cells: Characterization of an in vitro model of blood-CSF barrier[J]. In Vitro Cell Dev Biol Anim, 1998, 34(1):40-45.
20 Shi LZ, Zheng W. Early lead exposure increases the leakage of the blood-cerebrospinal fl uid barrier, in vitro[J]. Hum Exp Toxicol, 2007, 26(3):159-167.
21 Monnot AD, Zheng W. Culture of choroid plexus epithelialcells and in vitro model of blood-CSF barrier[M]. Methods Mol Biol, 2013, 945: 13-29.
22 Huang SL, He XJ, Li ZF, et al. A novel primary culture method for rat choroidal epithelial cells[J]. Neurosciences(Riyadh), 2013, 18(1):27-32. 23 Aldred AR, Brack CM, Schreiber G. The cerebral expression of plasma protein genes in different species[J]. Comp Biochem Physiol B Biochem Mol Biol, 1995, 111(1):1-15.
24 Herbert J, Wilcox JN, Pham KT, et al. Transthyretin: a choroid plexusspecifi c transport protein in human brain. The 1986 S. Weir Mitchell award[J].Neurology, 1986, 36(7):900-911.
25 Nilsson C, Lindvall-Axelsson M, Owman C. Neuroendocrine regulatory mechanisms in the choroid plexus-cerebrospinal fluid system [J]. Brain Res Brain Res Rev, 1992, 17(2):109-138.
26 Kimura K, Matsumoto N, Kitada M, et al. Neurite outgrowth from hippocampal neurons is promoted by choroid plexus ependymal cells in vitro[J]. J Neurocytol, 2004, 33(4):465-476.
27 Timmusk T, Mudò G, Metsis M, et al. Expression of mRNAs for neurotrophins and their receptors in the rat choroid plexus and dura mater[J]. Neuroreport, 1995, 6(15):1997-2000.
28 Hynes MA, Brooks PJ, Van Wyk JJ, et al. Insulin-like growth factor II messenger ribonucleic acids are synthesized in the choroid plexus of the rat brain[J]. Mol Endocrinol, 1988, 2(1):47-54.
29 Nilsson C, Hultberg BM, Gammeltoft S. Autocrine role of insulin-like growth factor II secretion by the rat choroid plexus[J]. Eur J Neurosci, 1996, 8(3):629-635.
30 Cuevas P, Gimenez-Gallego G, Martinez-Murillo R, et al. Immunohistochemical localization of basic fibroblast growth factor in ependymal cells of the rat lateral and third ventricles[J]. Acta Anat (Basel), 1991, 141(4):307-310.
31 Watanabe Y, Matsumoto N, Dezawa M, et al. Conditioned medium of the primary culture of rat choroid plexus epithelial (modified ependymal) cells enhances neurite outgrowth and survival of hippocampal neurons [J]. Neurosci Lett, 2005, 379(3):158-163.
32 Aliaghaei A, Khodagholi F, Ahmadiani A. Conditioned media of choroid plexus epithelial cells induces Nrf2-Activated phase II antioxidant response proteins and suppresses oxidative Stress-Induced apoptosis in PC12 cells [J]. J Mol Neurosci, 2014, 53(4):617-625.
33 Fleming CE, Saraiva MJ, Sousa MM. Transthyretin enhances nerve regeneration[J]. J Nerurochem, 2007, 103(2):831-839.
34 Ide C, Kitada M, Chakrabortty S, et al. Grafting of choroid plexus ependymal cells promotes the growth of regenerating axons in the dorsal funiculus of rat spinal cord: a preliminary report [J]. Exp Neurol, 2001, 167(2):242-251.
35 Kanekiyo K, Nakano N, Noda T, et al. Transplantation of choroid plexus epithelial cells into contusion-injured spinal cord of rats[J]. Restor Neurol Neurosci, 2016, 34(3):347-366.
36 Borlongan CV, Skinner SJ, Geaney M, et al. CNS grafts of rat choroid plexus protect against cerebral ischemia in adult rats[J]. Neuroreport, 2004, 15(10):1543-1547.
37 Matsumoto N, Taguchi A, Kitayama HA, et al. Transplantation of cultured choroid plexus epithelial cells via cerebrospinal fl uid shows prominent neuroprotective effects against acute ischemic brain injury in the rat[J]. Neurosci Lett, 2010, 469(3):283-288.
38 Borlongan CV, Skinner SJ, Geaney M, et al. Neuroprotection by encapsulated choroid plexus in a rodent model of Huntington's disease [J]. Neuroreport, 2004, 15(16):2521-2525.
39 Kells AP, Fong DM, Dragunow M, et al. AAV-mediated gene delivery of BDNF or GDNF is neuroprotective in a model of Huntington disease [J]. Mol Ther, 2004, 9(5):682-688.
40 Emerich DF, Thanos CG, Goddard MA, et al. Extensive neuroprotection by choroid plexus transplants in excitotoxin lesioned monkeys[J]. Neurobiol Dis, 2006, 23(2):471-480.
41 Borlongan CV, Thanos CG, Skinner SJ, et al. Transplants of encapsulated rat choroid plexus cells exert neuroprotection in a rodent model of Huntington's disease[J]. Cell Transplant, 2007, 16(10):987-992.
42 Aliaghaei A, Digaleh H, Khodagholi F, et al. Encapsulated choroid plexus epithelial cells actively protect against intrahippocampal aβinduced long-term memory dysfunction; upregulation of effective neurogenesis with the abrogated apoptosis and neuroinfl ammation[J]. J Mol Neurosci, 2015, 56(3):708-721.
43 Mandrekar-Colucci S, Landreth GE. Microglia and inflammation in alzheimer's disease[J]. CNS Neurol Disord Drug Targets, 2010, 9(2):156-167.
44 Mimura J, Kosaka K, Maruyama A, et al. Nrf2 regulates NGF mRNA induction by carnosic acid in T98G glioblastoma cells and normal human astrocytes [J]. J Biochem, 2011, 150(2):209-217.
45 Salinas M, Diaz R, Abraham NG, et al. Nerve growth factor protects against 6-hydroxydopamine-induced oxidative stress by increasing expression of heme oxygenase-1 in a phosphatidylinositol 3-kinasedependent manner[J]. J Biol Chem, 2003, 278(16):13898-13904.
46 Hao T, Rockwell P. Signaling through the vascular endothelial growth factor receptor VEGFR-2 protects hippocampal neurons from mitochondrial dysfunction and oxidative stress[J]. Free Radic Biol Med, 2013, 63:421-431.
47 Numakawa T, Kumamaru E, Adachi N, et al. Glucocorticoid receptor interaction with TrkB promotes BDNF-triggered PLC-gamma signaling for glutamate release via a glutamate transporter[J]. Proc Natl Acad Sci U S A, 2009, 106(2):647-652.
Choroid plexus epithelial cells and its neuroprotective effects
Zhao Shijun1, Sun Baoliang2,Li Yuechun1, Wang Baojun1, Xu Ning3.1Department of Neurology,3Hematology, Baotou Central Hospital, Baotou 014040, China;2Key Lab of Cerebral Microcirculation in Universities of Shandong, Taishan Medical University, Taian 271000, China
Treatment with neurotrophins and growth factors through injection to brain lesion sites has been demonstrated effective for neurodegenerative disease and acute brain injury. Transplantation of viable neurotrophin-producing cells to the brain lesion sites represents one of the most promising strategies for brain injury due to the continuous production of therapeutic factors. Choroid plexus epithelial cells (CPECs), an important component of choroid plexus, not only involve in the cerebrospinal fluid (CSF) synthesis and blood-brain barrier constitution, but also secret a variety of bioactive peptides, such as neuropeptides, growth factors, and cytokines, which exhibit therapeutic potential against brain injury. Accumulated evidences have demonstrated that CPECs can promote the growth and proliferation of neurons in vitro and in vivo, and has neuroprotective effects on a variety of neurological diseases. Hence, we will review the neuroprotective effects of CPECs, so as to facilitate the future work.
Choroid plexus; Epithelial cells; Nerve growth factors; Transplantation
2016-08-11)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2016.05.011
014040 包头市中心医院神经内科1,血液内科3;271000泰安 泰山医学院脑微循环实验室2
孙保亮,Email:blsun88@163.com
赵世君,孙保亮,李月春,等. 脉络丛上皮细胞及其神经保护作用[J/CD].中华细胞与干细胞杂志:电子版, 2016, 6(5):321-326.

