还原型谷胱甘肽(GSH)在小鼠体外受精中的作用初探
洪胜辉,倪利锋,王芊芊,陈晓娟,刘迪文
(1.浙江大学 实验动物中心,浙江杭州 310058; 2.杭州师范大学 实验动物中心)
试验研究
还原型谷胱甘肽(GSH)在小鼠体外受精中的作用初探
洪胜辉1,倪利锋2,王芊芊1,陈晓娟1,刘迪文1
(1.浙江大学 实验动物中心,浙江杭州 310058; 2.杭州师范大学 实验动物中心)
为研究还原型谷胱甘肽(GSH)在小鼠体外受精中的作用,试验选用C57BL/6J小鼠(雄鼠12周龄,雌鼠4周龄)、ICR受体鼠(8-10周龄)。GSH添加浓度分别为终浓度0、1 mmol/L、2 mmol/L,每组超排雌鼠5只,转基因小鼠净化试验每个品系超排雌鼠10只。结果显示,在受精液(HTF)中添加GSH 1 mmol/L时,小鼠体外受精效果最好,受精率达70.8%,胚胎形状正常,未受精单细胞与异形胚较少,胚胎移植平均妊娠率达93.5%。
还原型谷胱甘肽;体外受精;受精率;产仔率;小鼠
还原型谷胱甘肽(GSH)是由谷氨酸、半胱氨酸和甘氨酸以肽键形式缩合而成的三肽化合物,是机体内重要的抗氧化剂和自由基清除剂,能把体内的有害毒物转化为无害物质排出体外。GSH对巯基酶具有激活作用,在生物氧化、氨基酸转运、保护血红蛋白过程中发挥着重要作用。
哺乳动物的精子细胞对脂质过氧化作用非常敏感,极易导致精子结构损伤,降低精子的运动能力和新陈代谢。研究表明,在冷冻稀释液中添加一定浓度的GSH能显著增强牛、羊冷冻解冻精子的活力及精子质膜、顶体膜和DNA的完整性[1-2];提高牛卵母细胞体外受精率和胚胎发育率[3]。尽管国内有很多报道证明GSH能提高精子活力,但其研究都以牛、羊为对象,在小鼠上鲜有报道,笔者在日常小鼠净化实验中,通过在小鼠体外受精液中添加GSH,探索到最适合小鼠体外受精的GSH添加量,大大提高了小鼠体外受精率和小鼠净化效率,现报告如下,供参考。
1 材料与方法
1.1 试验动物 C57BL/6J小鼠(雄鼠12周龄、雌鼠4周龄)、ICR受体鼠(8-10周龄)购自上海某实验动物有限公司,饲养于SPF级动物屏障中,待净化转基因小鼠饲养于隔离待净化区域。
1.2 供试试剂 孕马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(HCG)购自宁波某制药有限公司。精子获能液(c-TYH)和受精液(HTF)由本中心配制,所用成分均购自sigma公司。GSH、M2培养液、矿物油购自sigma公司。
1.3 超排和取卵 每只小鼠腹腔注射PMSG 5 IU,间隔48 h后腹腔注射HCG 5IU。注射HCG后15 h左右取卵,将卵团细胞移入预先平衡的200 μL 受精液微滴中培养。GSH用HTF稀释,添加浓度分别为终浓度0 、1 mmol/L、2 mmol/L的受精液,每组超排C57BL/6J 雌鼠5只。转基因小鼠净化试验每个品系超排C57BL/6J雌鼠10只。
1.4 体外受精 将C57BL/6J及转基因雄鼠 脱颈椎处死,取附睾尾精子,精子团移入精子获能液c-TYH中,置CO2培养箱中培养。0.5 h后,镜检精子活力和密度,轻柔吸取微滴边缘的精子悬液加至含卵母细胞团的受精滴中,置培养箱中培养。4 h后洗卵,移入HTF中培养过夜。次日记录2细胞胚胎数、未受精卵数、异常卵数和取卵总数,统计受精率和异常卵比例,同时观察胚胎细胞形态。
2 结果与分析
2.1 最佳GSH浓度确定 C57BL/6J小鼠体外受精添加GSH试验结果,详见表1。
由表1可见,HTF中未添加GSH时,小鼠体外受精率较低,且异形胚胎数较多。添加2 mmol/L GSH 时,小鼠体外受精率较高,近50% 2-cell胚胎透明带内插入较多精子,胚胎似毛茸茸“小球“,这类胚胎移植成活率较低。结合体外受精率及胚胎形态,确定GSH添加量为1 mmol/L 时,小鼠体外受精率较高、异形胚较少,试验结果最佳。
2.2 转基因小鼠净化结果 详见表2。
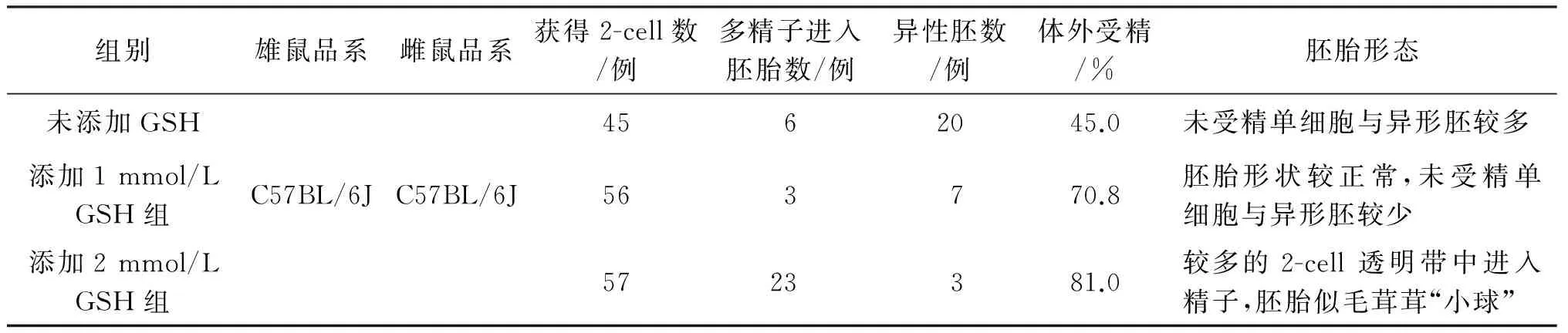
表1 确定GSH 最佳浓度添加量的试验结果

表2 转基因小鼠体外受精及产仔结果
由表2可见,添加1 mmol/L GSH后,小鼠平均体外受精率由58.9%提高到73.6%,平均每只供体获得的2-cell胚胎数由12.9例提高到18.2例。且移植受体的平均妊娠率及平均胚胎移植产仔率无显著差异,在相同净化条件下,可以减少超排供体的数量,从而节约成本,提高供体利用率。
3 小结与讨论
在养殖业中,GSH最早被添加于牛、羊精子冷冻稀释液中以提高冷冻精子的质量和受精率。多项研究表明,在冷冻稀释液中添加GSH后的冷冻精子复苏后体外受精率高于未添加组。有关研究认为GSH是通过清除精细胞中的ROS 和减少精细胞内抗氧化酶泄露来达到保护精细胞免受过多氧化物质损害的目的[1,2,4]。研究表明,GSH能促进卵母细胞体外受精胚胎发育,减少ROS,提高抗氧化作用。同时,GSH还可增加胚胎对温度升高的耐受性,对移植后胚胎的存活和发育有着重要作用。
本研究结果表明,在小鼠体外受精液中添加适量GSH能明显提高小鼠体外受精率,当GSH添加量为1 mmol/L 时,效果最佳,与Takeo T.等(2001)[5]研究结果基本一致。通过添加GSH,可明显提高小鼠体外受精效率和小鼠的生物净化效率,减少小鼠的超排量,节约成本,切实贯彻实验动物使用中的“3R”原则。
[1]Tuncer P B,Bucak M N,Buyukleblebici S,et al.The effect of cysteine and glutathione on sperm and oxidative stress parameters of post-thawed bull semen[J].Cryobiology,2010,61:303-307.
[2]Muhammad S A,Bushra A R,Syed M H,et al.Glutathione supplement tris-citric acid extender improves thep post-thaw quality and in vivo fertility of buffalo(Bubalus bubalis)bull spermatoza[J].Reproductive Biology,2012,271-276.
[3]魏红芳,张长兴,徐照学.谷胱甘肽(GSH)对牛卵母细胞体外受精胚胎发育的的影响[J].安徽农业科学,2009,37(33):16398-16404.
[4]Bilodeau J F,Blanchette S,Gagnon C,et al.Thiols prevent H2O2-mediated loss of sperm motility in cryopreserved bull semen[J].Theriogenology,2001,56:275-286.
[5]Takeo T,Nakagata N.Reduced Glutathione Enhances Fertility of Frozen/Thawed C57BL/6 Mouse Sperm after Exposure to Methyl-Beta-Cyclodextrin[J]. Blology of Reproduction.2011,85:1066-1072.
2016-08-16
洪胜辉(1986-),男,硕士,初级实验员,主要研究方向为种资净化与保存。
S865.1+30.3
A
1005-7307(2016)06-0001-002

