还原型谷胱甘肽脂质体的制备与表征研究
陈云辉冯珺蔡鑫君周中元
还原型谷胱甘肽脂质体的制备与表征研究
陈云辉1冯珺2蔡鑫君2周中元2
还原型谷胱甘肽;脂质体;制备;表征
还原型谷胱甘肽(GSH)是一种参与体内多种重要的生化代谢反应的化合物,是维持体内正常的氧化还原环境的关键因素。临床上常用于药物中毒、肝功能异常等[1-3]。但GSH属于多肽类药物,存在透过细胞膜能力差、易氧化、稳定性差等问题,给临床应用造成了一定的影响。脂质体作为一种由脂质双分子层包裹形成的微型泡囊体,因其磷脂双分子层与细胞膜的亲和力高,更容易将药物输送到细胞内,同时可以避免药物被分解破坏,并能使药物缓慢释放,有利于减少给药次数,提高生物利用度[4]。因此为了解决GSH存在的问题,更好地发挥GSH药效,并使其具缓释长效功能,本课题组制备GSH脂质体,并对其进行表征研究,从而为研究稳定长效的GSH制剂提供依据。
1 实验材料
1.1 仪器Agilent1100高效液相色谱仪(美国Agilent公司);Nano-ZS型粒径分析仪(英国马尔文公司);JEM-1200EX透射电子显微镜(日本Jeol公司);SCIENTZ-ⅡD超声波细胞粉碎机(宁波新芝生物科技股份有限公司);R202旋转蒸发器(上海申胜生物技术有限公司);85-2型恒温磁力搅拌器(上海志威电器有限公司);循环水真空泵(河南省予华仪器有限公司);pH(酸度)计(上海天达仪器有限公司);水浴恒温震荡器(常州溪华仪器有限公司)。
1.2 药品与试剂还原型谷胱甘肽对照品(中国药检所,批号130412);还原型谷胱甘肽原料药(上海宝曼生物科技有限公司,批号20150612);庚烷磺酸钠(山东禹王实业有限公司,批号2013110801);大豆卵磷脂(德国Lipoid公司,批号X0515);胆固醇(Sigma公司,批号);甲醇、磷酸、氯仿、柠檬酸、磷酸二氢钠、氢氧化钠(以上皆为分析纯)。
2 方法与结果
2.1 还原型谷胱甘肽含量测定方法
2.1.1 色谱条件色谱柱为Hypersil BDS C18(250mm×4.6mm,5μm);流动相为磷酸盐溶液(取磷酸二氢钠6.80g,庚烷磺酸钠2.20g,加水溶解使成1000mL,用磷酸调节pH值至3.0)-甲醇(96:4);流速为1.0mL/min;柱温为30℃;检测波长为210nm;进样量为20μL。在此色谱条件下,空白脂质体和还原型谷胱甘肽对照品及含药样品色谱图见图1(封三)。
2.1.2 对照品的制备精密称取还原型谷胱甘肽对照品7.5mg,置于25mL容量瓶中,加入流动相溶解并稀释至刻度,摇匀,得0.3mg/mL还原型谷胱甘肽对照品溶液。
2.1.3 标准曲线的建立还原型谷胱甘肽对照品溶液配成系列浓度,按“2.1.1”项进样分析,以峰面积为纵坐标,相应进样浓度为横坐标做回归方程,回归方程为:Y=10770X+82.210(r=0.999),分析表明还原型谷胱甘肽在0.06~0.3mg/mL范围内线性关系良好。
2.1.4 精密度试验与重复性试验精密吸取还原型谷胱甘肽对照品溶液20μL,按“2.1.1”项下方法重复进样6次,发现其RSD=1.02%(n=6),表明本方法精密度良好。平行配制6份上述对照品溶液,按“2.1.1”项方法测定,结果为RSD=0.82%(n=6),表明方法重复性良好。
2.1.5 稳定性试验取同一还原型谷胱甘肽对照品溶液,在不避光条件下分别放置0、0.5、1、1.5、2、3、4h,按“2.1.1”项下方法进行测定,结果为RSD=0.19%(n=7),表明对照品溶液4h内保持稳定。
2.2 还原型谷胱甘肽脂质体的制备分别称取胆固醇和卵磷脂置于烧杯中,加入氯仿溶解,磁力搅拌均匀后将类脂溶液置于圆底烧瓶中,在37℃水浴中旋转蒸发除去氯仿,待类脂物在瓶壁上形成一层薄膜后,加入0.3mol/L柠檬酸10mL,继续旋转水合30min,得空白脂质体。将还原型谷胱甘肽溶液加入空白脂质体中,调节pH为到8.0,将还原型谷胱甘肽脂质体在冰水浴中短时超声5min,即得。
2.3 还原型谷胱甘肽脂质体的表征研究
2.3.1 包封率的测定采用超速离心法测定还原型谷胱甘肽脂质体的包封率。取还原型谷胱甘肽脂质体溶液适量,15000r/min离心15min。HPLC测定上清液中的还原型谷胱甘肽含量,标为W1;再取等量的还原型谷胱甘肽脂质体溶液,加入甲醇超声破坏脂质体,以HPLC测定还原型谷胱甘肽的总量,标为W0;计算包封率为EE=(W0-W1)/W0×100%,其中,EE:包封率;W0:还原型谷胱甘肽投药量;W1:未包裹进脂质体中的药物量。
为了验证上述制备处方工艺的稳定性,根据确定工艺制备还原型谷胱甘肽脂质体,实验重复3次,所得还原型谷胱甘肽脂质体的平均包封率为82.31%,RSD为3.45%,表明该工艺稳定可靠。见表1。

表1 还原型谷胱甘肽脂质体的包封率检测结果
2.3.2 平均粒径的测定取适量脂质体用激光粒度测定仪测定平均粒径,显示平均粒径为109.8nm,见图2(封三)。
2.3.3 外观形态取少量脂质体溶液滴于铜网上,静置10min后用滤纸片吸干,再滴加2.0%磷钨酸溶液对其进行染色,待自然挥干后,在透射电镜镜下观察脂质体外观形态。结果见图3(封三),脂质体结构完整,外观呈球形,分布均匀。
2.3.4 体外释放测试采用透析袋法对还原型谷胱甘肽脂质体的体外释药特性进行研究。精密量取相同的还原型谷胱甘肽脂质体3份,置于经蒸馏水浸泡处理过的透析袋内,将袋口扎紧。将含药透析袋置于(pH7.4)缓冲液,于37℃恒温水浴振荡(100r/min),分别于0.1、1、2、3、4、5、6、8、12、18、36h取样,取样后补加等量同温释放介质,样品用0.22μm微孔滤膜滤过,取续滤液测定还原型谷胱甘肽含量,计算累积释放百分率(Qn)。见图4(封三)。结果发现还原型谷胱甘肽脂质体溶液在18h时已基本释放完全。
为探讨释放机理,将释药曲线分别用零级动力学方程、一级动力学方程、Higuchi方程、Weibull方程对释药数据进行拟合,见表2。结果表明,还原型谷胱甘肽脂质体溶液的体外释放曲线符合Weibull方程模型,为lnln(1/1-Q)=0.3817lnt-0.3227,r=0.9922,其中Q为累积释放百分率,t为取样时间。
3 讨论
目前,薄膜分散法、反相蒸发法、注入法和复乳法等是常用的脂质体制备方法[5-6],本文选择的pH梯度法属于“主动载药”技术,与传统的“被动载药”技术相比,可以更显著地提高脂质
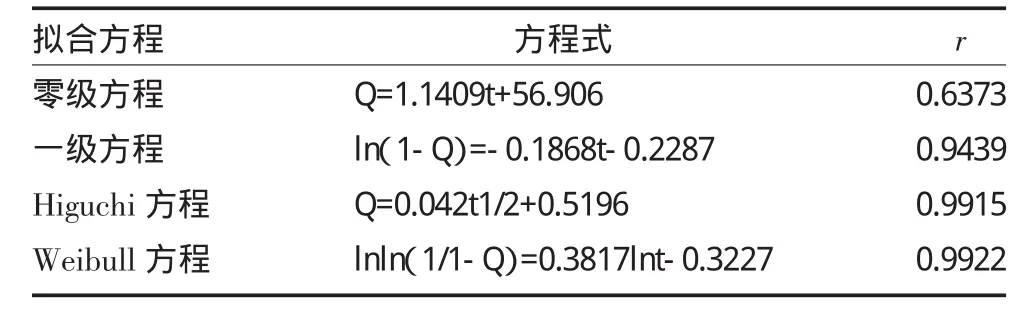
表2 还原型谷胱甘肽脂质体体外释药曲线拟合结果
体的包封率和稳定性。通过调节脂质体内外的pH梯度,使得更多的脂质体外水相中药物进入脂质体内部,可以明显提高药物的包封率,特别适合水溶性药物的包裹。
通过还原型谷胱甘肽对脂质体的体外释放度研究可以为体内药动学过程提供一定的参考,本研究制备的还原型谷胱甘肽脂质体体外释放度实验结果表明,还原型谷胱甘肽可以有效地缓释18h,明显优于原药,可以预测还原型谷胱甘肽脂质体可增加还原型谷胱甘肽在体内循环时间,并能减少药物降解,从而提高药物疗效。这一研究结果将为还原型谷胱甘肽脂质体体内药动药效提供基础数据。
[1]王祖君,李小丹.还原型谷胱甘肽联合丹参注射液治疗酒精性肝病临床观察[J].现代中西医结合杂志,2016,25(12):1304-1306.
[2]雷澈.还原型谷胱甘肽注射液治疗小儿肺炎合并肝功能损害的疗效观察[J].临床合理用药,2016,9(6):52-53.
[3]夏毅如,陈振华.联合应用还原型谷胱甘肽和促肝细胞生长素治疗婴儿肝炎综合征疗效研究[J].中国现代药物应用,2016,10(9):175-176.
[4]杨文秀.脂质体主动载药的研究与应用进展[J].现代医药卫生,2011,27(17):2647-2648.
[5]沈丹,张蕊,薛婧等.柔性脂质体研究进展[J].中国医师杂志,2014,16(3):425-427.
[6]盛竹君,徐维平,徐婷娟,等.脂质体药物传输系统的研究新进展[J].中国药业,2015,24(23):6-9.
(收稿:2016-12-29修回:2017-01-20)
book=716,ebook=84
浙江省药学会医院药学专项百特医院药学专项科研(No. 2013ZYY38)
1杭州市江干区人民医院药剂科(杭州310021);2浙江省中西医结合医院药剂科(杭州310003)
冯珺,Tel:057156109723;E-mail:492933372@qq.com

