4-[(E)-2-羟基-4-甲氧基苄亚氨基)]-1,5-二甲基-2-苯基-1,2-二氢-3H-吡唑-3-酮的合成与表征
严 思,胡浙耀,白林山,李竹琴,孟春龙,张 婷
(安徽工业大学化学与化工学院,安徽马鞍山243002)
4-[(E)-2-羟基-4-甲氧基苄亚氨基)]-1,5-二甲基-2-苯基-1,2-二氢-3H-吡唑-3-酮的合成与表征
严 思,胡浙耀,白林山,李竹琴,孟春龙,张 婷
(安徽工业大学化学与化工学院,安徽马鞍山243002)
∶研究2-羟基-4-甲氧基苯甲醛和4-氨基安替比林反应生成新型席夫碱化合物4-[(E)-2-羟基-4-甲氧基苄亚氨基)]-1, 5-二甲基-2-苯基-1,2-二氢-3H-吡唑-3-酮的方法。当2-羟基-4-甲氧基苯甲醛与4-氨基安替比林摩尔比为1∶1.75,反应时间为3.5 h,反应温度为70℃时,最大反应产率为84%。采用UV-vis,IR,1H NMR和X-射线单晶衍射等方法表征产物的分子和晶体结构,结果表明:该化合物晶体属于单斜晶系,空间群为C2/c,a=30.827(6)Å,b=6.967 5(13)Å,c=16.978(4)Å, β=110.786(2)°,V=3 409.4(11)Å3,Dc=1.315 g·cm-3,Z=8,F(000)=1 424,μ=0.091 mm-1,R1=0.068 6,wR2=0.171 1;通过分子内氢键O2—H2…N1和C(8)—H(8A)…O(3)可形成较稳定的晶体结构,产物具有一定抗氧化作用,半抑制质量浓度IC50为2.10 mg·mL-1,当质量浓度为200 mg·mL-1时,对DPPH自由基的清除率为5.11%,对金黄色葡萄球菌具有一定抗菌活性,对铜绿假单胞菌和大肠杆菌基本无抑制作用。
2-羟基-4-甲氧基苯甲醛;4-氨基安替比林;合成;表征;生物活性
1 目标化合物的合成路线
合成路线见图1。
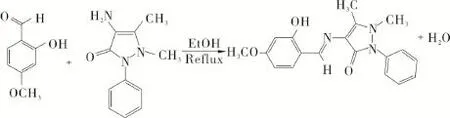
图1 目标化合物的合成Fig.1 Synthesis of the object compound
2 实验部分
2.1 主要试剂与仪器
2-羟基-4-甲氧基苯甲醛(质量分数,99%,百顺(北京)化学科技有限公司);乙醇(AR,国药集团化学试剂有限公司);甲醇(AR,国药集团化学试剂有限公司);二氯甲烷(AR,国药集团化学试剂有限公司);乙腈(AR,国药集团化学试剂有限公司);正己烷(AR,国药集团化学试剂有限公司);牛肉膏(BR,国药集团化学试剂有限公司);胰蛋白胨(BR,国药集团化学试剂有限公司);酵母提取物(BR,国药集团化学试剂有限公司);4-氨基安替比林(质量分数,98%);1,1-二苯基-2-苦基肼(DPPH,质量分数,96%,上海晶纯生化科技股份有限公司);金黄色葡萄球菌(Staphylococs aureus)ATCC 25923(中国普通微生物菌种保藏中心);铜绿假单胞菌(Pseudomonas aeruginosa)ATCC 27853(中国普通微生物菌种保藏中心);大肠杆菌(Escherichia coli)DH5a(本实验室提供)。
Spectrum One型红外光谱仪(Perkin Elmer,美国);LS55型荧光光谱仪(Perkin Elmer,美国);Specord Plus 200型紫外可见分光光度计(Analytik Jena,德国);SMART APEX II型X射线单晶衍射仪(Bruker,德国);Avance II 400型核磁共振波谱仪(Bruker,德国);Vario EL III型元素分析仪(Elementar,德国);Thermo Scientific Multiskan FC型酶标仪;Thermo Scientific Forma 905型超低温冰箱(-86℃,Thermo Fisher,美国);SW-CJ-1G型单人净化工作台(苏州净化设备有限公司);LRH-150型生化培养箱(上海一恒科学仪器有限公司);ZWYR-200D型恒温培养振荡器(上海智城分析仪器制造有限公司);HVE-50型高压灭菌器(Hirayama,日本);WRS-1B型数字熔点仪(上海精科实业有限公司);R-1002型旋转蒸发仪;SHB-Ш型循环水式多用真空泵(郑州长城科工贸有限公司)。
2.2 实验步骤
取0.152 2 g(1.0 mmol)2-羟基-4-甲氧基苯甲醛于250 mL两口烧瓶中,用10 mL无水乙醇溶解;加入0.355 8 g(1.75 mmol)4-氨基安替比林,用10 mL无水乙醇溶解,在70℃下回流反应3.5 h,冷却,减压蒸馏,析出黄色固体,依次用10 mL乙腈和15 mL正己烷洗涤,用无水甲醇和二氯甲烷(2∶5)重结晶,真空干燥,得0.2833 g淡黄色片状晶体,产率84%,熔点194.3~196.0℃。元素分析(C19H19N3O3,理论值(质量分数,%):C 67.66(67.64),H 5.95(5.68),N 12.59(12.46)。IR(KBr)ν/cm-1:3 233.93,1 631.71,1 216.88。1H NMR(CDCl3,400 MHz),δ:13.72(s,1H,—OH), 9.75(s,1H,),7.62~7.45(t,J=7.8 Hz, 2H,antipyrine—H),7.42~7.37(d,2H,antipyrine—H), 7.36~7.30(t,1H,antipyrine—H),7.27~7.22(t,1H, Ar—H),6.47~6.45(m,2H,Ar—H),3.82(s,3H,—OCH3),3.15(s,3H,N—CH3),2.39(s,3H,—CH3)。
2.3 晶体结构测定方法
取少量样品于20 mL烧杯中,用2 mL无水甲醇和5 mL二氯甲烷溶解,室温静置数天,得黄色片状晶体。选取适当大小晶体,在296(2)K下用石墨单色化的Mo Kα为入射线(λ=0.710 73 Å),以ω/2θ扫描方式,在2.45°<θ<27.48°范围内收集衍射数据。由直接法解出晶体结构,非氢原子坐标和各项异性参数用最小二乘法修正,强度数据用Lp因子和经验吸收校正。计算用SHELXL 97程序完成[8]。晶体学参数见表1。
2.4 抗氧化活性测定方法
采用1,1-二苯基-2-苦基肼(DPPH)法评价目标化合物的抗氧化活性。1,1-二苯基-2-苦基肼自由基(DPPH·)在517 nm处有吸收峰,在乙醇溶液中呈紫红色。当抗氧化剂存在时,DPPH·被清除,在517 nm处吸收峰减弱,溶液颜色变浅[9]。1)取0.019 7 g DPPH,溶于无水乙醇,定容至250 mL,摇匀,配制成0.2 mmol·L-1溶液,低温避光保存。2)用无水乙醇配置200mg·L-1抗坏血酸溶液和200mg·L-1目标化合物溶液。3)分取2.00 mL DPPH溶液和2.00 mL目标化合物溶液(样品组)、2 mL DPPH溶液和2.00 mL溶剂(对照组)、2.00 mL无水乙醇和2.00 mL目标化合物溶液(空白组)于3支10 mL比色管中,分别在25℃下于暗处静置30 min,用1 cm比色皿于517 nm波长处测定吸光度,分别记为As(样品组)、Ac(对照组)和Ab(空白组)。根据式(1)计算DPPH·平均清除率S。

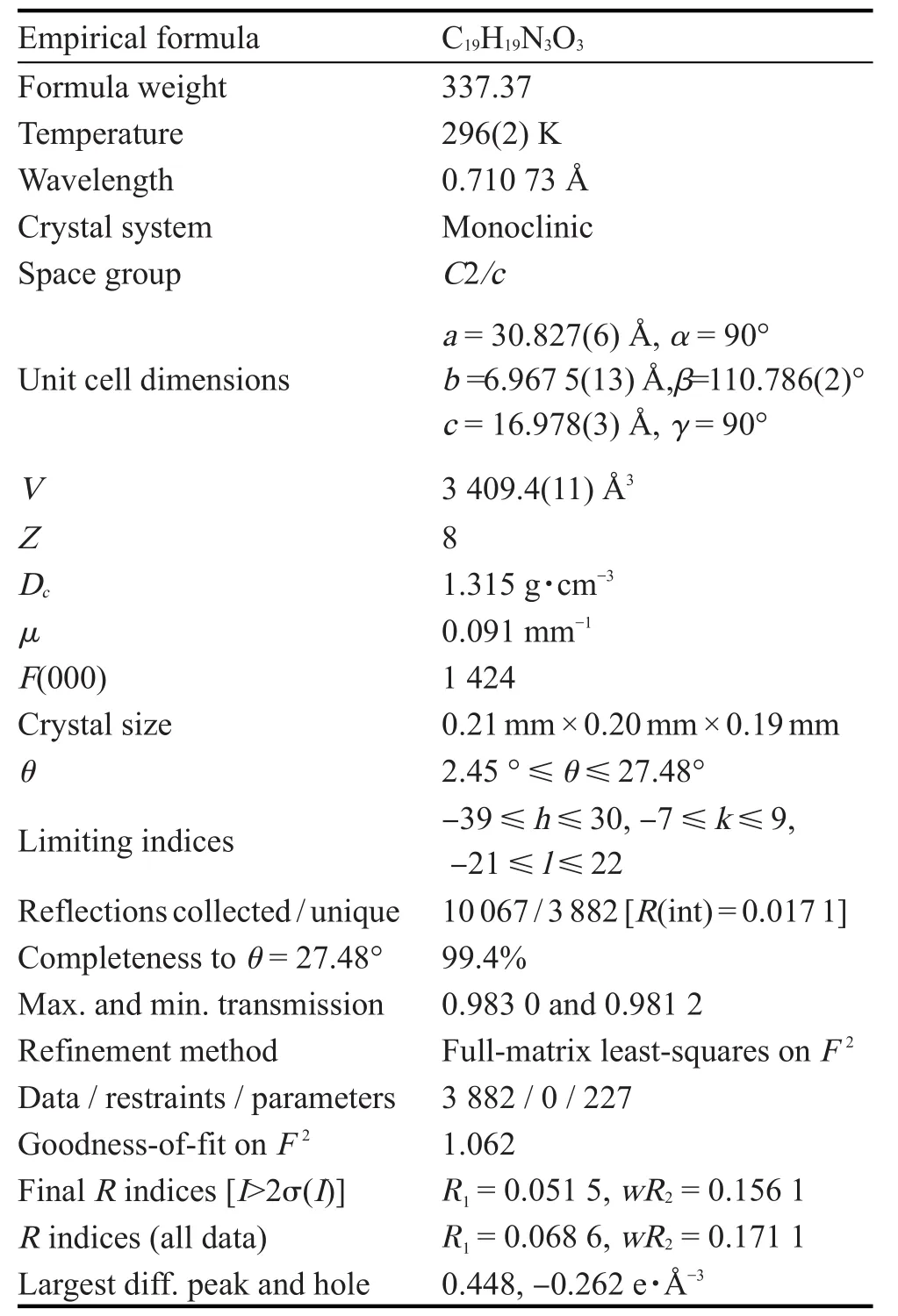
表1 目标化合物的晶体学参数Table.1 Crystal data of the object compound
2.5 抑菌活性测定方法
采用微量梯度稀释法评价目标化合物的抑菌作用。1)营养肉汤培养基的制备 取胰蛋白胨5 g,牛肉膏2.5 g,氯化钠2.5 g于1000 mL蓝盖试剂瓶中,加入500 mL蒸馏水,微热溶解,调pH为7.0,121℃灭菌20 min。2)待测物溶液的制备 取适量待测物溶于少量DMSO中,加入1滴吐温80溶液,加水配成1.0×10-3mol·L-1溶液,DMSO终体积分数控制在1%以下,用滤菌膜过滤除菌。3)在96孔培养板中,每孔均加入90 μL营养肉汤培养基,第2孔中加入10 μL1.0×10-3mol·L-1待测物溶液,从第2孔取10 μL液体加入第3孔中,依次梯度稀释至 第8孔,从第8孔中取10 μL液体弃去,向第2~第8孔中加入10 μL待测菌种。第9孔中加入10 μL体积分数为1%的DMSO溶液,取10 μL液体弃去,再加入10 μL待测菌种,第10孔中加入10 μL待测菌种,分别作为溶剂对照和空白对照。混匀后,置于37℃生化培养箱中培养24 h,于620 nm波长处用酶标仪测定吸光度(OD值)。
3 结果与讨论
3.1 紫外可见光谱分析
图2是目标化合物在甲醇-水溶液中紫外可见吸收光谱。由图2可知,目标化合物在200~500 nm范围内存在4个主要吸收峰,存在烯醇式和酮式互变异构现象[10](见图3)。在205 nm处为苯环π→π*跃迁K2带和K带吸收峰,在280 nm处是取代苯n→π*跃迁R带吸收,在350 nm处强吸收峰为烯醇式亚胺基π→π*跃迁吸收峰,在420 nm处弱吸收峰为酮式亚胺基n→π*跃迁吸收峰。随甲醇含量降低,溶液极性增大,350 nm处吸收峰逐渐减弱,420 nm处吸收峰逐渐增强。

图2 目标化合物在甲醇-水溶液中的紫外可见吸收光谱Fig.2 UV-vis spectra of the object compound in methanol-H2O solution

图3 目标化合物的烯醇式和酮式互变异构平衡Fig.3 Keto-Enol tautomerism of the object compound
3.2 红外光谱分析
采用KBr压片法(1 mg样品/100 mg KBr)测定目标化合物红外光谱,见图4。由图4可知,在3 224 cm-1处出现较强缔合—OH伸缩振动吸收峰,在2 839 cm-1处出现芳环甲氧基(C—H)对称伸缩振动吸收峰;在1 631, 1 595,1 495 cm-1处出现芳环骨架振动吸收峰,在1 613 cm-1处出现席夫碱基伸缩振动吸收峰[11],在1 600 cm-1附近和3 500~3 300 cm-1范围内均未出现及—NH2伸缩振动吸收峰,说明形成了目标席夫碱化合物。
3.3 核磁共振分析
用氘代氯仿(CDCl3)配制目标化合物溶液,取5 mg样品于直径5 mm核磁样品管中,加入质量分数为1%的TMS(四甲基硅烷)。用Avance II 400型核磁共振波谱仪测试1H NMR,结果见图5和表2。由图5和表2可知,—OH分子内氢键的去屏蔽作用使共振发生在低场,—OH氢原子信号峰出现在δ=13.72处。—CH
N中氢原子信号峰出现在δ=9.75处,证明形成了目标席夫碱化合物。

图4 目标化合物的红外光谱Fig.4 Infrared spectrum of the object compound
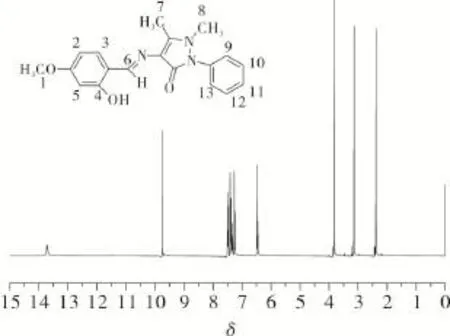
图5 目标化合物的1H NMR谱Fig.51H NMR spectrum of the object compound

表2 目标化合物的1H NMR的数据Tab.21H NMR data of the object compound
3.4 目标化合物的晶体结构
目标化合物晶体部分键长和键角见表3,4。

表3 目标化合物晶体的部分键长Tab.3 Selected bond lengths of the objected compound crystal
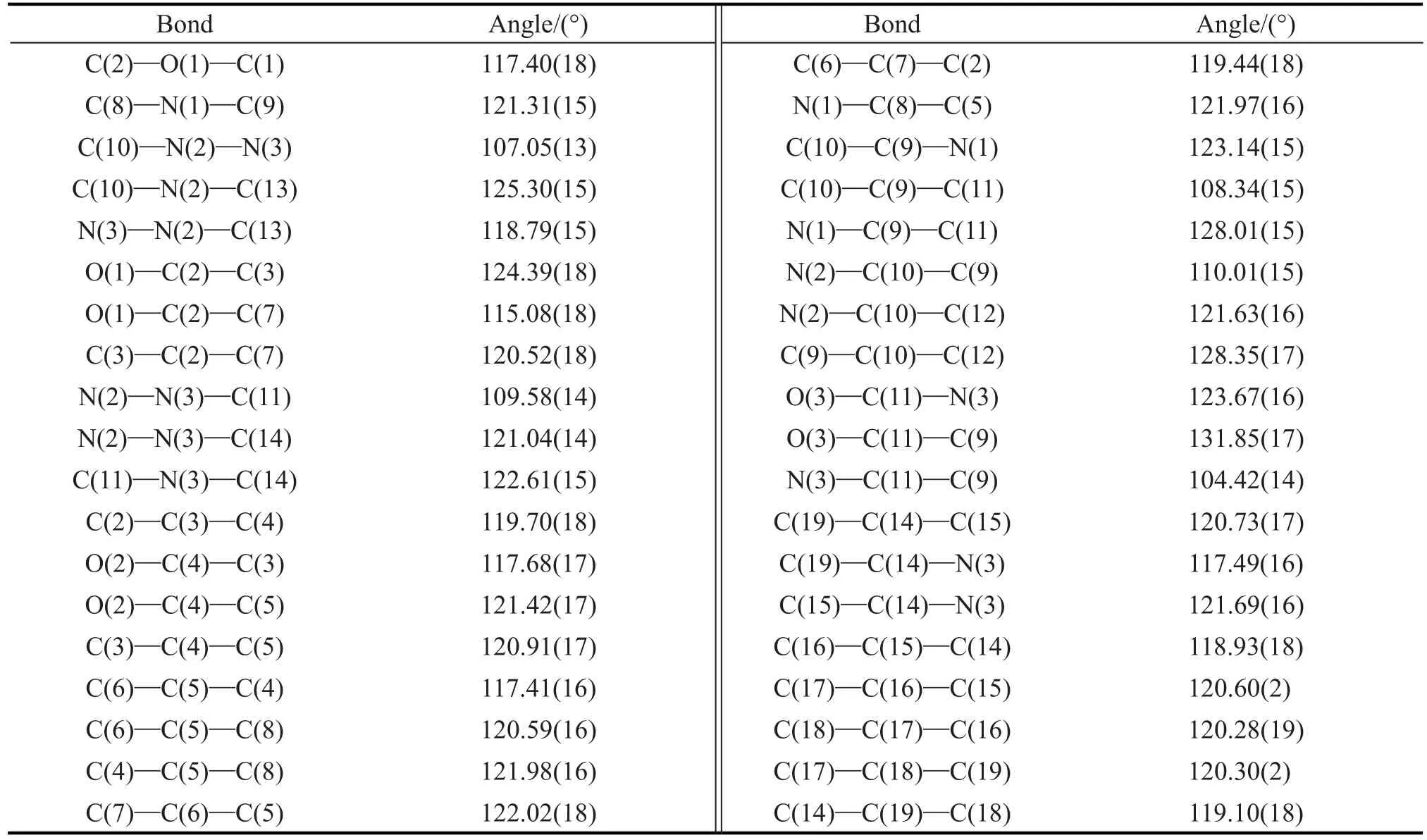
表4 目标化合物晶体的部分键角Tab.4 Selected bond langles of the objected compound crystal
分子结构、分子内氢键和晶胞堆积分别见图6~8。目标化合物晶体属单斜晶系,空间群C2/c,a=30.827(6)Å,b=6.967 5(13)Å,c=16.978(4)Å,β=110.786(2)°,V=3 409.4(11)Å3,Dc=1.315 g·cm-3,Z=8,F(000)=1 424, μ=0.091 cm-1,R1=0.068 6,wR2=0.171 1。
3.5 目标化合物的抗氧化作用
采用DPPH法[12],在10~200 mg·L-1范围内测定了抗坏血酸及目标化合物对DPPH自由基清除能力,结果见图9和表5。结果表明,目标化合物对DPPH自由基清除率S随浓度增大而增大,线性回归方程为S=0.023 7ρ+0.303 2,r=0.994 3,ρ为质量浓度,mg·L-1。用外推法求得半清除浓度IC50为2.10 mg·mL-1,具有一定抗氧化作用,但弱于抗坏血酸。
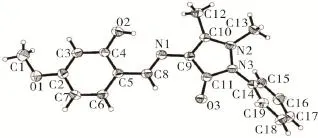
图6 目标化合物的单分子结构Fig.6 Molecular structure of the object compound
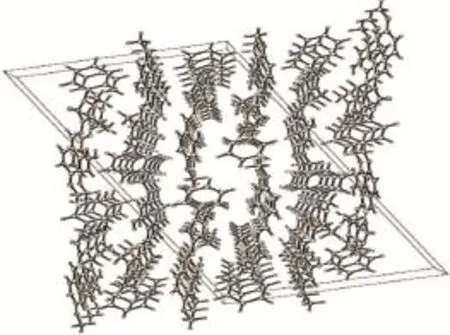
图7 目标化合物晶胞堆积图Fig.7Packing diagram of the object compound

图8 目标化合物的分子内氢键Fig.8 Intramolecular hydrogen bond of the object compound
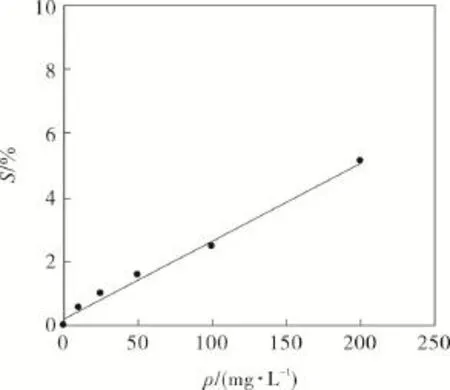
图9 目标化合物对DPPH自由基的清除率Fig.9 DPPH free radical scavenging activity of the object compound

表5 目标化合物对DPPH自由基的清除率Tab.5 DPPH free radical scavenging activity of the object compound
3.6 目标化合物的抑菌作用
采用微量梯度稀释法和酶标仪,探讨了目标化合物对金黄色葡萄球菌、铜绿假单胞菌和大肠杆菌的抑菌活性[13],结果见图10。结果表明,目标化合物对金黄色葡萄球菌具有一定抑菌活性,最低抑菌浓度(MIC)为1.0×10-5mol·L-1。对铜绿假单胞菌和大肠杆菌基本无作用。
4 结 论
本文合成了一种新型席夫碱化合物4-[(E)-2-羟基-4-甲氧基苄亚氨基)]-1,5-二甲基-2-苯基-1, 2-二氢-3H-吡唑-3-酮,反应条件简单,产率较高。目标化合物晶体属于单斜晶系,空间群为C2/c,具有一定的抗氧化活性和抑菌活性。

图10 目标化合物对金黄色葡萄球菌的抑菌作用Fig.10 Antibacterial activity of the object compound against Staphylococcus aureus
[1]MARTIN S J,KHOJASTECH R R.Synthesis,characterization,and antibacterial activities of Cr(III),Co(III),Ni(II), and Mn(III)complexes of heptadentate Schiff base ligand derived from tris(2-aminoethyl)amine[J].Russian Journal of General Chemistry,2015,85(7)∶1763-1767.
[2]RAMADAN R M,AL-NASR A K A,NOURELDEEN A F H.Synthesis,spectroscopic studies,antimicrobial activities and antitumor of a new monodentate V-shaped Schiff base and its transition metal complexes[J].Spectrochimica Acta Part A∶Molecular& Biomolecular Spectroscopy,2014,132(21)∶417-422.
[3]YE J,QIU S Y,HU A X,et al.Synthesis and antitumor activity of 4-tert-butyl-5-benzyl-2-benzyliminothiazoles[J].Chemical Research in Chinese University,2014,30(1)∶49-54.
[4]ZHANG X Y.Syntheses,crystal structures and antibacterial activities of two antipyrine derivatives[J].Journal of Chemical Crystallography,2011,41(7)∶1044-1048.
[5]白林山,周影,李竹琴,等.5-甲氧基-2-{(E)-[(3-甲基吡啶-2-基)亚氨基]甲基苯酚的合成与表征[J].安徽工业大学学报(自然科学版),2015,32(2)∶138-142.
[6]PATTEKHAN H H.Regioselectivity in the preparation of 2-hydroxy-4-methoxybenzaldehyde from resorcinol[J].Journal of Molecular CatalysisA∶Chemical,2001,169∶185-191.
[7]SUDHA C G,SHERINAT V,ANU ANAND V P,et al.Agrobacterium rhizogenes mediated transformation of the medicinal plant Decalepis arayalpathra and production of 2-hydroxy-4-methoxy benzaldehyde[J].Plant Cell Tissue and Organ Culture,2013, 112∶217-226.
[8]SHELDRICK G M.SHELXTL97∶Program for Crystal Structure Refinement[Z].University of Goettingen,Germany,1997.
[9]REZAIE M,FARHOOSH R,IRANSHAHI M,et al.Ultrasonic-assisted extraction of antioxidative compounds from Bene (Pistacia atlantica subsp.mutica)hull using various solvents of different physicochemical properties[J].Food Chemistry,2015, 173∶577-583.
[10]ROSHMY A,ANITHA V.Synthesis,characterization and photophysical studies of Schiff base bearing 1,2,4-Triazole scaffold [J].Journal of Molecular Structure,2016,1113∶60-69.
[11]MOTA V Z,CARVALHO G S G D,CORBI P P,et al.Crystal structure and theoretical studies of the keto-enol isomerism of N, N'-bis(salicylidene)-O-phenylenediamine(salophen)[J].SpectrochimicaActaPartA∶MolecularandBiomolecularSpectroscopy, 2012,99∶110-115.
[12]韦献雅,殷丽琴,钟成,等.DPPH法评价抗氧化活性研究进展[J].食品科学,2014,35(9)∶317-322.
[14]BRADFORD PA,PETERSEN P J,YOUNG M,et al.Tigecycline MIC testing by broth dilution requires use of fresh medium or addition of the biocatalytic oxygen-reducing reagent oxyrase to standardize the test method[J].Antimicrobial Agents& Chemotherapy,2005,49(9)∶3903-3909.
责任编辑:丁吉海
Synthesis and Characterization of 4-[(E)-2-Hydroxy-4-methoxybenzylidene)amino]-1,5-dimethyl-2-phenyl-1,2-dihydro-3H-pyrazol-3-one
YAN Si,HU Zheyao,BAI Linshan,LI Zhuqin,MENG Chunlong,ZHANG Ting
(School of Chemistry and Chemical Engineering,Anhui University of Technology,Ma'anshan 243002,China)
Thesynthesismethodof 4-[(E)-2-hydroxy-4-methoxybenzylidene)amino]-1,5-dimethyl-2-phenyl-1, 2-dihydro-3H-pyrazol-3-one by the reaction of 2-hydroxy-4-methoxybenzaldehyde and 4-aminoantipyrine was studied.The maximum yield was 84%obtained under the molar ratio 1∶1.75 of 2-hydroxy-4-methoxybenzaldehyde and 4-aminoantipyrine at temperature of 70℃for 3.5 h.The molecular and crystal structure of the product was characterized by UV-vis,IR,1H NMR and X-ray single crystal diffraction.The results show that the object compound crystallizes in the monoclinic system,space group C2/c with a=30.827(6)Å,b=6.967 5(13)Å, c=16.978(4)Å,β=110.786(2)°,V=3 409.4(11)Å3,Dc=1.315 g·cm-3,Z=8,F(000)=1 424,μ=0.091 mm-1, R1=0.068 6,wR2=0.171 1;the structure of the object compound features a stable crystal structure constructed by intramolecular hydrogen bond O2—H2…N1,C(8)—H(8A)…O(3).It was a mild antioxidant,IC50was 2.10 mg·mL-1, DPPH free radical scavenging activity was 5.11%under the concentration of 200 mg·mL-1of the object compound; the object compound has mild antibacterial activity against Staphylococcus aureus;minimal inhibitory concentration(MIC)was 1.0×10-5mol·L-1;but had no antibacterial activity against Pseudomonas aeruginosa and Escherichia coli.
2-hydroxy-4-methoxybenzaldehyde;4-aminoantipyrine;synthesis;characterization;bioactivity
O 621.25
A
10.3969/j.issn.1671-7872.2016.03.008
国家自然科学基金项目(81402511);安徽省高校自然科学重点研究项目(KJ2012A050);安徽工业大学研究生创新基金项目(2014040);国家级大学生创新创业训练计划项目(AH201610360017)
严思(1990-),女,安徽芜湖人,硕士生,研究方向为药物中间体合成。
白林山(1963-),男,河南唐河人,博士,教授,研究方向为分析化学和天然产物化学。
1671-7872(2016)03-0239-07

