姑息化疗对晚期肝癌疗效的Meta分析
梁汉霖,彭杰文,陈可绪
(中山市人民医院化疗科,广东 中山 528403)
姑息化疗对晚期肝癌疗效的Meta分析
梁汉霖,彭杰文,陈可绪
(中山市人民医院化疗科,广东 中山 528403)
目的:评价阿霉素等传统化疗药物是否能使晚期肝癌患者的总生存率得到获益。方法:使用系统评价方法。检索MEDLINE、EMBASE等国内外数据库中的相关文献,选择治疗组为姑息化疗并对症支持治疗,对照组只给予对症支持治疗(包括部分非细胞毒性药物)的晚期肝癌的随机对照试验(RCT)。由2位评价者分别按以上检索策略收集资料,按选择标准入选,主要对半年生存率及一年生存率进行Meta分析。结果:姑息化疗与最佳支持治疗对比,姑息化疗不能提高半年和一年生存率,差异无统计学意义。结论:目前姑息化疗不推荐用于晚期肝癌,需要开展一系列大规模的随机对照临床试验以解决这一争议。
化疗;肝癌;荟萃分析;中位生存期
晚期肝癌的治疗非常棘手,阿霉素单药治疗肝癌效率高,然而姑息化疗能否使晚期肝癌患者获益仍然存在争议[1]。美国国家综合癌症网络(NCCN)指南不建议对晚期肝癌使用全身化疗,因为目前临床试验的数据非常有限,所以很有必要对相关的临床研究进行Meta分析,为临床提供更高级别的证据。对局部晚期或远处转移的晚期肝癌患者,比较化疗与最佳支持治疗(BSC)对总生存影响的随机临床试验进行Meta分析,以便明确化疗能否使晚期肝癌的总生存期得到获益。
1 方法
1.1检索策略以MEDLINE(Ovid MEDLINE)数据库、EMBASE数据库、Cochrane图书馆、互联网上注册临床试验数据库(www.controlled-trials. com,clinicaltrials.gov,UK metaregister of controlled trials, WHO international clinical trials registry platform)、中国生物医学文献(CBMdisc)为主要来源(检索2015年10月27日以前已发表的文献和已注册但未发表的临床试验)。中文检索词为“肝癌”、“化疗”;英文检索词为liver or hepatic or hepatocellularorhepato-cellular、 carcinomor cancer*or neoplasm*or malign*or tumo*、HCC and *antineoplastic agent or*cancer chemotherapy or chemo*等,语种不限。
1.2纳入标准与排除标准纳入标准:(1)研究的类型为随机对照试验(RCT);研究的设计较为严密,患者同质性较好;(2)研究对象为局部进展的和有远处转移的肝癌患者,即不可切除的肝癌;有病理学确诊;研究之前及期间患者未接受过靶向治疗和动脉灌注化疗等其他抗肿瘤治疗;血常规、肝功能、肾功能基本正常,能耐受化疗;研究对象中无肝癌以外的肿瘤;研究之前未接受任何放疗和化疗;(3)研究内容为有关晚期肝癌化疗与单纯BSC(包括部分非细胞毒性药物)对生存期影响的临床研究;(4)纳入的文献随访率>95%,要求有随访截尾时的存活例数或有生存曲线。
排除标准:(1)合并有其它肿瘤。(2)研究期间或研究前6个月内接受过化疗、热疗、靶向治疗等抗肿瘤治疗。(3)研究前1个月内接受放疗。
1.3资料收集与分析由2位评价者分别按以上策略收集资料,得到相同的结果,共有19 952条索引,严格按纳入标准和排除标准进行筛选,被排除的文献多为无对照组,研究组中除了化疗还混有动脉灌注化疗、靶向治疗,患者为早期肝癌等,随机对照临床研究只有3项,数据列表见表1。
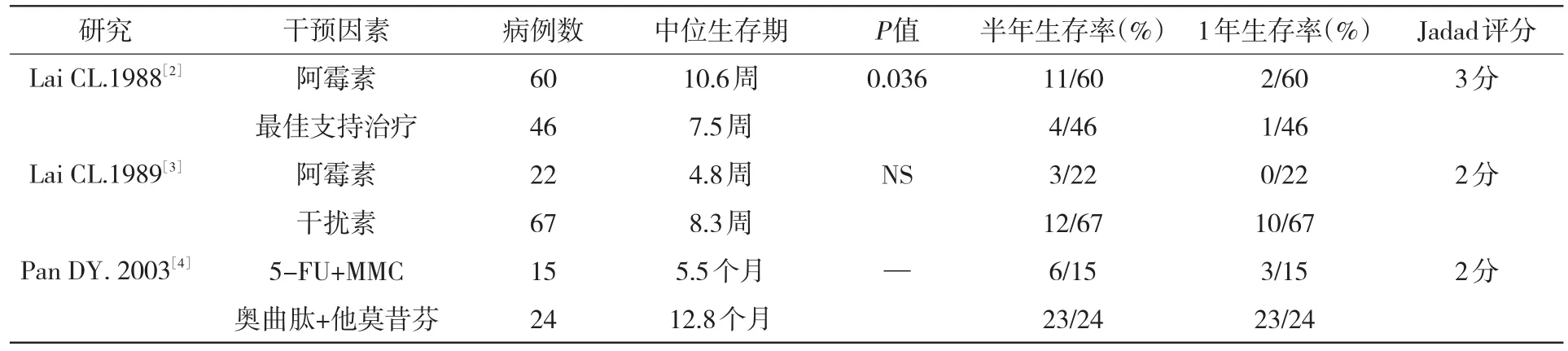
表1 纳入研究的3项晚期肝癌的对照临床试验
随机对照研究的方法学质量控制评分可采用Jadad记分法[7],RCT总分为1~5分,1~2分为低质量研究,3分以上为高质量的研究,随机为2分(1分=作者叙述为随机;2分=描述正确的随机方法),盲法评为0~2分(0分=非双盲;1分=作者叙述为双盲;2分=患者和试验者双盲,且叙述其方法),是否描述失访及失访的原因记为0~1分。结果详见表1。
1.4统计学方法采用Cochrane图书馆的RevMan5.3软件进行Meta分析。
2 结果
入选的3个RCT研究设计均较严密,所有病例均经过组织学的确诊,根据患者的年龄、体能、疾病严重程度等进行了配对。3项研究均提供了生存曲线,尽管提供了中位生存期数据,但没有相应的标准差数据,未能对中位生存期进行分析,仅可获得半年及1年生存率。这3项研究都是晚期肝癌化疗与最佳支持治疗(包括一些非细胞毒性药物,如奥曲肽、他莫昔芬和干扰素对肝癌无明确疗效且毒性很小的药物)相比较。
从表1可见,Lai[2]研究显示阿霉素治疗晚期肝癌似乎比最佳支持治疗有一定的生存获益,但Lai[3]和Pan[4]发现化疗不比常规的内科治疗(非细胞毒类药物)好。各个RCT的结果矛盾,因此需要进行Meta分析,以提供更好的证据。RCT结果的异质性分析可用检验统计量Q表示,应符合公式V=K-1的X2分布。图1是半年生存率的(晚期肝癌化疗vs BSC)随机效应模型的治疗优势比图,图2是1年生存率的(晚期肝癌化疗vs BSC)随机效应模型的治疗优势比图,结果发现,半年生存率的分析结果的P值<0.05,这说明半年生存率在各个研究间的差异大,应选用随机效应模型;1年生存率的分析结果显示P值<0.05,这说明1年生存率在各个研究间的差异大,应选用随机效应模型。化疗与BSC对比,化疗无法提高半年生存率(RD=-0.15,95%CI=[-0.48~-0.18],P= 0.37),也无法提高1年生存率(RD=-0.28,95% CI=[-0.64~-0.08],P=0.12),差异无统计学意义。
3 讨论
肝癌对化疗不甚敏感,阿霉素是应用最广的药物,在非随机对照研究中显示出较高的客观缓解率。在一个Ⅲ期临床试验[8](FOLFOX4 vs阿霉素)中,FOLFOX4组患者在PFS、OS均明显优于阿霉素组,因此FOLFOX4很可能是晚期肝癌的有效方案,但该研究的结果的得出是有一个假设前提的,就是阿霉素化疗能提高晚期肝癌的总生存。但很可惜的是目前没有证据表明阿霉素等的传统化疗可让晚期肝癌的总生存获益。目前的RCT样本量很少,且各研究的结果是矛盾的。
本文的Meta分析显示,与常规内科治疗对比(最佳支持治疗,包括部分毒性小的非细胞毒药物如奥曲肽、他莫昔芬和干扰素),姑息化疗并不能提高晚期肝癌的生存期。对本研究的结果分析如下:(1)所有研究的中位生存期均不提供标准差,无法对其进行分析。肝癌的中位生存期短,不能评价中位生存期,仅评价半年和1年生存率,其可信性明显下降。各个研究的年代久远,其可比性下降。(2)半年和1年生存率的异质性分析结果表明,各研究间差异很大,均选用了随机效应模型。异质性的来源有以下几方面:(1)选择偏倚:每个临床试验入选患者的病情严重程度有一定的差别,很难同质化。(2)化疗方案是以阿霉素为基础,但仍涉及其它的传统化疗方案,如其中一个研究的化疗方案为5-FU+MMC。(3)各研究组间的对照组支持治疗的强度并不完全相同,奥曲肽、他莫昔芬和干扰素均为普通的内科治疗药物,但这些药物之间的疗效可能有差异,所以各研究的可比性有所下降。(4)本研究未找到FOLFOX方案跟BSC对比的RCT,FOLFOX这个很可能有效的方案未被纳入,可能使结果产生偏性。(5)本研究未纳入未发表的RCT,出现偏倚难以避免。
因此,老一代的姑息化疗未能显示出生存获益,化疗的毒副作用往往抵消了其生存获益,但由于各个研究结果的异质性大,未能得出定论,部分体质好的患者可能从阿霉素等老一代方案中获益。新一代的化疗方案FOLFOX似乎有一定的生存获益,顾小林等[6]研究为非随机对照研究,对照组入选的是一些体质差或拒绝化疗的患者,这组患者本身的预后就差,所以该研究可信度有限。
晚期肝癌患者的中位生存期很短,生存率并不是很好的评价指标,用生活质量的指标可能更好地显示化疗的效果。
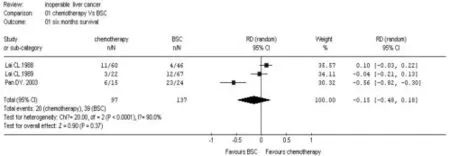
图1 半年生存率的随机效应模型的治疗优势比图
[1]Lopez PM,Villanueva A,Llovet JM.Systematic review:evidencebased management ofhepatocellular carcinoma--an updated analysis of randomized controlled trials[J].Aliment Pharmacol Ther,2006,23(11):1535-1547.
[2]Lai CL,Wu PC,Chan GC,et al.Doxorubicin versus no antitumor therapy in inoperable hepatocellular carcinoma.A prospective randomized trial[J].Cancer,1988,62(3):479-483.
[3]Lai CL,Wu PC,Lok AS,et al.Recombinant alpha 2 interferon is superior to doxorubicin for inoperable hepatocellular carcinoma:a prospective randomised trial[J].Br J Cancer,1989,60(6):928-933.
[4]Pan DY,Qiao JG,Chen JW,et al.Tamoxifen combined with octreotideorregularchemotherapeuticagentsintreatmentofprimary liver cancer:a randomized controlled trial[J].Hepatobiliary Pancreat Dis Int,2003,2(2):211-215.
[5]Schachschal G,Lochs H,Plauth M.Controlled clinical trial of doxorubicin and tamoxifen versus tamoxifen monotherapy in hepatocellular carcinoma[J].Eur J Gastroenterol Hepatol,2000,12(3):281-284.
[6]顾小林,王娟,单桂芹.FOLFOX4治疗晚期肝癌的临床研究[J].现代肿瘤医学,2014,22(9):2153-2155.
[7]Jadad AR,Moore RA,Carroll D,et al.Assessing the quality of report of randomized clinical trials:is blinding necessary?[J]. Controlled Clin Trials,1996,17(1):1-12.
[8]Qin S,Bai Y,Lim HY,et al.Randomized,multicenter,open-label study of oxaliplatin plus fluorouracil/leucovorin versus doxorubicin as palliative chemotherapy in patients with advanced hepatocellular carcinoma from Asia[J].J Clin Oncol,2013,31(28):3501 -3508.
(吴迪编辑)
Meta Analysis of Chemotherapy with Best Supportive Care in the Survival of Inoperable Hepatocellular Carcinoma
LIANG Hanlin,PENG Jiewen,CHEN Kexu
(Department of Chemotherapy,Zhongshan People's Hospital,Zhongshan 528403,China)
Objective:To evaluate the effects of chemotherapy on survival of patients with inoperable hepatocellular carcinoma. Methods:MEDLINE and EMBASE searches were supplemented by information from trial registers.RCT(randomized clinical trial) for chemotherapy of old generation and best supportive care in inoperable hepatocellular carcinoma was selected.Best supportive care may include some non-cytotoxic drug,such as tamoxifen,octreotide and so on.A quantitative meta-analysis using updated information basing on inclusion and exclusion criterion from all available RCT was carried out by two reviewers.The metaanalysis was based on 6 months survival rate and 1 year survival rate.Result:There was no significant improvement for chemotherapy of old generation in 6 months survival rate and 1 year survival rate as compared with best supportive care.Conclusions: There is no convincing evidence that inoperable hepatocellular carcinoma patients will benefit from chemotherapy.A large number of randomized controlled clinical studies should be performed to confirm the efficacy of chemotherapy.
chemotherapy;hepatocellular carcinoma;meta-analysis;median survival
R735.705
A
1008-2344(2016)06-0456-03
10.16753/j.cnki.1008-2344.2016.06.012
2016-03-28

