瘦素调控乳腺癌MDA-MB-231细胞周期进程的研究
周伟强
(沈阳医学院基础医学院,辽宁省环境污染与微生态重点实验室,辽宁 沈阳 110034)
瘦素调控乳腺癌MDA-MB-231细胞周期进程的研究
周伟强
(沈阳医学院基础医学院,辽宁省环境污染与微生态重点实验室,辽宁 沈阳 110034)
目的:研究瘦素诱导乳腺癌MDA-MB-231细胞周期进程。方法:采用MTT、细胞活力、凋亡及细胞周期测定瘦素刺激乳腺癌MDA-MB-231细胞生长、增殖的生物学能力。并采用实时定量PCR及Western blot法测定瘦素对乳腺癌细胞周期调控的分子机制。结果:瘦素作用浓度为1.25 nmol/L、作用时间为24 h的条件下对乳腺癌MDA-MB-231细胞有诱导生长的效果。经瘦素处理后的MDA-MB-231细胞表现为细胞活力显著增强,细胞死亡率和早晚期细胞凋亡发生率明显下降。细胞周期检测结果也证实经瘦素作用后MDA-MB-231细胞进入S期的细胞增多。通过筛查瘦素对细胞周期相关调控因子mRNA和蛋白水平表达影响中发现,瘦素对MDA-MB-231细胞周期调控因子相关的影响主要集中在G1→S期限制点调控上。结论:瘦素可显著刺激乳腺癌MDA-MB-231细胞生长,增强乳腺癌细胞恶变性的生物学能力。
乳腺癌;MDA-MB-231;细胞周期
乳腺癌是女性常见的恶性肿瘤,在我国,乳腺癌发病率占女性恶性肿瘤的7%~10%,仅次于子宫颈癌,近几年发病率攀升,并有年轻化趋势,是妇女恶性肿瘤死亡的主要原因之一,严重危害女性身心健康[1]。自上世纪80年代以来,随着对乳腺癌发生的不断认识,乳腺癌的预防、治疗有了长足的进步,但有效地预防和阻断乳腺癌发生和发展仍是乳腺癌研究的关键和难点之一。
瘦素(Leptin)是Zhang等[2]在1994年通过ob基因定位克隆和定性研究发现并命名的,由146个氨基酸组成、主要为体内白色脂肪细胞分泌的16 kDa蛋白质。人类Leptin基因位于第7号染色体的长臂3区1带3亚带(7q31.3),由3个外显子和2个内含子组成,Leptin通过与相应受体OB-Rb结合而发挥其生物学效应[3]。
Leptin和乳腺癌的发生有着千丝万缕的联系,它可作为一种独立危险因素参与乳腺癌的形成过程[4]。研究表明,随着正常乳腺细胞Leptin水平的增加,刺激雌激素过度生成。这些雌激素持续刺激乳腺邻近脂肪组织的乳腺上皮细胞,使乳腺细胞生长紊乱、过度增殖,并诱发相关的血管增生,最终导致乳腺癌的产生[5]。目前临床上大约1/3乳腺癌患者为雌激素ER-乳腺癌,以恶性程度高、侵袭性强及预后差为主要特征,对于此类乳腺癌人们还没有完全弄清其致癌机制,本文选取雌激素ER-乳腺癌细胞系MDA-MB-231,探讨Leptin在MDA-MB-231细胞增殖过程中的作用,为进一步了解雌激素ER-乳腺癌发生机制提供实验依据。
1 材料与方法
1.1材料人乳腺癌细胞株MDA-MB-231购自美国ATCC细胞库;Leibovitz's L-15培养基、胎牛血清、青霉素及链霉素购自美国Thermo公司;人重组Leptin蛋白购自美国Sigma-Aldrich公司;CellTiter96AQueous One Solution Cell Proliferation Assay试剂盒购自美国Promega公司;Cell Proliferation Assay试剂盒购自美国Roche公司;其他的化学试剂购自美国Sigma-Aldrich公司。
1.2方法
1.2.1细胞培养人乳腺癌MDA-MB-231细胞培养于含15%胎牛血清、100 U/ml的青霉素、100 μg/ml的链霉素的Leibovitz's L-15培养基中。
1.2.2细胞增殖测定将1×104/ml乳腺癌MDAMB-231细胞接种于96孔板各孔中,细胞进行无血清同步化处理后加入不同浓度的Leptin(0、0.625、1.25、2.5、6.5、12.5 μmol/L)与细胞分别孵育24、48和72 h,应用CellTiter96AQueous One Solution Cell Proliferation Assay试剂盒进行MTT测定MDA-MB-231细胞增殖的情况。
1.2.3细胞活力测定将5×105/ml乳腺癌MDAMB-231细胞接种于6孔板各孔中,无血清培养液同步化处理后加入不同浓度Leptin(0、0.625、1.25、2.5、6.5、12.5 μmol/L)与细胞孵育24 h。细胞活力实验参照试剂盒说明书进行。将孵育后的细胞经胰酶消化,收集2×105个细胞加入450 μl Count&Viability reagent静置5 min后应用自动细胞分析仪Muse Cell Analyzer(Millipore)进行检测。
1.2.4细胞凋亡检测按1.2.3方法将不同浓度Leptin与MDA-MB-231细胞共同培养24 h后,收集1×106个细胞与100 μl Muse Annexin V&Dead Cell reagent室温孵育20 min。应用自动细胞分析仪Muse Cell Analyzer检测Leptin作用下MDA-MB-231细胞凋亡发生的情况。
1.2.5细胞周期检测将1.25 nmol/L Leptin与5× 105/ml的MDA-MB-231细胞置于6孔板中共同培养24 h后,加入10 μmol/L BrdU 37℃静置60 min。加入包被Fluorescein荧光素的抗BrdU单克隆抗体按照Cell Proliferation Assay试剂盒说明书操作程序分别通过流式细胞仪和荧光显微镜分析Leptin对MDA-MB-231细胞增殖周期的影响。
1.2.6细胞周期相关调控因子mRNA表达的检测
细胞RNA抽提按试剂盒说明书进行,第一条链cDNA合成后应用SYBR Green方法以GAPDH为内参进行实时定量PCR反应。25 μl反应体系中包含1×SYBR Green Supermix试剂12.5 μl,0.1 μmol/L上、下游引物各0.5 μl,2 μl cDNA(10 ng)和9.5 μl双蒸水。实时定量PCR扩增参数为:50℃2 min,95℃预变性2 min;95℃变性15 s,60℃延伸1 min,延伸后检测荧光信号,共40个循环。每个样品设置3个复孔,mRNA相对表达量按照2-△△Ct法计算。细胞周期蛋白Cyclin E1引物序列:上游为5'-AGCGGTAAGAAGCAGAGCAG-3',下游为5'-TTTGATGCCATCCACAGAAA-3';CDK4引物序列:上游为5'-GAAACTCTGAAGCCGACCAG-3',下游为5'-AGGCAGAGATTCGCTTGTGT-3';CDK2引物序列:上游为5'-CATTCCTCTTCCCCTCATCA-3',下游为5'-CAGGGACTCCAAAAGCTCTG-3';NF-κB引物序列:上游为5'-TCTGCTTCCAGGTGA CAGTG-3',下游为5'-ATCTTGAGCTCGGCAGTG TT-3';Bcl-2引物序列:上游为5'-GGATGCCTTT GTGGAACTGT-3',下游为5'-AGCCTGCAGCTTT GTTTCAT-3';VEGF引物序列:上游为5'-AAGG AGGAGGGCAGAATCAT-3',下游为5'-ATCTGCA TGGTGATGTTGGA-3';GAPDH引物序列:上游为5'-GAGTCAACGGATTTGGTCGT-3',下游为5'-GACAAGCTTCCCGTTCTCAG-3'。
1.2.7细胞周期相关调控因子蛋白表达的检测将1.25 nmol/L Leptin与1×106/ml的MDA-MB-231细胞37℃共同孵育24 h。细胞经胰蛋白酶消化、离心后,将离心后的细胞团块裂解,应用BCA蛋白分析试剂盒测定各样品的蛋白浓度。将20 μg蛋白样品液上样进行SDS-PAGE电泳,经转膜后与相关一抗4℃振荡过夜。PVDF膜经冲洗后加入辣根过氧化物酶(HRP)标记的二抗振荡孵育1 h。将等体积混合的ECL化学发光底物A、B液均匀加在PVDF膜上,显色5 min。化学发光成像系统曝光呈像。应用ImageJ软件标定膜上各显影带的灰度值量化Leptin对MDA-MB-231细胞中各周期调控因子表达的影响。
1.3统计学方法采用SPSS 20.0软件进行统计学分析,采用Student's t-test分析软件进行统计处理,结果以(±s)表示,采用单因素方差分析方法,P<0.05为差异有统计学意义。
2 结果
2.1Leptin对乳腺癌MDA-MB-231细胞增殖的影响MTT检测结果发现,Leptin对乳腺癌MDAMB-231细胞确实有诱导细胞生长的效果。在各实验组中,仅0.625 nmol/L的Leptin未表现出明显的诱导增殖的作用,当Leptin浓度达到1.25 nmol/L时,作用24 h后即表现出明显的刺激乳腺癌细胞生长的特性,这种刺激作用一直维持到48 h。随着作用时间的延长及培养液养分的消耗,孵育时间持续72 h后浓度为1.25 nmol/L的Leptin还有诱导作用。见图1。
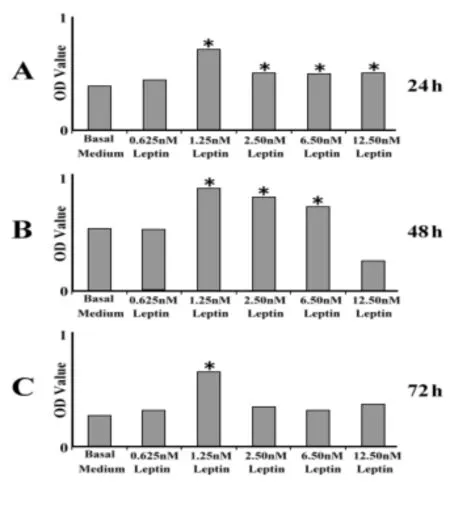
图1 Leptin诱导乳腺癌MDA-MB-231细胞增殖的MTT分析
2.2Leptin对乳腺癌MDA-MB-231细胞活力和细胞凋亡的影响细胞活力实验结果显示:Leptin作用24 h后,与对照组相比,虽然Leptin并未表现出明显的浓度依赖性刺激乳腺癌细胞增殖的特性,但随着Leptin的加入,MDA-MB-231活细胞比率还是有不同程度的增加,其中1.25 nmol/L Leptin诱导下MDA-MB-231活细胞比率由63.9%上升至85.6%,刺激乳腺癌细胞生长效果最明显;而随着Leptin作用浓度的增加,MDA-MB-231细胞活力并未随之增加,这说明单纯增加Leptin作用浓度并不能达到持续诱导乳腺癌细胞生长的目的,见图2。细胞凋亡结果显示:与对照组相比,Leptin作用24 h后发生凋亡的细胞明显减少,其中1.25 nmol/L Leptin作用下MDA-MB-231细胞中已死亡和发生凋亡的细胞比率由对照组的15.75%和5.40%下降至0.95%和1.70%,见图3。
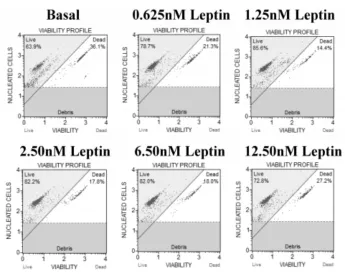
图2 Leptin诱导乳腺癌MDA-MB-231细胞增殖的细胞活力测定
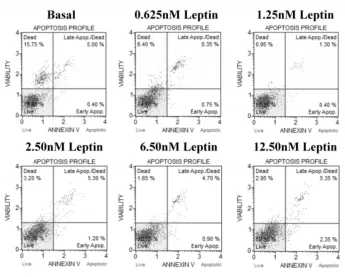
图3 Leptin诱导乳腺癌MDA-MB-231细胞增殖的细胞凋亡测定
2.3Leptin对乳腺癌MDA-MB-231细胞周期的影响荧光显微镜下观察发现,对照组细胞BrdU荧光点主要集中于细胞的胞质和核周,呈散在发布;而在1.25 nmol/L Leptin作用下,MDA-MB-231细胞中的荧光点主要集中在细胞核内,呈密集团块状分布,提示此刻细胞正处于细胞复制旺盛期,见图4A。细胞周期检测结果发现,1.25 nmol/ L Leptin作用MDA-MB-231细胞24 h后,MDAMB-231细胞中S期细胞比率由对照组的22.6%增加至36.5%,与之对应的是G0/G1期细胞由35.0%下降至28.4%,见图4B。
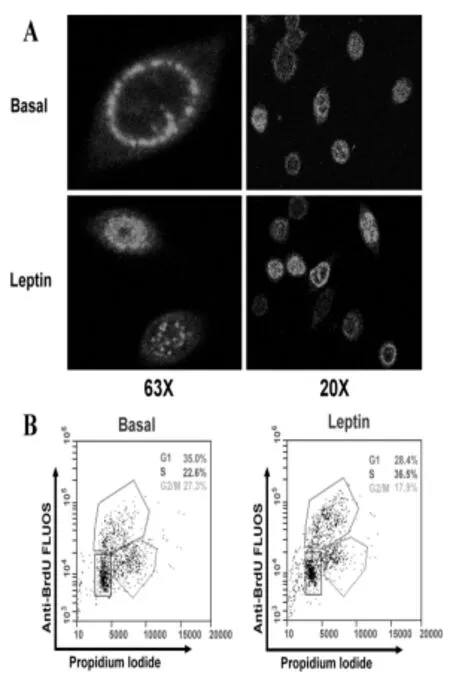
图4 Leptin诱导乳腺癌MDA-MB-231细胞增殖的细胞周期测定
2.4Leptin对乳腺癌MDA-MB-231细胞周期相关分子表达变化的影响实时定量PCR结果表明,与对照组比较,Leptin作用后乳腺癌MDA-MB-231细胞中CDK2、CDK4、Cyclin E1、Bcl-2、NF-κB和VEGF mRNA表达水平都有不同程度的增加,见图5;Western blot结果显示,CDK2、Cyclin E1和Bcl-2蛋白表达水平在Leptin诱导下表达量增加,而CDK4和Cyclin D1蛋白表达水平未发生变化,见图6。
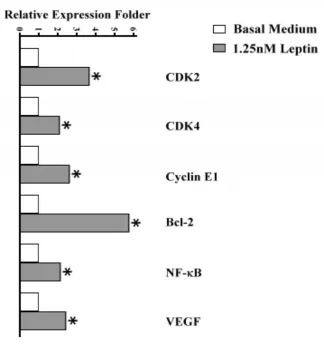
图5 Leptin作用乳腺癌MDA-MB-231细胞周期调控系统的分子mRNA表达的测定
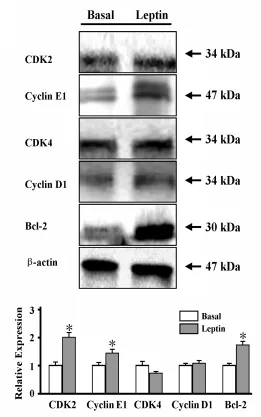
图6 Leptin作用乳腺癌MDA-MB-231细胞周期调控系统的分子蛋'白表达的测定
3 讨论
肥胖症一直被认为是乳腺癌发生的一个重要危险因素,Leptin与肥胖症密切相关,其表达水平的高低与乳腺癌相关[6]。Ozet等[6]采用放射免疫测定法对58例乳腺癌患者血清Leptin水平进行检测,并选取58例健康人作为对照组。结果发现乳腺癌组血清Leptin水平高于对照组(P<0.05);绝经前后、早期和晚期乳腺癌患者血清Leptin水平比较差异无统计学意义。于华等[7]应用放射免疫分析分别检测46例乳腺癌、28例乳腺良性病变患者及41例正常对照组外周血中Leptin水平。结果发现乳腺癌组外周血中Leptin水平明显高于乳腺良性病变组及正常对照组,差异有统计学意义。Leptin表达水平与乳腺癌的发生密切相关,提示Leptin可作为乳腺癌诊断的实验室指标,可用于指导乳腺癌的分期和预后评价及治疗方案的选择。
前期研究发现,Leptin可诱导乳腺癌MDAMB-231细胞的游走,增强其侵袭力[8]。本实验发现,Leptin具有明显的诱导乳腺癌MDA-MB-231细胞生长的特性。经Leptin处理后的MDA-MB-231表现为细胞活力显著增强,细胞死亡率和早晚期细胞凋亡发生率明显下降;经Leptin作用后MDA-MB-231进入S期的细胞增多。Leptin通过诱导芳香化酶(Aromatase)的活性来调节雌激素的生物活性,因此Leptin具有影响雌激素依赖性乳腺癌发生的生物学能力[9-11]。但Leptin对ER-乳腺癌的作用机制目前还不是十分清楚。我们通过筛查Leptin对细胞周期相关调控因子mRNA和蛋白表达水平的影响发现,Leptin对MDA-MB-231细胞周期相关调控因子的影响主要集中在G1→S期限制点调控上,表现为激活CDK2、CDK4和Cyclin E1的表达,并通过诱导细胞凋亡因子Bcl-2的表达抑制细胞凋亡的发生。同时在本实验中,经Leptin作用后,MDA-MB-231细胞中NF-κB和VEGF的表达也显著增加,由于炎症发生、细胞增殖和凋亡等多种通路都是由NF-κB调控的[12-13],因此Leptin可能在乳腺癌发生过程中以自分泌或旁分泌方式促进了正常组织的致癌作用和癌细胞的远处转移,通过激活细胞内相关信号转导通路,在乳腺癌的病程发展和癌细胞侵袭性方面起着重要的作用。
综上所述,Leptin作为脂肪细胞因子之一,在本实验中被证明可以刺激乳腺癌MDA-MB-231细胞生长,增加肿瘤恶变性的生物学能力。但目前对Leptin和乳腺癌关系的认识远未成熟,对Leptin诱导乳腺癌发生的具体机制也尚不清楚,因此本实验为更好地解释乳腺癌发生和在不远的将来开发抗乳腺癌药物提供了理论和实验依据。
[1]曹文东,杨涛,郝斌,等.瘦素及瘦素受体在乳腺癌中的表达及临床意义[J].中华实验外科杂志,2006,23(2):241 -243.
[2]Zhang Y,Proenca R,Maffei M,et al.Positional cloning of the mouse obese gene and its human homologue[J].Nature,1994,372(6505):425-432.
[3]Strong AL,Ohlstein JF,Biagas BA,et al.Leptin produced by obese adipose stromal/stem cells enhances proliferation and metastasis of estrogen receptor positive breast cancers[J]. Breast Cancer Res,2015,17:112.
[4]陈薇,查小明,刘晓安,等.瘦素和瘦素受体在乳腺癌组织中的表达及其与临床预后的关系[J].临床肿瘤学杂志,2010,15(6):493-497.
[5]李春蕊,刘文励,孙汉英,等.瘦素mRNA和瘦素受体mRNA在乳腺癌合并肥胖症患者乳腺癌组织中的表达及其与临床病理的关系[J].中国现代医学杂志,2007,17(13):1569-1571.
[6]Ozet A,Arpaci F,Yilmaz MI,et al.Effects of tamoxifen on the serum leptin level in patients with breast cancer[J].Jpn J Clin Oncol,2001,31(9):424-427.
[7]于华,朱文茹,徐淑华.乳腺癌患者血清Leptin水平检测及其临床意义[J].放射免疫学杂志,2005,18(5):327-329.
[8]Delort L,Rossary A,Farges MC,et al.Leptin,adipocytes and breast cancer:Focus on inflammation and anti-tumor immunity[J].Life Sci,2015,140:37-48.
[9]周伟强.瘦素诱导乳腺癌三阴细胞条MDA-MB-231侵袭的形态学研究[J].沈阳医学院学报,2016,16(4):234-236.
[10]Chang CC,Wu MJ,Yang JY,et al.Leptin-STAT3-G9a signaling promotes obesity-mediated breast cancer progression[J]. Cancer Res,2015,75(11):2375-2386.
[11]Assiri AM,Kamel HF, Hassanien MF.Resistin,visfatin,adiponectin,and leptin:risk of breast cancer in pre-and postmenopausal saudi females and their possible diagnostic and predictive implications as novel biomarkers[J].Dis Markers,2015,2015:253519.
[12]Catalano S,Leggio A,Barone I,et al.A novel leptin antagonist peptide inhibits breast cancer growth in vitro and in vivo[J].J Cell Mol Med,2015,19(5):1122-1132.
[13]Papanikolaou V,Stefanou N,Dubos S,et al.Synergy of leptin/ STAT3 with HER2 receptor induces tamoxifen resistance in breast cancer cells through regulation of apoptosis-related genes[J].Cell Oncol(Dordr),2015,38(2):155-164.
(文敏编辑)
Leptin Regulates the Progression of Cell Cycle for Breast Cancer Cell Line MDA-MB-231
ZHOU Weiqiang
(Shenyang Medical College,Key Laboratory of Environmental Pollution and Microecology of Liaoning Province,Shenyang 110034,China)
Objective:To study cell cycle progression induced by leptin in breast cancer cell line MDA-MB-231.Methods:MTT,cell viability test,apoptosis assays and cell cycle analysis were used to detect the effects of leptin on cell growth and proliferation of breast cancer cell line MDA-MB-231.QPCR and Western blot assay were used to assess the molecular mechanisms of leptin on cell cycle regulation of MDA-MB-231 cells.Results:When treated with 1.25 nmol/L leptin for 24 hours,the MDA-MB-231 cells were stimulated to grow obviously.With the leptin treatment,the cell viability was increased markedly and the cell death rate and apoptosis rate was decreased significantly.Cell cycle assay displayed that S phase cells increased after leptin induction.By screening the mRNA and protein levels of cell cycle regulatory factors,the results were demonstrated that leptin could speed up the transition from G1 to S phase in MDA-MB-231 cells.Conclusion:Leptin can significantly stimulate breast cancer MDA-MB-231 cell growth,strengthen the malignant ability of breast cancer cells.
breast cancer;MDA-MB-231;cell cycle
R394.3
A
1008-2344(2016)06-0421-05
10.16753/j.cnki.1008-2344.2016.06.002
国家自然科学基金项目(No.81172509)
周伟强(1970—),男(汉),教授.研究方向:乳腺癌发生与调控.E-mail:zhouwq@hotmail.com
2016-05-09

