单纯性马蹄内翻足模型鼠足踝部组织中Col9a1基因表达的研究
王正东,王鑫宇,颜南,孟欣雨,曾亮,王效杰
(1.沈阳医学院基础医学院解剖学教研室,辽宁 沈阳 110034;2.基础医学院临床医学专业2014级3班;3.医学应用技术学院康复教研室)
单纯性马蹄内翻足模型鼠足踝部组织中Col9a1基因表达的研究
王正东1,王鑫宇2,颜南3,孟欣雨2,曾亮1,王效杰1
(1.沈阳医学院基础医学院解剖学教研室,辽宁 沈阳 110034;2.基础医学院临床医学专业2014级3班;3.医学应用技术学院康复教研室)
目的:研究Col9a1基因在单纯性马蹄内翻足(idiopathic congenital talipes equinovarus,ICTEV)模型鼠足踝部组织的表达规律。方法:制作ICTEV模型,分别取模型组及对照组大鼠足踝部组织,采用免疫荧光染色及免疫组化染色技术检测Col9a1蛋白的表达。结果:模型组足踝部组织中Col9a1蛋白表达水平高于对照组(P<0.05),主要分布在软组织和软骨膜。结论:Col9a1基因在ICTEV模型大鼠足踝部组织的表达升高可能与ICTEV畸形的产生有关。
全反式维甲酸;Col9a1基因;单纯性马蹄内翻足;组织;Ⅸ型胶原
单纯性马蹄内翻足 (idiopathic congenital talipes equinovarus,ICTEV)是一类比较常见的先天性疾病,其主要表现为婴儿出生即出现腓侧肌肉痉挛,胫侧肌肉因牵伸而松弛所导致的跟骨内翻、足尖内收、跖骨旋后、踝关节垂下,呈现马蹄状。先天和后天均能发病,发生率大约为1‰~6‰,男女比例约为3∶1[1],且男性具有遗传倾向[2]。其发病原因目前仍不明确。研究普遍认为主要的致病因素为基因遗传、神经、肌肉病变、血管异常、软组织痉挛等[3],另外家族遗传、吸烟、气候等因素也是引起ICTEV的原因[4-5]。因此研究ICTEV的分子病理机制及其演变过程等显得极为重要。
由于当前治疗方法等因素限制,获取ICTEV病理标本极为困难。因此,建立ICTEV模型是研究这种疾病致病因素和发病进程的重要基础。有研究表明:全反式维甲酸(all-trans-retinoic acid,ATRA)为维生素A衍生物在生物体内的正常存在形式,ATRA对多种动物有致畸作用。有报道称,孕妇在妊娠初期为治疗皮肤病服用维甲酸(RA)可导致胎儿畸形[6]。体内发育中的软骨细胞为ATRA的主要靶细胞,高剂量的ARTA会影响生长过程中骨骼,有致畸作用。已有报道表明,ATRA可以诱导包括ICTEV在内的多种畸形发生[7]。本研究将使用ATRA诱导孕鼠制作ICTEV模型,作为研究ICTEV机制的模型。
在目前的研究中与下肢发育有关的基因有DTDST、COL9A1[8]、COL1A1[9]、FGF、GIL3[10-11]等。国内学者对84例ICTEV核心家族COL9A1基因簇的7个多态位点进行鉴别研究,结果显示COL9A1基因可能为ICTEV的易感基因[8]。本研究通过ATRA灌胃孕鼠,制作ICTEV模型,观察以这种方法制作的ICTEV模型与ICTEV患者之间是否具有一致性,并且通过进一步检测ICTEV模型中Col9a1蛋白的表达水平及定位,来判断其是否与人的Col9a1蛋白表达具有相关性。
1 材料与方法
1.1实验动物普通级SD大鼠140只,雌雄各70只,体重320~350 g,购于沈阳医学院实验动物中心(动物合格证号2015-0001)。
1.2ICTEV模型的制作及取材将SD大鼠按雌雄比例1∶1置于笼中夜间交配,第2天通过阴道涂片检查,获得孕鼠63只。将孕10 d的大鼠随机分为对照组(22只)和实验组(41只),实验组大鼠按135 mg/kg体重用灌胃法给予ATRA(Sigma公司),对照组给予相应体积矿物油。孕21 d剖腹取出胚胎,观察并选取其足踝部前部内收、足后部内翻、跖骨旋后、向下垂呈现马蹄状的幼鼠,取幼鼠的软组织制成标本。
1.3实验方法
1.3.1免疫荧光方法检测Col9a1蛋白的表达取实验组和对照组幼鼠足踝部组织标本,甲醛固定1 d后,沉入40%蔗糖2 d,常规制作冰冻切片,采用免疫荧光方法检测Col9a1蛋白表达部位。(1)取0.01 mol/L,pH 7.4的PBS滴于标本片上,保持10 min后弃除,置于有盖瓷搪盒中,使标本片处于同一定湿度的环境;(2)使用0.01 mol/L,pH 7.4的PBS适当稀释兔抗鼠Col9a1抗体(Santa Cruz Biotechnology公司),使标本片置于有盖搪瓷盒内,37℃下保温30 min;(3)将标本片从搪瓷盒中转至标本架,首先使用0.01 mol/L,pH 7.4的PBS冲洗2次,然后依次使其经过0.01 mol/L,pH 7.4的PBS三缸浸泡,每缸5 min,不时振荡;(4)取出标本片,用滤纸除掉部分水分,但不使标本片干燥,滴加一滴一定稀释度的羊抗兔FITC标记的二抗(Santa Cruz Biotechnology公司);(5)将标本片平放在有盖搪瓷盒内,37℃保温30 min;(6)重复操作步骤(3);(7)取出标本片,用滤纸除掉部分水分,滴加一滴缓冲甘油,覆上盖玻片;(8)使用荧光显微镜进行观察并拍照。
1.3.2免疫组化法检测Col9a1蛋白的表达水平取实验组和对照组幼鼠足踝部组织标本,甲醛固定1 d后,沉入40%蔗糖2 d,常规制作冰冻切片,免疫组化方法检测Col9a1蛋白表达,用链霉菌抗生物素蛋白-过氧化酶染色法,按试剂盒说明书操作。(1)PBS洗3次;(2)加入过氧化物酶阻断液A灭活内源性酶,室温下孵育10 min,PBS洗3次;(3)抗原修复,柠檬酸盐缓冲液煮沸8 min,冷却后取出;PBS洗3次;(4)加非免疫性动物血清封闭液B,甩去血清;(5)加入第一抗体4℃过夜,PBS洗3次;(6)加生物素标记的二抗,PBS洗3次;(7)加链亲和素-过氧化物酶溶液D,PBS洗3次。(8)加DAB显色,待显色后自来水冲洗,苏木素复染,脱水,中性树胶封固。(9)免疫组化染色分析:以不加一抗的正常切片为阴性对照。Col9a1蛋白为细胞质染色,与阴性对照进行比较。在100倍视野中随机取4个视野,然后采用Imagepro plus 6.0软件进行平均灰度值扫描。
1.4统计学方法采用SPSS 10.0软件进行统计学分析,组间比较采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1建模结果对照组孕21 d剖腹获得幼鼠212只,实验组孕21 d剖腹获得幼鼠245只,其中74只幼鼠仅具有下肢足部畸形,占30.2%,与人类ICTEV患者足踝部具有一定相似性,均呈现足尖内收、踝骨内翻、距舟关节面由原来的向前转向内侧面,舟骨内侧变小且向内移位,呈现内收畸形,足踝部整体呈现马蹄状,表明模型构建成功。2.2免疫荧光结果Col9a1蛋白主要定位于实验组幼鼠足踝部软组织及骨化中心部位,在骨细胞中只有少量表达,见图1。
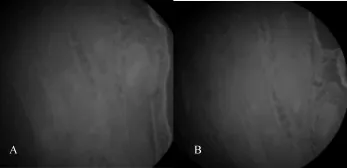
图1 幼鼠足踝部组织Col9a1蛋白表达(免疫荧光染色,×100)
2.3免疫组化结果2组Col9a1蛋白均主要表达在足踝部软组织中,在软骨组织中主要表达在软骨膜区域,在骨组织中有少量表达,阳性颗粒表达在细胞质,见图2。实验组幼鼠足踝部组织Col9a1蛋白表达的平均光密度比为(1.8±0.07),明显高于对照组(1.0±0.05)(P<0.05)。
3 讨论
1980年,Ippolito等[12]提出了软组织痉挛导致ICTEV的理论。2004年赵东风等[13-14]对15例ICTEV患者及5例非神经、胶原病及肌肉死亡的小儿的踝内侧及腓骨肌深筋膜进行扫描电镜对比研究后,推测ICTEV的致病因素可能为足内侧肌肉纤维化,但是对具体的分子机制仍无法解释。部分国外学者发现ICTEV患者的足跟部和足踝部韧带出现异常增厚,认为可能是患儿足踝部出现了较多的肥大细胞和成纤维细胞[15],这些细胞的增生增加了胶原纤维的厚度,可能是导致ICTEV的原因之一。胶原作为细胞外基质的主要成分,在维持组织器官的完整性,参与人体早期发育、器官形成、细胞趋化等方面均起到重要作用。当胶原的产生过多或过少时,都可能引起疾病。胶原根据分子结构分类,可以分为成纤维胶原和非成纤维胶原,其中Ⅸ型胶原可以与成纤维胶原相互作用。Col9a1基因在生长过程中编码Ⅸ型胶原的α1链,是构成透明软骨的重要胶原成分;而Ⅸ型胶原在调节Ⅱ型胶原直径方面具有重要作用。Nakata等[16]研究发现在Col9a1开放阅读框内有一段基因缺失可能导致轻微的软骨发育不良,随时间的推移会产生骨关节炎性病变。国内学者在25例ICTEV患儿的肌肉组织中检测出22例COL9A1(88%)表达阳性,5例正常组织中2例COL9A1(20%)表达阳性,证明了COL9A1基因在人体内表达上调与ICTEV发生具有相关性[8,17]。
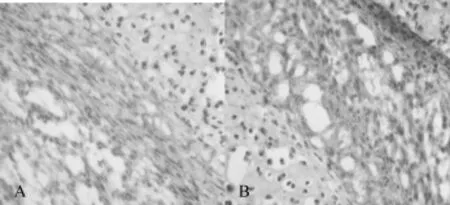
图2 幼鼠足踝部组织Col9a1蛋白表达(免疫组化染色,×400)
在当前的医疗环境下,对于ICTEV的治疗不再使用传统皮下跟腱切除术而改用跟腱延伸术[18-19],由于极难获得患者的病例标本,因此建立稳定的动物模型极为重要。大量研究结果表明,当RA处于低浓度时,可以促进软骨细胞生长,在高浓度则会抑制软骨细胞生长而引起畸形。一些研究表明,RA的浓度稍稍有所改变将极大地影响成软骨细胞的表达[20]。高浓度RA将过度激活RA受体,进而影响视黄酸信号系统引导的下游调控基因的表达,或干扰其他基因表达调控因子来调节靶基因,从而产生畸形[21]。本研究使用ATRA对实验组孕鼠灌胃,孕21 d后剖腹取出胎鼠,将出现典型畸形足的实验鼠与对照组相对比,发现实验鼠足前部向内倾斜,距骨变小,位于跟骨后方,呈现菱形;胫骨关节内屈,跟骨发生内收,产生后足外旋、前足内旋[22-23],内侧肌腱、筋膜、韧带等均存在不同程度的挛缩和变短,距骨骨化中心较正常小,其距骨头和颈生长均发育异常,因此该模型与患儿ICTEV在形态上具有较高的一致性。但ATRA具有很强的胚胎毒性,造成许多例死胎、吸收胎,而且由ATRA产生的畸形不单单局限于足踝部,还表现在眼部畸形(表现为眼部突出、眼内流血、晶状体浑浊),后足畸形(表现为马蹄内翻足),尾部畸形(表现出无尾、短尾、螺旋尾),前肢短小,开放性脊柱裂等,甚至出现多种畸形共存,这些对ICTEV模型的制作产生了极大的影响。人类ICTEV患儿的致畸因素多种多样,包含了遗传、肌肉、神经、环境、气候等,是由多种因素作用导致的,且仅仅表现在足踝部,全身其他部位并不表现出畸形,然而ATRA的致畸作用则是作用于全身,会有多种畸形合并的现象,目前普遍的ICTEV模型制作方法虽存在着与人ICTEV有一定的相似性,但也有很大的局限性。135 mg/kg ATRA灌胃制作ICTEV模型鼠是国内外学者普遍使用的模型制作方法,且135 mg/ kg ATRA制作的ICTEV模型具有的胚胎毒性和合并畸形率最少,是目前最接近人类ICTEV的模型。
在目前的模型基础上,本研究采用免疫荧光标记检测实验组大鼠Col9a1蛋白的表达,发现Col9a1蛋白主要表达在足踝部软组织中,尤其在骨化中心及软骨骨膜中。并且2组大鼠经免疫组化染色后统计发现实验组足踝部组织Col9a1蛋白表达水平明显高于对照组。通过对比发现,通过ATRA灌胃制作的ICTEV模型与ICTEV患儿的COL9A1基因在软组织表达上具有一定的相似性。但是由于没有记载患儿足踝部软骨及骨组织COL9A1基因表达的文献,并且临床上也无法获得患儿患儿足踝部软骨及骨组织病理标本,所以在该部位的表达无法比较。
有研究表明,前列腺素、糖皮质激素、血清、各种生长因子等,在胶原的生理生成和纤维化发展方面起着重要作用[24-25]。我们推测ATRA通过一系列途径调节Col9a1基因表达上调,Col9a1基因编码大量Ⅸ型胶原与成纤维胶原相互作用,产生了大量肥大细胞、成纤维细胞和纤维细胞[15],随后胶原发生聚集沉淀,导致ICTEV初期的局部纤维化,腓侧肌肉痉挛产生较强的拉力,破坏正常的肌力平衡,将患足拉向内侧畸形部位,即产生了距骨变下,位于跟骨后方,足前收,外踝后移与跟骨、肌腱等距离变短,距舟关节方向发生改变等表现。
综上所述,目前由ATRA灌胃产生的ICTEV模型具有一定的局限性。理想的ICTEV模型应该是不具有胚胎毒性,并且全身其他部位不发生畸形。当前出现这种理想模型的概率仅有30.2%,建立优秀的动物模型是进行临床疾病研究的首要工作,对研究ICTEV有重要的理论价值和临床意义,因此在当前的模型基础上进行突破创新,探索更加有效的制作方法是极为重要的。同时,RA调节Col9a1基因表达升高的调节途径以及Col9a1基因以何种方式参与ICTEV的病程发展目前没有明确的发现。因此,我们需要在动物模型的基础上进一步寻找Col9a1基因的上游因子,以求揭示ICTEV产生的具体分子机制。
[1]Wallander HM.Congenital clubfoot.Aspects on epidemiology,residual deformity and patient reported outcome[J].Acta Orthop Suppl,2010,81(339):1-25.
[2]毛宾尧.严重马蹄内翻足的诊疗进展[J].中国矫形外科杂志,2012,20(5):422-424.
[3]Chapman C,Stott NS,Port RV,et al.Genetics of club foot in Maori and Pacific people[J].J Med Genet,2000,37(9):680-683.
[4]Gibbons PJ,Gray K.Update on clubfoot[J].J Peadiatr Child Health,2013,49(9):E434-E437.
[5]Lipson AH,Collins F,Webster WS.Multiple congenital defects associated with maternal use of topical tretinoin[J].Lancet,1993,341(8856):1352-1353.
[6]Collins MD,Mao GE.Teratology of retinoids[J].Annu Rev Pharmacol Toxicol,1999,39:399-430.
[7]EngellV,NielsenJ,DamborgF,et al.Heritabilityofclubfoot:a twin study[J].J Child Orthop,2014,8(1):37-41.
[8]刘丽英,金春莲,曹东华,等.COL9A1基因与先天性马蹄内翻足相关性的研究[J].遗传,2007,29(4):427-432.
[9]赵宁,金春莲,刘丽英,等.COL1A1基因转录调控序列变异与单纯性马蹄内翻足的相关性[J].遗传,2008,30(6):723-727.
[10]Cao D,Jin C,Ren M,et al.The expression of Gli3,regulated by HOXD13,may play a role in idiopathic congenital talipes equinovarus[J].BMC Musculoskelet Disord,2009,10:142.
[11]曹东华,张炫,林长坤,等.GLI3基因在单纯性马蹄内翻足发病机制中的作用[J].中华医学遗传学杂志,2012,29(3):260-265.
[12]Ippolito E,Ponseti IV.Congenital clubfoot in the human fetus.A histological study[J].J Bone Joint Surg Am,1980,62(1):8-22.
[13]赵东风,岳勇,赵黎,等.先天性马蹄内翻足患者深筋膜超微结构观察[J].中国组织工程研究,2004,8(8):1504-1505.
[14]赵东风,岳勇,黄耀添,等.先天性马蹄内翻足深筋膜胶原的免疫组化研究[J].中华小儿外科杂志,2004,25(2):182-184.
[15]Bergerault F,Fournier J,Bonnard C.Idiopathic congenital clubfoot:Initial treatment[J].Orthop Traumatol Surg Res,2013,99(1 Suppl):S150-S159.
[16]Nakata K,Ono K,Miyazaki J,et al.Osteoarthritis associated with mild chondrodysplasia in transgenic mice expressing alpha 1(IX)collagen chains with a central deletion[J].Proc Nat Acad Sci U S A,1993,90(7):2870-2874.
[17]刘丽英,金春莲,蒋丽,等.COL9A1基因在单纯性马蹄内翻足中的表达及其多态性分析[J].中国当代儿科杂志,2011,13(6):478-481.
[18]董静静,颉强,雷伟.先天性马蹄内翻足早期肌力平衡手术中期及远期疗效对比分析[J].中华小儿外科杂志,2010,31(6):444-447.
[19]管仲良,李战春,王丹,等.先天性马蹄内翻足的三维有限元分析在临床手术中的应用[J].浙江创伤外科,2012,17(6):760-761.
[20]Hoffman LM,Garcha K,Karamboulas K,et al.BMP action in skeletogenesis involves attenuation of retinoid signaling[J].J Cell Biol,2006,174(1):101-113.
[21]Hernandez RE,Putzke AP,Myers JP,et al.Cyp26 enzymes generate the retinoic acid response pattern necessary for hindbrain development[J].Development,2007,134(1):177-187.
[22]Seringe R,Wicart P.The talonavicular and subtalar joints:the“calcaneopedal unit”concept[J].Orthop Traumatol Surg Res,2013,99(6 Suppl):S345-S355.
[23]杜世新,吉士俊,马瑞雪,等.类先天马蹄内翻足动物模型的建立及病理演变研究[J].中华小儿外科杂志,2003,24(2):158-160.
[24]Gao C,Wang H,Huang C,et al.Study of activity of promoter from mouse alpha2 procollagen gene[J].Chin Med J,1999,112(4):316-320.
[25]Laping NJ,Olson BA,Ho T,et al.Hepatocyte growth factor:a regulator of extracellualar matrix genes in mouse mesangial cells[J].Biochem Pharmacol,2000,59(7):847-853.
(文敏编辑)
Expression ofCol9a1Gene in Ankle Tissue of Rat Model of Idiopathic Congenital Talipes Equinovarus
WANG Zhengdong1,WANG Xinyu2,YAN Nan3,MENG Xinyu2,ZENG Liang1,WANG Xiaojie1
(1.Department of Anatomy,Shenyang Medical College,Shenyang 110034,China;2.Grade 14 Class 3;3.Department of Rehabilitation)
Objective:To investigate the expression of Col9a1 gene in ankle tissue of rat model of idiopathic congenital talipes equinovarus(ICTEV).Methods:ICTEV rat model was established.Immunofluorescence staining and immunohistochemical dyeing technology were used to detect the expression of Col9a1 protein in ankle tissue of model group and control group.Results:The expression level of Col9a1 protein in ankle tissue in model group was higher than that in the control group(P<0.05),Col9a1 gene expressed primarily in soft tissue and cartilage membrane.Conclusion:The increasing expression level of Col9a1 gene in ankle tissue of ICTEV rats may be related to clubfoot deformity.
all-trans-retinoic acid;Col9a1;idiopathic congenital talipes equinovarus;tissue;collagen typeⅨ
沈阳医学院博士科研启动基金项目(No.20133055)
王正东(1977—),男(汉),副教授,博士,研究方向:单纯性马蹄内翻足分子遗传学.E-mail:wzd_2008@163.com
R682.16
A
1008-2344(2016)06-0426-04
10.16753/j.cnki.1008-2344.2016.06.003
2016-06-16

