FOXO3在结直肠癌组织中的表达及临床意义
刘 鑫 胡皆乐 李 佑 刘 坤 蒋奕玫 罗秀芳 赵 任
FOXO3在结直肠癌组织中的表达及临床意义
刘 鑫 胡皆乐 李 佑 刘 坤 蒋奕玫 罗秀芳 赵 任
目的 探讨叉头框蛋白O3(forkhead box class O3,FOXO3)在结直肠癌(colorectal cancer,CRC)组织中的表达及其临床意义。方法 选择手术切除的结直肠癌标本100份,采用实时定量PCR(real-time quantitative PCR,RT-qPCR)检测结直肠癌组织及相应正常癌旁组织中FOXO3基因mRNA水平表达,采用蛋白免疫印迹法(Western blot,WB)检测上述患者FOXO3蛋白的表达,采用免疫组织化学方法(immunohistochemistry,IHC)检测肠癌组织样本与正常肠粘膜组织FOXO3蛋白的表达。结果 肠癌肿瘤组织中FOXO3 mRNA、蛋白表达水平显著低于远端癌旁组织(P<0.05);FOXO3阴性组生存率较FOXO3阳性组和FOXO3强阳性组生存率显著降低(P<0.05);FOXO3强阳性组与FOXO3阳性组生存率比较无明显差异(P>0.05);FOXO3表达与肿瘤分化(χ2=32.7468,P=1.05e-08)、浸润深度(χ2=4.0921,P=0.04308)、淋巴结转移(χ2=5.7301,P=0.01668)、TNM分期(χ2=9.2374,P=0.01451)及组织学分类(χ2=8.5963,P=0.01359)密切相关。结论 FOXO3表达可能与结直肠癌的肿瘤分化、浸润深度、淋巴结转移、TNM分期和组织学分类有关。FOXO3表达可能成为判定结直肠癌严重程度及预后效果的预测因子。
结直肠癌;免疫组织化学;FOXO3;RT-qPCR;Western Blot
(ThePracticalJournalofCancer,2016,31:1773~1777)
结直肠癌(colorectal cancer,CRC)是消化道常见的恶性肿瘤之一[1-4],随着我国人民生活质量的不断提高以及饮食习惯的改变,结直肠癌已成为近年来发病率增长最快的肿瘤之一,现已成为我国发病率第三、病死率第五的恶性肿瘤[5]。结直肠癌的发生、发展是1个长期多因素、多阶段参与的复杂过程[2-3],其详细病因及发病机制尚不明确。Forkhead转录因子是2000年才正式统一命名的新转录因子家族[6],其中研究最深入的是O亚家族(FOXO)。叉头框蛋白O3(forkhead box class O3,FOXO3)是FOXO亚家族的重要成员,研究表明FOXO3在肝癌、肺癌、胃癌、原发性乳腺癌等多种恶性肿瘤中表达降低,与肿瘤的发生、侵袭和转移密切相关,已成为近年来研究的热点[7-9]。Bullock等[10]于2013年对FOXO3在结直肠癌中的表达和临床意义进行了探究。Bullock等的研究病例样本为欧罗巴人种,由于人种的差异,可能其中的某些结果不能很好的反映中国人的情况。
综上,为深入研究FOXO3在结直肠癌发生、发展中的作用,本研究选择手术切除的结直肠癌标本100份,采用RT-qPCR、Western Blot、免疫组织化学等方法检测了结肠癌肿瘤组织和相应癌旁正常组织中FOXO3在mRNA和蛋白质的表达水平,同时通过对肠癌患者进行为期3年的随访,结合病人癌组织中FOXO3的表达进行分组并统计其生存率,并采用计数资料列联表的相关分析法分析FOXO3表达与结直肠癌临床病理特征的关系。
1 材料与方法
1.1 标本及医疗数据收集
收集上海交通大学附属瑞金医院2008至2011年经手术切除的结直肠癌冻存组织100例及相应正常肠黏膜冻存组织(距肿瘤组织5 cm以上)100例,收集整理该100例患者3年的随访记录,用于生存率分析。所有病例临床及病理资料完整,其中男性65例,女性35例;≤60岁患者38例,>60岁患者62例;肿瘤直径≤5 cm的病例43例,>5 cm的病例57例;肿瘤高分化31例(男性15例、女性16例),肿瘤中分化程度37例(男性18例、女性19例),低分化32例(男性27例,女性5例);肿瘤浸润程度低(T1~2)52例,浸润程度高(T3~4)48例;淋巴结无转移56例,淋巴结转移44例;TNM Ⅰ、Ⅱ、Ⅲ、Ⅳ分期患者分别为23例、33例、30例、14例;组织学分类:腺癌、粘液癌、未分化癌患者分别为68例、22例和10例。所有患者术前均未进行放疗、化疗以及其他针对肿瘤的特殊治疗,术后病理检查均经两位病理医师诊断。
按照患者肿瘤分化程度及性别,从31例肿瘤高分化患者中随机选取2例(男女各1例),37例中分化患者中随机选取2例(男女各1例),32例低分化患者中随机选取1例(男性),分别记为C1、N1、C2、N2、C3、N3、C4、N4、C5、N5(其中C代表癌症组织,N代表癌旁正常组织)。
1.2 主要试剂
兔抗人FOXO3多克隆抗体和EnVisionⅢ加强型试剂盒购于Thermo Fisher Scientific公司。RT-qPCR试剂盒购自大连宝生物工程有限公司。
1.3 RT-qPCR法测定CRC组织和相应癌旁正常组织中FOXO3 mRNA的表达水平
采用RT-qPCR法测定五个样本中CRC组织及癌旁正常组织中FOXO3 mRNA的表达水平,每个样品设置5个平行重复。
①根据文献,应用primer premier 6.0软件设计引物FOXO3:上游引物,5'-AAGCCAGCTACCTTCTCTTCCA-3';下游引物,5'-GTGGCTAAGTGAGTCCGAAGTGA-3'。②采用异硫氰胍一步法快速提取总RNA。③根据宝生物公司RT-qPCR试剂盒说明书操作,琼脂糖凝胶电泳后,用凝胶成像分析系统及灰度分析软件测平均灰度值,以β-actin为内参照。
1.4 Western Blot法检测CRC组织和相应癌旁正常组织中FOXO3蛋白表达水平
采用Western Blot检测CRC组织和相应癌旁正常组织中FOXO3蛋白表达水平。裂解各样本细胞提取总蛋白,按每个泳道20 μg进行十二烷基硫酸钠-聚丙酰胺凝胶电泳,采用Bio-Red标准湿式转膜装置转移至硝酸纤维素膜上,转膜电流300 mA,转膜时间为90 min;加入5%脱脂奶粉封闭液,室温摇床封闭1 h后加入FOXO3及β-actin鼠抗单克隆一抗,4 ℃孵化过夜;洗膜后加入辣根过氧化物酶标记的单克隆鼠抗,1∶4000稀释,室温孵化1 h;洗膜后使用增强化学发光试剂及凝胶成像分析系统进行扫描,采用Image J图像分析软件对FOXO3蛋白表达进行分析,以目的条带吸光度与β-actin条带吸光度比值作为各目的条带的相对表达水平。
1.5 免疫组织化学测定FOXO3在CRC组织和相应癌旁正常组织中表达情况
采用EnVisionTM二步法,分别测定100份CRC组织及相应正常癌旁组织中FOXO3蛋白表达。各样本石蜡切片常规脱蜡至水,以依地酸为抗原修复液进行微波抗原修复,3%过氧化氢溶液常温孵育15 min,滴加一抗(兔抗人FOXO3单克隆抗体,浓度1∶50),4 ℃过夜后滴加二抗(EnVisionⅢ加强型试剂盒),室温孵育2 h,DAB显色,脱水,透明,封片,显微镜观察。
本实验中所有免疫组织化学染色结果均采用双盲法阅片,由两位有经验的病理医师分别作出判断。FOXO3蛋白免疫组化以细胞核呈现棕黄色颗粒为阳性,每张切片于400倍光镜下随机取5个视野,每个视野计数100个细胞,根据每个视野中阳性细胞数百分比和染色强弱进行评分。镜下观察肿瘤实质细胞着色强度:0分,细胞无着色;1分,阳性细胞数染色呈淡棕色;2分,阳性细胞染色呈棕色;3分阳性细胞染色呈棕褐色。着色广度:0分,阳性细胞数比率<1 %;1分,阳性细胞数比率2%~25%;2分,阳性细胞数比率26%~50%;3分,阳性细胞数比率51%~75%;4分,阳性细胞数比率>75%。然后判定各标本的染色得分。着色总分(0-12):广度强度;总分分级:0~4分视为0级,为阴性表达(FOXO3+/-);5~8分视为I级,为阳性表达(FOXO3+/+);9~12分视为Ⅱ级,为强阳性表达(FOXO3+++-++++)。
1.6 结直肠癌患者生存率分析
对100例接受手术的结直肠癌患者进行为期3年的随访,按照免疫组织化学结果,将100例患者分为三组(FOXO3阴性组、FOXO3阳性组和FOXO3强阳性组),每组分别根据不同时间下患者的存活数目绘制结直肠癌患者的生存率图。
1.7 统计学方法
2 结果
2.1 CRC组织和相应癌旁正常组织中FOXO3 mRNA表达水平(图1)
CRC组织和相应癌旁正常组织中FOXO3mRNA相对表达水平见图1,随机选取的5例CRC肿瘤组织中FOXO3表达水平显著低于相应癌旁正常组织的(P<0.05)。

图1 CRC组织和相应癌旁正常组织中FOXO3 mRNA的表达水平
2.2 CRC组织和相应癌旁正常组织中FOXO3蛋白表达水平
在CRC组织和相应癌旁正常组织中FOXO3蛋白相对表达水平见图2,由灰度图和相对表达量柱状图可知,与癌旁正常组织相比,随机选取的5例CRC患者肿瘤组织中FOXO3蛋白的表达水平显著降低(P<0.05)。
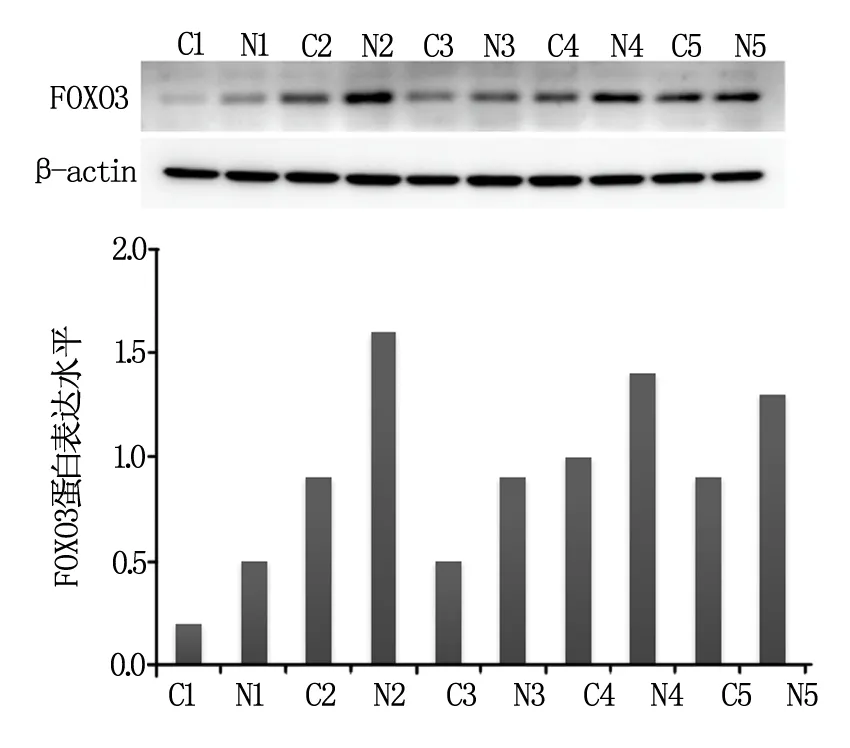
图2 CRC组织和相应癌旁正常组织中FOXO3蛋白表达水平
2.3 免疫组织化学结果
对100例CRC组织及相应癌旁正常组织进行免疫组化染色。FOXO3蛋白阳性产物为棕黄色颗粒,定位于细胞核。经双盲法阅片,根据每个视野中阳性细胞数百分比和染色强弱进行评分并比较其阳性率,统计结果表明,CRC组织中FOXO3蛋白表达阳性率显著低于正常粘膜组织(P<0.01)。
2.4 3年生存率
FOXO3不同表达水平组3年生存率见图3,FOXO3阴性组患者的3年生存率显著低于FOXO3阳性组和FOXO3强阳性组(P<0.01),而FOXO3阳性组和FOXO3强阳性组3年生存率比较无显著性差异(P>0.05)。
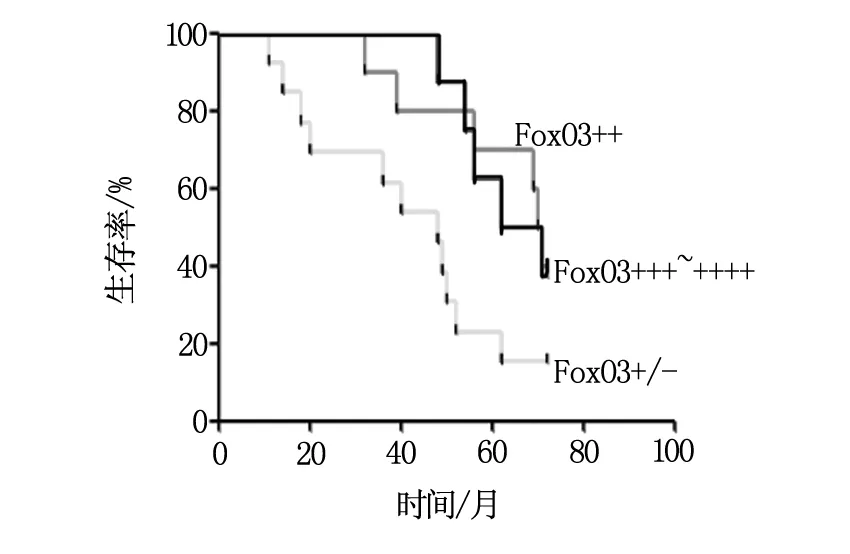
图3 FOXO3不同表达水平组3年生存率比较
2.5 FOX03蛋白表达与结直肠癌临床病理特征的关系
FOXO3蛋白表达(FOXO3强阳性组和FOXO3阴性组)与结直肠癌临床病理特征的关系见表1,结果显示,FOXO3蛋白表达与患者性别、年龄及肿瘤直径无显著相关性,与肿瘤分化、浸润深度、淋巴结转移、TNM分期及组织学分类密切相关。
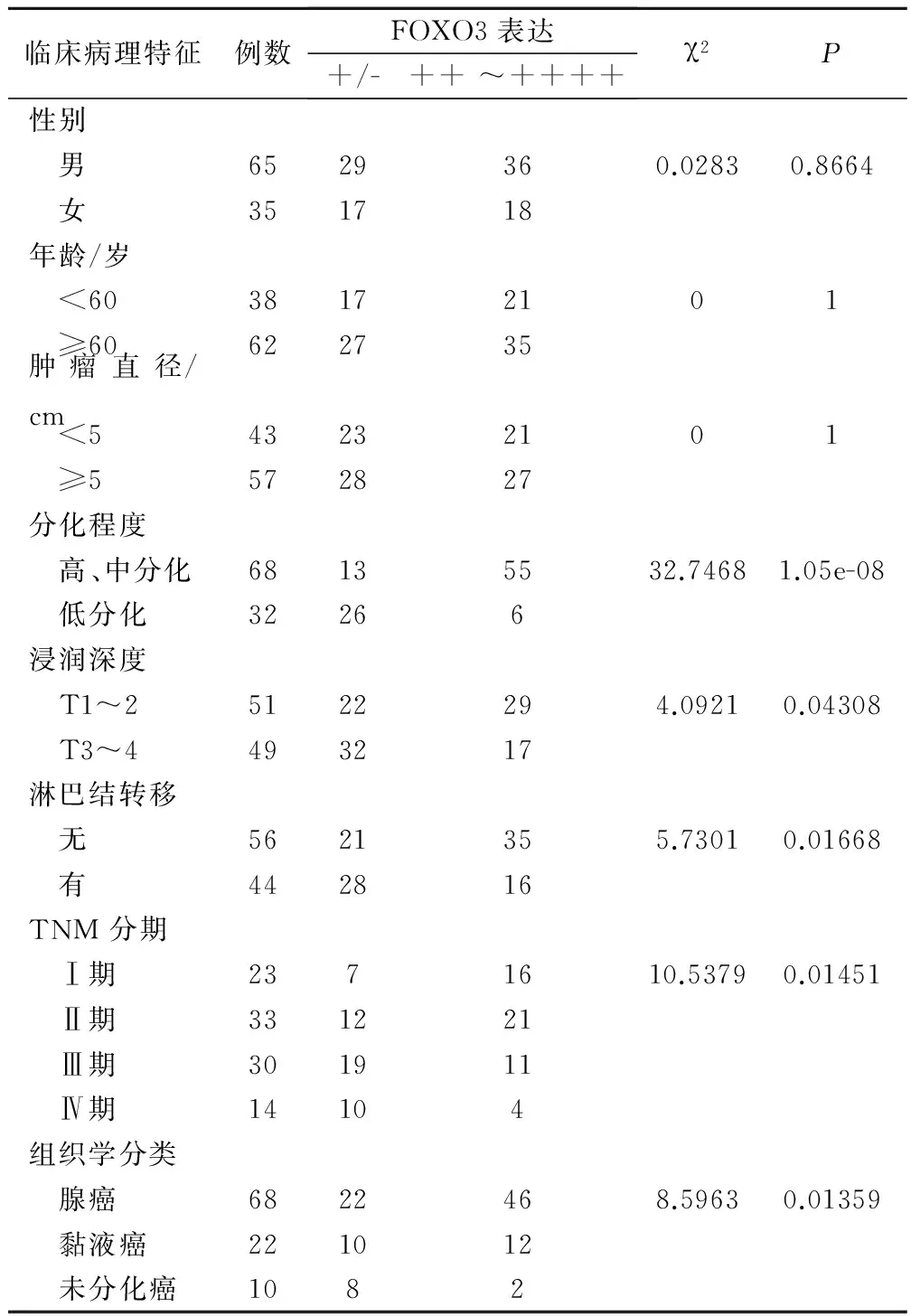
表1 FOXO3蛋白表达与结直肠癌临床病理特征的关系/例
3 讨论
近年来,随着人民生活水平的不断提高,饮食习惯和饮食结构的改变以及人口老龄化,我国结直肠癌的发病率和死亡率均保持上升趋势,深入研究其关键分子机制为新药开发和临床治疗具有极大的社会价值和现实意义。FOXO转录因子是Forkhead蛋白大家族的一个亚群,从蠕虫到人均有表达。FOXO家族的转录因子穿梭于细胞核内外,在代谢、细胞增殖、氧化应激、凋亡、分化和老化中发挥重要作用,多个研究表明其可作为肿瘤治疗靶点之一[11]。FOXO3是FOXO亚家族中的重要成员,其磷酸化失活及亚细胞定位与肿瘤的发生密切相关。研究表明,FOXO3表达缺失在甲状腺癌[12]、卵巢癌[13]、乳腺癌[14]、尿路上皮癌[15]等多种肿瘤发生、发展过程密切相关,且与患者预后密切相关。深入研究FOXO3在肿瘤发生、发展过程中的分子机制,对研制分子靶向治疗药物、制定临床治疗策略具有重要意思。鉴于结直肠癌严峻的上升趋势以及FOXO3在其他癌症中的重要作用,本研究收集整理了100例结直肠癌患者的肿瘤及癌旁正常组织标本、临床病理数据和随访记录,探究FOXO3在结直肠癌中的表达情况以及FOXO3的表达与临床病理特征的关系,即FOXO3在结直肠癌的发生、发展过程中可能发挥的作用。设计了一系列实验,包括:FOXO3在CRC组织和癌旁正常粘膜组织中mRNA水平和蛋白质水平的表达,FOXO3表达高低对结直肠癌病人生存率的影响,FOXO3表达与临床病理特征相关性的分析等。
RT-qPCR实验结果、Western Blot实验结果均表明,FOXO3 mRNA、蛋白在CRC肿瘤组织中表达显著低于正常组织,同时也表明FOXO3蛋白在CRC组织低表达极有可能是在发生在转录过程中,FOXO3发生低表达的原因可能与基因组的表达调控有关。FOXO3低表达是否在翻译水平受到影响还需要进一步的实验进行验证,相关研究仍在进行。对肿瘤组织和正常癌旁组织的免疫组织化学分析也可以得出FOXO3在肿瘤组织中发生了低表达,也与RT-qPCR实验结果、Western Blot实验结果相类似,同时也进一步印证了FOXO3在结直肠组织中的抑癌作用。
对肿瘤组织免疫组织化学切片观察及评分,将肿瘤患者分为3组(FOXO3阴性表达组、FOXO3阳性表达组和FOXO3强阳性表达组),结合3年间患者随访数据,本研究分析了3个分组患者的生存率,结果表明FOXO3阴性表达组患者的生存率显著低于其它两组患者,但FOXO3强阳性表达组患者生存率与FOXO3阳性表达组患者的生存率无显著差异。该结果暗示FOXO3蛋白阳性表达可提高结肠癌患者的生存率,但当FOXO3的表达量提高至一定水平后,继续升高FOXO3的表达量对结肠癌患者生存率无显著性影响。该结果可为靶向FOXO3治疗手段相关研究提供参考,即在用药时需注意FOXO3蛋白浓度调控。
本研究中,我们也对FOXO3蛋白与结直肠癌临床病理特征的相关性进行了探究,结果表明FOXO3蛋白的表达与病人性别、年龄及肿瘤直径无显著相关性,但与肿瘤分化、浸润深度、淋巴结转移、TNM分期及组织学分类密切相关,暗示FOXO3在结直肠癌发生、发展过程中产生了重要影响,相关结论可能为靶向FOXO3治疗结直肠癌提供一定理论指导。
总之,FOXO3在结直肠癌中的表达显著下调,其表达与结直肠癌的肿瘤分化、浸润深度、淋巴结转移、TNM分期和组织学分类有关,FOXO3的表达下调可能在结直肠癌发生、发展过程中起重要作用,FOXO3可能为临床结直肠癌基因治疗提供新的基因靶点。FOXO3可能与结直肠癌的发生发展相关,此结论鲜见报道,尚需扩大研究范围进一步研究证实。
[1] Chawla N,Butler EN,Lund J,et al.Patterns of colorectal cancer care in Europe,Australia,and New Zealand〔J〕.J Natl Cancer Inst Monogr,2013(46):36-61.
[2] Gonzalez SA,Ziebarth TH,Wang J,et al.Interventions promoting colorectal cancer screening in the Hispanic population:a review of the literature〔J〕.J Nurs Scholarsh,2012,44(4):332-340.
[3] Li L,Ma BB.Colorectal cancer in Chinese patients:current and emerging treatment options〔J〕.Onco Targets Ther,2014,7:1817-1728.
[4] Naylor K,Ward J,Polite BN.Interventions to improve care related to colorectal cancer among racial and ethnic minorities:a systematic review〔J〕.J Gen Intern Med,2012,27(8):1033-1046.
[5] Zheng ZX,Zheng RS,Zhang S W,et al.Colorectal cancer incidence and mortality in china,2010〔J〕.Asian Pac J Cancer Prev,2014,15(19):8455-8460.
[6] Kaestner KH,Knochel W,Martinez D E.Unified nomenclature for the winged helix/forkhead transcription factors〔J〕.Genes Dev,2000,14(2):142-146.
[7] Yang JY,Hung MC.A new fork for clinical application:targeting forkhead transcription factors in cancer〔J〕.Clin Cancer Res,2009,15(3):752-757.
[8] Ekizoglu S,Dalay N,Karaman E,et al.LKB1 downregulation may be independent of promoter methylation or FOXO3 expression in head and neck cancer〔J〕.Transl Res,2013,162(2):122-129.
[9] Kim W,Youn H,Seong K M,et al.PIM1-activated PRAS40 regulates radioresistance in non-small cell lung cancer cells through interplay with FOXO3a,14-3-3 and protein phosphatases〔J〕.Radiat Res,2011,176(5):539-552.
[10] Bullock MD,Bruce A,Sreekumar R,et al.FOXO3 expression during colorectal cancer progression:biomarker potential reflects a tumour suppressor role〔J〕.Br J Cancer,2013,109(2):387-394.
[11] Greer EL,Brunet A.FOXO transcription factors at the interface between longevity and tumor suppression〔J〕.Oncogene,2005,24(50):7410-7425.
[12] Hong ZY,Lee HJ,Shin DY,et al.Inhibition of Akt/FOXO-
3a signaling by constitutively active FOXO3a suppresses growth of follicular thyroid cancer cell lines〔J〕.Cancer Lett,2012,314(1):34-40.
[13] Chou JL,Su HY,Chen LY,et al.Promoter hypermethylation of FBXO32,a novel TGF-beta/SMAD4 target gene and tumor suppressor,is associated with poor prognosis in human ovarian cancer〔J〕.Lab Invest,2010,90(3):414-425.
[14] Zou Y,Tsai WB,Cheng CJ,et al.Forkhead box transcription factor FOXO3a suppresses estrogen-dependent breast cancer cell proliferation and tumorigenesis〔J〕.Breast Cancer Res,2008,10(1):R21.
[15] Shiota M,Song Y,Yokomizo A,et al.Foxo3a suppression of urothelial cancer invasiveness through Twist1,Y-box-binding protein 1,and E-cadherin regulation〔J〕.Clin Cancer Res,2010,16(23):5654-5663.
(编辑:吴小红)
Expression and Clinical Significance of FOXO3 in Colorectal Carcinoma
LIUXin,HUJiele,LIYou,etal.
RuijinHospital,ShanghaiJiaoTongUniversitySchoolofMedicine,Shanghai,200025
Objective To investigate the expression and clinical significance of FOXO3(forkhead box class O3) in colorectal carcinoma.Methods 100 cases of colorectal cancer treated with surgical resection were selected,FOXO3 mRNA expression of colorectal cancer and normal tissues were detected using real-time quantitative PCR (Real-time quantitative PCR,RT-qPCR),FOXO3 protein expression was detected by western blot,Immunohistochemical method (Immunohistochemistry,IHC) was used to detect FOXO3 protein expression in human colorectal carcinoma and normal tissues.Results As compared with normal colorectal mucosa tissues,FOXO3 expression in colorectal cancer tissues obviously decreased(P<0.05) both at mRNA and protein levels.The survival rate of FOXO3 negative group significantly decreased (P<0.05) compared with the other 2 groups,and that of FOXO3 positive group and FOXO3 strongly positive group have no significant difference(P>0.05).The expression of FOXO3 in colorectal cancer was significantly correlated with tumor differentiation(χ2=32.7468,P=1.05e-08)、depth of tumor invasion(χ2=4.0921,P=0.04308)、metastasis of lymph node(χ2=5.7301,P=0.01668)、TNM stage(χ2=9.2374,P=0.01451,P=0.01451)and tumor histological differentiation(χ2=8.5963,P=0.01359).Conclusion The expression of FOXO3 may be closely related with differentiation,depth of tumor invasion,metastasis of lymph node,TNM stage,and histological differentiation of colorectal cancer,and it may be an important indicator to evaluate the malignant degree and prognosis of the colorectal cancer.
Colorectal cancer;Immunohistochemistry;FOXO3;RT-qPCR;Western Blot
200025 上海交通大学医学院附属瑞金医院(刘 鑫,赵
任);201801 上海交通大学医学院附属瑞金医院北院(胡皆乐,李 佑,刘 坤,蒋奕玫,罗秀芳)
赵 任
10.3969/j.issn.1001-5930.2016.11.010
R735.3+7
A
1001-5930(2016)11-1773-05
2015-12-02
2016-06-01)

