PDCD5在人子宫内膜癌中的表达及对细胞凋亡的影响
梁婷婷 于云海 董延磊 黄太胜 俆 晖
PDCD5在人子宫内膜癌中的表达及对细胞凋亡的影响
梁婷婷 于云海 董延磊 黄太胜 俆 晖
目的 探讨PDCD5对子宫内膜癌细胞克隆形成,增殖以及凋亡的作用。方法 收集行手术切除的子宫内膜癌及对应癌旁组织共60例,采用qRT-PCR,western blot分别检测PDCD5 mRNA水平及蛋白水平在子宫内膜癌及对应癌旁组织中的表达情况,通过重组PDCD5(rhPDCD5)处理HEC1A子宫内膜癌细胞,检测其对细胞增殖、克隆形成及细胞凋亡的影响。结果 子宫内膜癌组织中PDCD5表达水平显著低于对应癌旁组织(P<0.05);肿瘤组织中PDCD5低表达与病理分期、组织学分级、肌层浸润以及肿瘤淋巴结转移均具有显著相关性(P<0.05);低表达PDCD5的患者总生存时间均显著缩短(P<0.05);重组的PDCD5蛋白能够通过促进子宫内膜癌细胞凋亡抑制细胞增殖和克隆形成能力。结论PDCD5在子宫内膜癌组织中低表达并与子宫内膜癌临床病理特征及不良预后显著相关,并能够通过促进子宫内膜癌细胞凋亡进而抑制细胞增殖及克隆形成,PDCD可能参与子宫内膜癌发生发展进程,并可作为早期诊断及预后评价的重要分子。
PDCD5;子宫内膜癌;表达;预后
(ThePracticalJournalofCancer,2016,31:1749~1753)
子宫内膜癌(endometrial cancer)是最常见的女性生殖系统恶性肿瘤之一,每年大约有超过288 000女性发展成为子宫内膜癌,约占全部恶性肿瘤的7%,占女性生殖道恶性肿瘤的20%~30%[1-2]。目前子宫内膜癌发生发展机制仍然不清楚,因此研究子宫内膜癌的发生发展机制对于提高患者的诊断及预后评价具有重要意义。PDCD5原名TFAR19(TF-1 cell apoptosis related gene-19),是由我国学者发现的1个参与细胞凋亡过程调控的新基因[3]。研究表明,PDCD5广泛表于人体的各个组织,其mRNA表达水平在胚胎组织中显著低于成人组织[4]。近年来的研究发现,PDCD5在肿瘤患者,特别是在肺癌,卵巢癌,胃癌和胶质瘤中表达量降低,提示低表达量的PDCD5可能与肿瘤的发生发展相关[5-7]。但PDCD5在子宫内膜癌中的表达及与患者预后关系用尚不清楚。
本研究检测了PDCD5在子宫内膜癌及对应癌旁组织中的表达情况,分析PDCD5表达水平与子宫内膜癌临床病理参数间的关系及其对子宫内膜癌患者预后的影响。通过体外实验检测重组PDCD5对子宫内膜癌细胞增殖,克隆形成以及凋亡的影响,以期为子宫内膜癌的诊断与预后评估提供新的思路。
1 材料与方法
1.1 临床资料
选择2007年1月至2012年12月期间于我院妇产科行子宫内膜癌手术治疗并具有完整随访资料的患者60例。子宫内膜癌及对应癌旁组织标本手术切除后迅速进行多点取材,分别置于液氮或4%多聚甲醛固定并石蜡包埋保存备用。
1.2 主要试剂
RNA提取试剂,cDNA反转录试剂盒,qRT-PCR试剂盒均购自大连宝生物工程有限公司;PDCD5及β-actin PCR引物有深圳华大基因生物科技有限公司合成;鼠抗人PDCD5单克隆抗体及兔抗小鼠二抗均购自美国Santa Cruz公司;重组PDCD5购于Novoprotein公司。MTT细胞增殖检测试剂盒以及Annexin V-FITC细胞凋亡检测试剂盒均购自于上海碧云天生物技术有限公司。
1.3 细胞培养
子宫内膜癌细胞HEC1A用含10%胎牛血清的DMEM培养基于37 ℃、5% CO2条件下培养,待生长至70%~80%汇合度时,用0.25%的胰蛋白酶消化传代培养。
1.4 qRT-PCR
取适量液氮冻存的组织标本于研钵中研磨后加入1 ml RNA提取试剂提取癌及癌旁组织总RNA,按反转录说明书分别将1 μg总mRNA反转成cDNA,以下列引物:PDCD5:上游引物5′-CGACTGATCCAGAACTTGGG-3′,下游引物5′-GAGCTGCAGGCCAAACAC-3′;β-actin:上游引物5′-GGGACCTGACTGACTACCTC-3′,下游引物5′-TCATACTCCTGCTTGCTGAT-3′,按qRT-PCR说明书要求配制反应体系进行PCR扩增反应。以β-actin基因为内参,采用2-△△Ct法计算PDCD5 mRNA在癌及癌旁组织中的相对表达量。通过计算癌组织标本中PDCD5表达量的平均值,将患者分为高表达PDCD5组和低表达PDCD5组,统计其与患者临床病理参数的关系及生存曲线。
1.5 四甲基偶氮唑盐比色法(MTT)
取对数生长期的细胞,按5×103个/孔接种至96孔板,每孔培养基体积200 μL。过夜后按照不同的剂量给予重组PDCD5(10 μg)处理,分别培养24 h,48 h,72 h,96 h时间后,每孔加入20 μL MTT(5 mg/ml),继续孵育4 h,弃上清,每孔加入150 μL DMSO,震荡混匀10 min使结晶完全溶解,选择490 nm波长,应用酶标仪测定各孔光吸收值,记录结果,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.6 流式细胞术(FCM)检测细胞凋亡
子宫内膜癌细胞按1×105个/孔接种至6孔板,次日给予rhPDCD5(5 μg和10 μg)处理,以加入PBS为对照组,处理24 h后收集细胞,按照Annexin V-FITC/PI双染法试剂盒说明书预染细胞,整个操作使样品处于低温避光,孵育好样品后采用流式细胞仪检测细胞凋亡情况。
1.7 平板克隆形成实验
将HEC1A细胞消化吹打成单个细胞并按200个孔接种于6孔板,置37 ℃,5%CO2环境下静置培养24 h,实验组给予rhPDCD5(10 μg)处理,对照组给予PBS,继续培养10~14 d,当出现肉眼可见的集落时终止培养,弃上清,PBS清洗3遍,甲醇固定15 min后,弃上清,加入0.1%结晶紫溶液染色10~30 min,流水缓慢冲洗后晾干,观察克隆大小并计数克隆数。
1.8 免疫印迹实验(Western blots)
子宫内膜癌细胞HEC1A分别经重组PDCD5处理以及对照组PBS处理培养48 h后提取总蛋白并测定蛋白浓度,相同质量的蛋白样品进行聚丙烯酰胺凝胶电泳(SDS-PAGE)后转印至PVDF膜,用5%脱脂牛奶封闭2~3 h,孵育PDCD5一抗4 ℃过夜,0.5% PBST洗膜,室温孵育辣根过氧化物酶标记的二抗1 h,0.5% PBST洗膜后用ECL化学发光法检测结果。
1.9 统计学处理
应用SPSS 17.0统计软件进行分析。数据以平均值±标准差表示,组间比较采用t检验;计数资料采用Pearson卡方检验;Kaplan-Meier生存分析患者生存曲线,P<0.05表示差异具有统计学意义。
2 结果
2.1 子宫内膜癌组织中PDCD5的表达
qRT-PCR检测60例子宫内膜癌组织及对应的癌旁组织中PDCD5表达结果发现,子宫内膜癌组织中PDCD5 mRNA表达量显著低于癌旁组织中PDCD5的表达水平(P<0.01,图1A)。Western blot检测其中3份标本中PDCD5蛋白表达水平也发现,子宫内膜癌组织中PDCD5蛋白表达量均低于对应癌旁组织(图1B)。以上结果表明,PDCD5在子宫内膜癌中呈低表达。

注:A为qRT-PCR检测;B为Western blot检测,1、2、3分别表示3份癌与癌旁组织样本,N表示癌旁组织,T表示癌组织。
2.2 PDCD5表达水平与子宫内膜癌临床病理特征的关系
按子宫内膜癌组织中PDCD5基因表达水平将60例患者分成高表达和低表达两组。Pearson卡方检验结果见表1所示,子宫内膜癌组织中低表达PDCD5基因与病理分期、组织学分级、肌层浸润以及肿瘤淋巴结转移(P=0.002)均显著相关,而与患者年龄无关(P>0.05)。以上结果提示,PDCD5可能参与了子宫内膜癌的发生发展过程。

表1 PDCD5表达与子宫内膜癌临床病理参数的关系/例
2.3 PDCD5表达水平与子宫内膜癌患者预后的关系
Kaplan-Meier分析PDCD5表达水平与子宫内膜癌患者的生存时间结果显示,高表达PDCD5患者生存时间显著长于PDCD5低表达患者的生存时间(P<0.05,图2)。以上结果提示,PDCD5表达水平可以作为判断子宫内膜癌患者预后的重要指标。

图2 Kaplan-Meier生存时间分析
2.4 重组PDCD5蛋白对子宫内膜癌细胞增殖和克隆形成的影响
增殖实验结果显示,加入rhPDCD5后,子宫内膜癌细胞的增殖能力显著弱于对照组(P<0.05,图3)。克隆形成实验也发现,经rhPDCD5处理后,HEC1A细胞的克隆大小显著弱于对照组,加入重组PDCD5组的克隆数目也显著少于未加入组(P<0.05,图3)。
2.5 重组PDCD5蛋白对子宫内膜癌细胞凋亡的影响
检测重组PDCD5 蛋白对子宫内膜癌细胞凋亡的影响,结果显示,与对照组相比,当加入5 μg和10 μg rhPDCD5处理细胞后显著促进细胞凋亡发生,细胞凋亡率分别为(3.2±0.01)%、(12.5±0.81)%和(35.6±0.61)%(P<0.05,图4)。
3 讨论
子宫内膜癌由于其复杂的发病过程,导致在确诊时大部分患者已处于疾病晚期。尽管早期的子宫内膜癌患者5年生存率达到90%,但是其中有约30%是高级别肿瘤,其发生深度浸润及局部转移,5年生存率在16%~66%[8]。近年来,对于治疗子宫内膜癌主要的治疗方案有子宫切除术,激素治疗以及放化疗联合做方案。这些治疗方案对早期子宫内膜癌具有显著的治疗效果,然而一旦肿瘤发生转移,这些治疗方案就失去作用[9-10]。因此,研究子宫内膜癌的发病机理以及寻找早期诊断和预后标志物已成为提高子宫内膜癌诊治水平的重要手段。
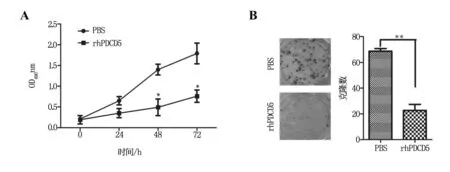
注:A为 MTT法检测HEC1A增殖实验;PBS为对照组;rhPDCD5为实验组,重组的PDCD5;B为克隆形成实验。

注:PBS为对照组,未加rhPDCD5;实验组分别加入5μg和10μg rhPDCD5处理子宫内膜癌细胞。
PDCD5氨基酸序列在真核生物中相当保守,是细胞凋亡相关基因。PDCD5在人类疾病中的作用已有广泛研究。如在卵巢癌,胶质瘤和前列腺癌中低表达PDCD5与患者的肿瘤级别及预后呈正相关[5,11-12]。而在另外一些疾病如急性髓细胞白血病患者中,PDCD5蛋白水平显著高于正常人[13]。但其在子宫内膜癌中的临床价值尚不清楚。本研究发现,PDCD5在子宫内膜癌组织中的表达水平均显著低于对应癌旁组织,并且低表达PDCD5与病理参数如肿瘤淋巴结转移及病理分期等临床病理特征具有显著相关性。生存分析发现,与PDCD5基因高表达患者相比,PDCD5基因低表达患者的总生存率均显著降低。PDCD5发挥功能主要是以一种依赖细胞因子的细胞凋亡调节作用[3]。当细胞发生凋亡时,细胞质中的PDCD5迅速转位到细胞核并发挥促凋亡作用[14]。体外细胞实验发现,重组的PDCD5通过细胞内吞作用抑制肝癌细胞增殖并诱导细胞凋亡[15]。过表达PDCD5促进了细胞对顺铂的敏感性,并抑制了肝癌细胞的侵袭转移能力[16]。本研究发现,重组的PDCD5蛋白能够抑制子宫内膜癌细胞体外增殖和克隆形成,流式细胞术凋亡检测发现,重组PDCD5蛋白能够促进子宫内膜癌细胞凋亡,提示PDCD5在子宫内膜癌中发挥抑癌作用。因而,我们得出结论,PDCD是一种重要的抑癌蛋白,在调控子宫内膜癌发生发展方面具有重要作用。
综上所述,PDCD5在子宫内膜癌组织呈低表达状态,低表达PDCD5与子宫内膜癌恶性临床病理特征及患者不良预后密切相关。一步机制研究发现重组的PDCD5通过促进细胞凋亡从而抑制子宫内膜癌细胞体外增殖和克隆形成能力。因此,PDCD5在子宫内膜癌的发生发展中起着重要作用。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics〔J〕.CA Cancer J Clin,2011,61(2):69-90.
[2] 张燕燕,李 群.晚期子宫内膜癌的治疗进展〔J〕.实用癌症杂志,2013,28(3):327-329.
[3] Liu H,Wang Y,Zhang Y,et al.TFAR19,a novel apoptosis-related gene cloned from human leukemia cell line TF-1,could enhance apoptosis of some tumor cells induced by growth factor withdrawal〔J〕.Biochem Biophys Res Commun,1999,254(1):203-210.
[4] Dobson AT,Raja R,Abeyta MJ,et al.The unique transcriptome through day 3 of human preimplantation development〔J〕.Hum Mol Genet,2004,13(14):1461-1470.
[5] Li H,Wang Q,Gao F,et al.Reduced expression of PDCD5 is associated with high-grade astrocytic gliomas〔J〕.Oncol Rep,2008,20(3):573-579.
[6] Spinola M,Meyer P,Kammerer S,et al.Association of the PDCD5 locus with lung cancer risk and prognosis in smokers〔J〕.J Clin Oncol,2006,24(11):1672-1678.
[7] Yang YH,Zhao M,Li WM,et al.Expression of programmed cell death 5 gene involves in regulation of apoptosis in gastric tumor cells〔J〕.Apoptosis,2006,11(6):993-1001.
[8] Makker A,Goel MM.Tumor progression,metastasis and m-
odulators of EMT in endometrioid endometrial carcinoma:an update〔J〕.Endocr Relat Cancer,2015,23(2):R85-R111.
[9] Rauh-Hain JA,Del Carmen MG.Treatment for advanced and recurrent endometrial carcinoma:combined modalities〔J〕.Oncologist,2010,15(8):852-861.
[10] 张克强,江 宁,沈光耀.子宫内膜癌的综合治疗及临床特点分析〔J〕.实用癌症杂志,2007,22(3):305-310.
[11] Gao L,Ye X,Ma RQ,et al.Low programmed cell death 5 expression is a prognostic factor in ovarian cancer〔J〕.Chin Med J,2015,128(8):1084-109.
[12] Du YJ,Xiong L,Lou Y,et al.Reduced expression of programmed cell death 5 protein in tissue of human prostate cancer〔J〕.Chin Med Sci J,2009,24(4):241-245.
[13] 王立茹,王 敏,崔建英,等.急性髓系白血病PDCD5的表达及其临床意义〔J〕.中国实验血液学杂志,2015,23(1):24-28.
[14] Chen Y,Sun R,Han W,et al.Nuclear translocation of PDCD5 (TFAR19):an early signal for apoptosis?〔J〕.FEBS Lett,2001,509(2):191-196.
[15] Fu DZ,Cheng Y,He H,et al.Recombinant human PDCD5 exhibits an antitumor role in hepatocellular carcinoma cells via clathrindependent endocytosis〔J〕.Mol Med Rep,2015,12(6):8134-8140.
[16] Fan GL,Yao Y,Yao L,et al.PDCD5 transfection increases cisplatin sensitivity and decreases invasion in hepatic cancer cells〔J〕.Oncol Lett,2015,9(1):411-417.
(编辑:吴小红)
The Expression of PDCD5 in Human Endometrial Cancer and Its Effect on Apoptosis
LIANGTingting,YUYunhai,DONGYanlei,etal.
TheSecondHospitalofShandongUniversity,Jinan,250033
Objective To investigate the effect of expression of PDCD5 on cell colony formation,proliferation and apoptosis in human endometrial cancer.Methods 60 cases of endometrial carcinoma and matched tumor-adjacent tissues were collected.mRNA and the protein expression of PDCD5 of endometrial carcinoma and matched tumor-adjacent tissues were detected by qRT-PCR and western blot.Effects of PDCD5 on HEC1A cell proliferation,colony formation and apoptosis were evaluated.Results Expression of PDCD5 in endometrial carcinoma tissues were lower than matched tumor-adjacent tissues(P<0.05).Low expression of PDCD5 was associated with histology grade,tumor stage,myometrial invasion and lymph nod metastasis (P<0.05).Moreover,patients with lower PDCD5 expression levels showed poor overall survival than high PDCD5 expression group (P<0.05).In addition,Recombinant human PDCD5 (rhPDCD5) inhibited HEC1A cell proliferation,colony formation and induced cell apoptosis in vitro.Conclusion PDCD5 is a candidate tumor suppressor gene in human endometrial carcinoma,and low expression is related to the malignant clinicopathological features and poor prognosis.It could inhibit tumor cell growth and colony formation though induce apoptosis in vitro.PDCD5 might offer future clinical utility in the treatment of endometrial carcinoma.
PDCD5;Endometrial carcinoma;Expression;Apoptosis
山东省科技发展计划项目(编号:2011WSB21018)
250033 山东大学第二医院
俆 晖
10.3969/j.issn.1001-5930.2016.11.004
R737.33
A
1001-5930(2016)11-1749-05
2015-12-07
2016-05-31)

