甲壳素发酵液在彭泽鲫幼鱼养殖上应用效果
王菊华,张国华,黄江丽,黄 黄,圣 平,张志红
(江西省科学院生物资源研究所,南昌 330096)
甲壳素发酵液在彭泽鲫幼鱼养殖上应用效果
王菊华,张国华,黄江丽,黄 黄,圣 平,张志红
(江西省科学院生物资源研究所,南昌 330096)
为研究甲壳素发酵液(Chitin fermentation liquid,CFL)在彭泽鲫(Carassiusauratusvariety pengze)幼鱼上效果,通过在室外养殖池水体中定期泼洒CFL,比较不同用量CFL(0.01%和0.02%)以及0.02%CFL和商品壳聚糖(Chitosan,C)联合应用效果,每个处理3次重复。饲养初始彭泽鲫体重为35 g左右,培养2个月后测定幼鱼生长性能和水体指标。结果显示:0.01% CFL、0.02 % CFL和0.02% CFL+C三个处理彭泽鲫总体重与养殖初期比较增重均达到20%以上,增重效果分别比对照高101.5%、110.4%和172.7%。0.01% CFL和0.02% CFL处理的彭泽鲫消化系统中脂肪酶、蛋白酶和淀粉酶比对照高22.03%以上,但两个浓度之间差异不显著。CFL处理降低养殖水体中亚硝态氮、总氮和总磷含量,0.01% CFL处理分别比对照低29.4%、15.2%和77.8%,其它两个处理与0.01% CFL差异不显著。CFL处理降低了感染嗜水气单胞菌后彭泽鲫的死亡率,提高了保护效果。结果表明,甲壳素发酵液明显提高彭泽鲫抗病能力,促进鱼体生长,改善水质。
甲壳素发酵液;壳聚糖;彭泽鲫(Carassiusauratusvariety pengze);嗜水气单胞菌
在渔业养殖逐渐实现集约化和工厂化过程中,鱼类非常容易感染病原微生物,病害频繁发生。大量抗生素和农药长期使用不仅使鱼肉的品质受到严重的影响,并且药品的长期使用还会通过食物链直接影响人类健康[1]。因此,有必要开发绿色环保和价廉的渔业养殖专用产品。甲壳素(Chitin)是自然界中合成量仅次于纤维素的第二大可再生自然资源,大量存在于节肢动物如虾、蟹和昆虫外壳中,也存在于菌类、藻类和高等植物的细胞壁中,分布极其广泛,是保健食品、医用材料以及化妆品行业重要原料[2]。甲壳素化学特性稳定,不易分解和熔化,不溶于水、乙醇、乙醚、稀酸(但溶于乙酸)和稀碱。甲壳素的不溶性限制了其应用范围,所以大多加工成衍生物壳聚糖使用。壳聚糖(Chitosan)又称为脱乙酰甲壳质、可溶性甲壳素、甲壳胺等,是由甲壳素脱乙酰基后生成的直链多糖。近年来国内外对其应用研究十分活跃,是迄今为止所发现的唯一一种碱性多糖,具有良好的生理活性和生物相容性[3]。甲壳素衍生物作为饲料添加剂在水产动物养殖上应用,具有调控营养物质代谢、促进生长、增强抗氧化能力和提高抗病和免疫能力等作用,可部分替代抗生素等化学药物[4-6]。本试验选用课题组研制的甲壳素微生物发酵液,研究其在彭泽鲫(Carassiusauratusvariety pengze)上的养殖效果,比较不同浓度甲壳素发酵液对彭泽鲫生长性能、抗病能力和水质环境的影响,为提高渔业养殖技术、开发新产品提供参考。
1 材料与方法
1.1 实验材料
鱼苗:购自江西省水产科学研究所,选取体重35 g左右彭泽鲫。
饲料:市场购买,主要成分含量为粗蛋白28.0%,粗脂肪8.5%,总磷0.60%,粗纤维10.0%,粗灰分11.0%,水份13.0%。
病原菌:嗜水气单胞菌(Aeromonashydrophila),上海海洋大学赠送。
甲壳素发酵液(CFL):本课题组开发的一种微生态制剂,该制剂是由三种芽孢杆菌(Bacillussp.)和一种酵母菌(Saccharomycessp.)联合降解胶质甲壳素得到的发酵液,发酵后甲壳素降解为壳聚糖。发酵液中含有大量脱乙酰酶和几丁质酶,四种微生物总含量=10×108个/mL。
商品壳聚糖(C):粉状制品,购于山东青岛海良生物制品有限公司,脱乙酰度为99%。
1.2 试验方法
试验设4个处理:①对照(CK),仅饲喂基础饲料;②0.01%甲壳素发酵液(0.01% CFL),按照池水量0.01%投入,每隔7 d泼洒一次;③0.02%甲壳素发酵液(0.02% CFL),按照池水量0.02%投入,每隔7 d泼洒一次;④0.02%甲壳素发酵液+壳聚糖(0.02% CFL+C),壳聚糖在基础饲料中按照0.1%添加,甲壳素发酵液按照池水量0.02%投入,每隔7 d泼洒一次。每个水泥养殖池为1个重复,每个处理设3个重复。室外水泥养殖池的水体面积为6 m2,水深0.5 m,养殖水直接取自无污染的地下水,加水静置7 d 后再放鱼养殖。
选择健壮、无伤病、体长和体重接近的幼鱼,试验开始前对幼鱼称重,每个水池中彭泽鲫40 尾。日投喂量按体重的3%饲喂,每天2 次,上下午各1 次。先用基础饲料驯养7 d,至摄食正常后,开始正式试验。在整个试验过程中,池水日通气时间不少于10 h,养殖过程中不换水。养殖时间为9月25日—11月25日,养殖结束幼鱼称重。
攻毒试验:每个水池中选出20 尾彭泽鲫进行攻毒试验。试验在室内可控温、通气玻璃鱼缸内进行,温度控制在25 ℃左右。嗜水气单胞菌在接种之前活化3次,经预试验确定攻毒浓度为4×107个/mL,注射剂量为每尾鱼0.1 mL,采用腹腔注射方法。每天记录攻毒后彭泽鲫的累积死亡数。按下式计算各组相对保护率(relative percent survival,RPS)。
RPS=(1-处理死亡率/对照死亡率)×100%
水质测定:不同时间取样测定养殖水体中亚硝态氮、总氮和总磷含量,亚硝态氮采用N-(1-萘基)-乙二胺光度法,总氮采用碱性过硫酸钾消解紫外分光光度法,总磷采用钼酸铵分光光度法[7]。
消化酶测定:养殖试验结束后取饥饿1 d的彭泽鲫,用南京建成生物工程研究所试剂盒测定鱼体内淀粉酶、脂肪酶和蛋白酶活性。从每个处理组中随机取彭泽鲫6 尾,取出全肠和肝胰脏,将全肠和肝胰脏一起称重,置于匀浆器中,加入10倍体积的高纯水匀浆,在4 ℃冰箱中静置过夜。4 ℃、10 000 r/min离心10 min,获得的上清液即为粗酶液,并置于4 ℃冰箱中待用[8]。脂肪酶活性测定以37 ℃条件下每g组织蛋白在反应体系中与底物反应1 min,每消耗1 μmol底物为1个酶活力单位。蛋白酶活性测定以每mg组织蛋白37 ℃每min水解生成1 μg氨基酸作为1个酶活力单位。淀粉酶活性采用碘-淀粉比色法,以组织中每mg蛋白在37 ℃与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活力单位。
1.3 统计分析
数据统计分析采用SAS V8软件的Duncan氏法进行多重比较,P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 不同处理对幼鱼生长和抗病的影响
甲壳素发酵液处理对彭泽鲫幼鱼促进生长效果明显(见表1),每个处理中彭泽鲫总体重与养殖初期比较增重均达到20%以上,三个处理分别比对照增重高101.5%、110.4%和172.7%,增重效果显著高于对照。比较甲壳素发酵液与壳聚糖联合处理效果,对彭泽鲫促生效果比单独甲壳素发酵液效果更好。在试验过程中,彭泽鲫感染了存活在养殖水泥池中的寄生虫——小瓜虫,对照在15 d时全部死亡,甲壳素发酵液处理比对照晚5 d出现小瓜虫感染症状,死亡率为50%左右。由于试验中彭泽鲫感染寄生虫,先前一批养殖20 d时清除剩余彭泽鲫,养殖池用石灰水彻底消毒、曝晒后重新开始试验。

表1 不同处理对彭泽鲫总体重的影响
注:同列数据肩标有不同小写字母表示差异显著(P<0.05)。下同。
养殖60 d后嗜水气单胞菌病原菌对不同处理彭泽鲫攻毒,结果表明(见表2),10 d时甲壳素发酵液都能有效降低彭泽鲫幼鱼死亡率,相对保护率均达到58%以上。
2.2 不同处理对彭泽鲫幼鱼消化酶活力的影响
从消化系统中三种消化酶测定结果看(见表3),甲壳素发酵液处理提高了彭泽鲫幼鱼体内消化酶活性。0.01%甲壳素发酵液处理彭泽鲫脂肪酶、蛋白酶和淀粉酶分别比对照高26.13%、25.60%和36.41%,0.02%分别比对照高35.11%、22.03%和43.09%,0.01%和0.02%甲壳素发酵液差异不明显。甲壳素发酵液与壳聚糖联合效果对三种消化酶提高效果更明显,提高幅度都达到45%以上。

表2 嗜水气单胞菌攻毒后第10天彭泽鲫幼鱼死亡情况

表3 不同处理对彭泽鲫体内消化酶影响
2.3 不同处理对彭泽鲫养殖水质因素的影响
从表4可以看出不同处理对养殖水质因素的影响,甲壳素发酵液处理均能不同程度降低亚硝态氮、总氮和总磷含量,0.01%甲壳素发酵液处理分别比对照相应低29.4%、15.2%和77.8%(P<0.05),0.02%甲壳素发酵液处理分别低32.1%、19.0%和77.8%,0.02%甲壳素发酵液和壳聚糖联合处理分别低27.8%、13.3%和86.9%。从结果看出,0.02%甲壳素发酵液对三种水体环境因子降低效果略好于0.01%甲壳素发酵液处理,但是没有达到显著性差异;0.02%甲壳素发酵液和壳聚糖联合处理与单独0.02%甲壳素发酵液比较效果不明显。
3 讨论
甲壳素脱乙酰降解为壳聚糖需要大量氢氧化钠、正戊醇、过氧化氢等化学试剂,反应过程需要高温和多次洗涤脱碱等,并且能耗高、环境污染严重。因此,用化学方法制备壳聚糖越来越受到限制[9]。利用微生物及其产生酶降解甲壳素生产壳聚糖,产物丰富,含有不同链长度的壳聚糖以及其他活性物质,关键是环境污染少,成本低,是一种很有研究和应用价值的壳聚糖生产方法[10]。本研究采用四种微生物联合发酵培养方法,利用微生物产生的脱乙酰酶和几丁质酶降解胶质甲壳素,发酵
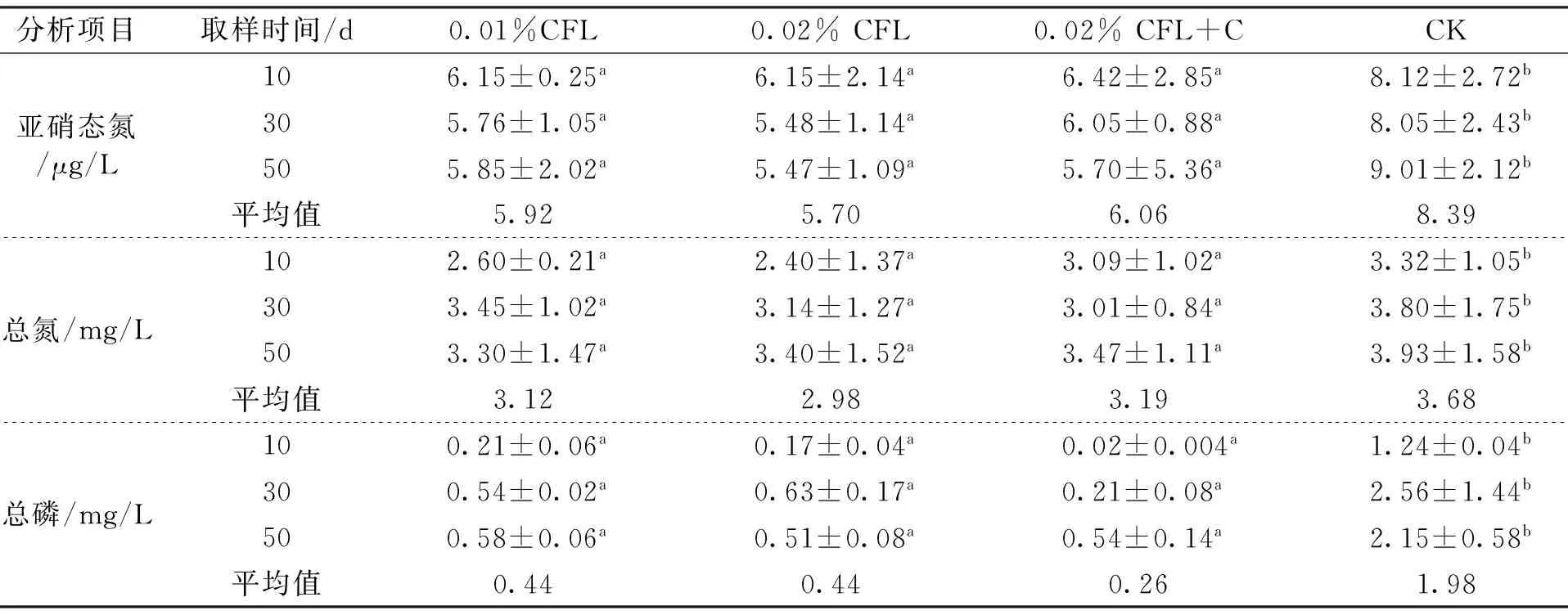
表4 不同处理对养殖水体参数的影响
后含有不同降解程度的壳聚糖以及大量微生物。因此,甲壳素发酵液是一个多元复合产品,不同于结构单一的商品壳聚糖。
于东祥等[11]在真鲷(Pagrosomusmajor) 幼鱼试验中比较了壳聚糖与腐植酸钠、海藻酸钠等不同添加剂对幼鱼生长影响,壳聚糖处理比对照增重高28.03%,增重效果好于其它添加剂。任秀芳等[12]在基础饲料中添加不同比例壳聚糖研究对克氏原螯虾(Procambarusclarkii)存活和免疫功能等影响,结果表明壳聚糖明显提高克氏原螯虾的生长性能和非特异性免疫。华雪铭等[8]研究壳聚糖对水产动物促生作用主要表现为提高消化酶活性,肠道消化酶活性的提高是促进鱼体生长的重要原因之一。甲壳素及其衍生物通过提高鱼体的消化酶活性来提高对营养物质的消化吸收能力,进而提高对蛋白质、淀粉等营养物质的利用率[13],本研究甲壳素发酵液明显促进彭泽鲫幼鱼体内消化酶活性,是促进鱼体生长的重要因素之一。在水产养殖中,有益菌广泛作为饲料添加剂来调节养殖动物肠道微生物群落结构,促进机体生长[14]。芽孢杆菌明显提高草鱼(Ctenopharyngodonidellus)、罗非鱼(Oreochromisniloticus)和黑鲷(Sparusmacrocephlus)等水生动物生长性能[15-17],芽孢杆菌通过定殖在肠道后刺激肠道内壁,增加内源性消化酶的分泌和活性的增强,提高消化吸收能力,保证机体快速生长[18]。同时,芽孢杆菌作为外源菌能抑制肠道有害菌繁殖,平衡肠道菌群,促进肠道中有益菌群乳酸杆菌(Lactobacillussp.)和双歧杆菌(Bifidobacteriumsp.)繁殖,增强该系统的稳定性和自身调节能力,改善肠道微生态环境,提高机体免疫能力[19]。本研究中甲壳素发酵液含有的芽孢杆菌和酵母菌对彭泽鲫生长可能也发挥重要作用。甲壳素发酵液不仅促进幼鱼生长,也提高彭泽鲫幼鱼对病原菌嗜水气单胞菌和寄生虫小瓜虫的抗性,相对保护率明显高于对照。本研究中,甲壳素发酵液与壳聚糖联合处理效果明显高于单独0.02%甲壳素发酵液处理,说明添加商品壳聚糖能进一步提高甲壳素发酵液应用效果,可能与它们有效成分含量和结构差异有关。
水质环境好坏是养殖成败的关键,在养殖过程中各种残饵和排泄物影响水质,引起水产动物死亡[20]。任秀芳等[21]在水体中添加不同浓度羧化壳聚糖,结果表明壳聚糖显著降低水体中氨态氮、硫化氢、亚硝酸盐的浓度、改善水质和稳定水体pH值。孙艳辉等[22]也研究了壳聚糖对亚硝酸盐的清除作用,随壳聚糖用量增加对亚硝酸盐清除能力也升高。李永芹等[23]研究表明,芽孢杆菌对养殖水体中氨氮和亚硝酸盐的降解率分别为81.9%和64.3%,对净化养殖池塘水质有明显作用。张峰峰等[24]研究认为芽孢杆菌可迅速有效降低水体中的硝酸盐、亚硝酸盐含量,4 d去除率均达99%以上,可有效降低水体pH值,但对氨氮没有明显作用。周建忠等[25]在研究微生物与酶效果时也发现随着用量增加,试验组降低底泥中有机碳效果并无显著性差异,考虑经济效益问题,建议采用较低剂量。孙逢明[26]研究7个用量的侧芽孢杆菌对水质改善效果,亚硝态氮和氨态氮降解效果没有随用量提高而提高。微生态制剂使用量控制在一定范围内才能有效提高水产动物生长,否则适得其反,降低动物生长性能[27]。桂琳等[28]研究复合益生菌不同用量对草鱼影响发现,当添加量为3 000 mg /kg时,增重率和超氧化物歧化酶活性低于添加量为2 000 mg/kg。本研究中,甲壳素发酵液对水质环境改善,应该与发酵液中含有的壳聚糖和有益微生物密切相关。0.01%和0.02%甲壳素发酵液对水体改善和彭泽鲫生长效果接近,原因可能是养殖池空间相对较小、没有外源水体交换的养殖环境中,微生物达到一定数量后,效果不会随着用量增加而增加,甲壳素发酵液用量建议为0.01%。
结果表明,甲壳素发酵液明显提高了彭泽鲫生长速度,增强了鱼体对嗜水气单胞菌抗性,降低了水体中亚硝态氮、总氮和总磷含量,改善了水质。
致谢
感谢江西省水产科学研究所章海鑫等同志对本研究给予的指导和帮助。
[1]王亚敏,王印庚.微生态制剂在水产养殖中的作用机理及应用研究进展[J].动物医学进展,2008,29( 6):72-75.
[2]Jayakumar R,Menon D,Manzoor K,et al.Biomedical applications of chitin and chitosan based nanomaterials-A short review[J].Carbohyd Polym,2010,82(2):227-232.
[3]Majeti N V,Ravi K.A review of chitin and chitosan applications[J].React Funct Polym,2000,46(1):1-27.
[4]孙立威,文 华,蒋 明,等.壳寡糖对吉富罗非鱼幼鱼生长性能、非特异性免疫及血液学指标的影响[J].广东海洋大学学报,2011,31(3):43-49.
[5]王 月,杨彬彬,邵庆均.甲壳素、壳聚糖对水产动物免疫功能的影响研究进展[J].中国饲料,2013,(6):38-41.
[6]杨怀宇,武婷茹,刘俊希,等.甲壳素-壳聚糖的生理功能及应用研究进展[J].安徽农业科学,2015,43(18):24-25.
[7]陈佳荣.水化学实验指导书[M].北京:中国农业出版社,1998:115-152.
[8]华雪铭,周洪琪,张宇峰,等.饲料中添加壳聚糖和益生菌对暗纹东方鲀幼鱼生长及部分消化酶活性的影响[J]水生生物学报,2005,29(3):299-305.
[9]柏正武,付克勤,宾 琴,等.不同分子量超高脱乙酰度壳聚度糖的制备[J].武汉工程大学学报,2014,36(8):16-19.
[10]阎贺静,胡志平,韩晓红,等.用于壳聚糖降解的复合酶制剂产生菌的筛选[J].食品工业科技,2013,34(5):172-176.
[11]于东祥,柳学周,雷霁霖.甲壳胺制剂对真鲷幼鱼的促生长作用研究[J].海洋水产研究,2000,21(3):62-66.
[12]任秀芳,周 鑫,张 萍,等.壳聚糖对克氏原螯虾存活、血清生化指标和非特异性免疫功能的影响[J].淡水渔业,2013,43(3):77-82.
[13]陈 勇,周洪琪,冷向军,等.壳聚糖对异育银鲫生长和消化酶的影响[J].中国水产科学,2006,13(3):440-445.
[14]李卓佳,贾晓平,杨莺莺,等.微生物技术与对虾健康养殖[M].北京:海洋出版社,2007:20-22.
[15]Telli G S,Ranzani-Paiva M J T,Dias D D C,et al.Dietary administration ofBacillussubtilison hematology and non-specific immunity of Nile tilapiaOreochromisniloticusraised at different stocking densities[J].Fish Shellf Immunol,2014,39(2):305-311.
[16]李盈锋,齐 鑫,华 颖,等.枯草芽孢杆菌对黑鲷幼鱼生长、消化酶活性及抗氧化功能的影响[J].扬州大学学报(农业与生命科学版),2014,35(1):37-42.
[17]沈文英,李卫芬,梁 权,等.饲料中添加枯草芽孢杆菌对草鱼生长性能、免疫和抗氧化功能的影响[J].动物营养学报,2011,23(5):881-886.
[18]Zokaeifar H,Balaczar J L,Saad C R,et al.Effects ofBacillussubtilison the growth performance,digestive enzymes,immune gene expression and disease resistance of white shrimp,Litopenaeusvannamei[J].Fish Shellf Immunol,2012,33(4):683-689.
[19]Goren E,Dejong W A,Doomenbal P ,et al.Protection of chicks againstSalmonellainfection induced by spray application of intestinal microflora in the hatchery[J].Veterin Quart,1984,6(2):73-79.
[20]宋 超,孟顺龙,范立民,等.中国淡水池塘养殖面临的环境问题及对策[J].中国农学通报,2012,28( 26) :89-92.
[21]任秀芳,柏爱旭,张 萍,等.壳聚糖对水质和克氏原螯虾仔虾非特异性免疫酶的影响[J].江苏农业科学,2013,41 (9):202-204.
[22]孙艳辉,董 英.壳聚糖对亚硝酸盐清除作用的研究[J].食品科学,2005,26,(12):71-73.
[23]李永芹,许乐乐,陈克卫.1株芽孢杆菌的筛选鉴定及其净水效果研究[J].水生态学杂志,2013,34(1):96-99.
[24]张峰峰,谢凤行,赵玉洁,等.枯草芽孢杆菌水质净化作用的研究[J].华北农学报,2009,24(4):218-221.
[25]周建忠,吴 伟.微生物与酶对水产养殖池塘底质及有机碳的控制[J].天津农业科学,2015,21(5):23-27.
[26]孙逢明.侧芽孢杆菌(PGPR菌)制剂对南美白对虾池塘水质调控效应的影响[J].当代水产,2013,(6):88-89.
[27]付天玺,许国焕,吴月嫦,等.凝结芽孢杆菌对奥尼罗非鱼消化酶活性、消化率及生长性能的影响[J].淡水渔业,2008,38(4):30-34.
[28]桂 琳,王晓清,康 银,等.一种复合益生菌对草鱼生长和抗氧化功能的影响[J].淡水渔业,2015,45(5):83-87.
(责任编辑:陈细华)
Effects of chitin fermentation liquid on Carassius auratus variety pengze
WANG Ju-hua,ZHANG Guo-hua,HUANG Jiang-li,HUANG Huang, SHENG Ping,ZHANG Zhi-hong
(InstituteofBiologicalResourceofJiangxiAcademyofSciences,Nanchang330096,China)
The effects of the Chitin Fermentation Liquid (CFL) onCarassiusauratusvariety pengze were determined under different concentrations of CFL and CFL-plus- commercial chitosan(0.02% CFL+C),and CFL were splashed into the water regularly.The present results showed that fish weights increased by more than 20% at the end of 2 months of 0.01% CFL,0.02% CFL and 0.02% CFL+C treatments.The growth rates of fishes in these three treatment groups were 101.5%,110.4% and 172.7% higher than that of the control group,respectively (P<0.05).The lipase,trypsin and amylase activities in digestive tracts of fishes treated by 0.01% and 0.02% CFL were 22.03% higher than those of the control group,and there was no significant difference between the 0.01% CFL and 0.02% CFL treatments (P>0.05).In the 0.02% CFL+C treatment group,these three enzyme activities of fishes were 45% higher than those of the control group (P<0.05).Furthmore,we also found that,in the 0.01% CFL treatment group,the nitrite nitrogen,total nitrogen and total phosphorus contents of water were 29.4%,15.2% and 77.8 % lower than those of the control group,respectively (P<0.05).There was no significant difference between 0.01% CFL treatment group and the other two treatment groups (P>0.05).Besides ,the CFL treatment could also reduce the mortality rate of fishes infected byAeromonashydrophila.Taken together,the CFL could improve the disease resistance,growth rate of the fish and water quality.The results presented here clearly indicated the potential of CFL as microbiological preparation for aquaculture.
Chitin fermentation liquid (CFL);chitosan;Carassiusauratusvariety pengze;Aeromonashydrophila
2016-01-06;
2016-06-24
江西省科技攻关计划(20111BBF60043) ;江西省科学院国家预研项目(2013-YGY-6)
王菊华(1961- ) ,男,副研究员,主要从事鱼病防治研究。E-mail:190943152@qq.com
张志红。E-mail:zzh04scau@126.com
S963.73
A
1000-6907-(2016)06-0104-05

