中华鲟piwil1基因的克隆表达特征研究
李创举,杨晓鸽,岳华梅,叶 欢,危起伟
(1.农业部淡水生物多样性保护重点实验室,中国水产科学研究院长江水产研究所,武汉 430223;2.中国水产科学研究院淡水渔业研究中心,江苏无锡 214081)
中华鲟piwil1基因的克隆表达特征研究
李创举1,2,杨晓鸽1,岳华梅1,2,叶 欢1,危起伟1,2
(1.农业部淡水生物多样性保护重点实验室,中国水产科学研究院长江水产研究所,武汉 430223;2.中国水产科学研究院淡水渔业研究中心,江苏无锡 214081)
Piwi是鱼类配子发生和性腺发育的重要调控因子。本研究从中华鲟(Acipensersinensis)性腺中克隆得到了piwi基因的全长cDNA序列,该序列长3 393 bp,开放阅读框为2 583 bp,编码860个氨基酸。氨基酸序列多重对比发现,该序列具有PAZ和PIWI保守结构域,与其他鱼类piwil具有较高同源性;系统进化分析显示,中华鲟piwil聚于piwil1分支;因此,所得序列为piwi-like1基因,命名为Aspiwil1。荧光定量PCR研究表明,Aspiwil1为母源表达,且其表达量随着胚胎发育逐渐降低;Aspiwil1在性腺中大量表达,在脑组织中也有较低水平的表达。性腺组织切片RNA原位杂交结果表明,Aspiwil1仅在生殖细胞表达,且其杂交信号随着卵子发生逐渐增强、精子发生逐渐减弱。本研究为中华鲟配子发生过程中Aspiwil1的功能研究提供了基础。
中华鲟(Acipensersinensis);piwi;克隆;表达;原位杂交
Piwi属于Argonaute蛋白家族成员,具有保守的PIWI和PAZ结构域,该蛋白通过与一类长为26-31个核苷酸的piwi-interacting RNAs (piRNA)结合,形成piwi-piRNA复合体,在配子发生、转座子沉默、DNA甲基化及基因组完整性方面起重要作用[1-2]。Piwi基因首先在果蝇中被鉴定分离出来,其在维持果蝇生殖干细胞的自我更新及分裂调控方面扮演着不可或缺的角色[3-5]。目前,在斑马鱼、青鳉和奥利亚罗非鱼等多种鱼类中鉴定了piwi基因[6]。斑马鱼piwi有ziwi和zili两个成员,且二者在雌、雄性腺中均有表达[7-8]。Ziwi基因突变导致斑马鱼生殖细胞凋亡;zili在斑马鱼生殖细胞分化和减数分裂中起重要作用[1,8]。青鳉opiwi除了在性腺组织中表达外,在眼和脑中也有表达,且opiwi可能参与原始生殖细胞的数量决定并控制其迁移[9]。上述研究表明,不同物种中piwi的表达模式存在一定的差异,但其在生殖细胞发育及配子发生中的功能相对保守。
中华鲟(Acipensersinensis)为大型江海洄游鱼类,由于水利水电工程建设、航运、污染和过度捕捞等人类活动的影响,其生存环境恶化,数量急剧减少,物种处于极度濒危状态,为国家一级保护动物。尽管中华鲟全人工繁殖技术已获突破,但未能规模化,其配子发生的调控机制还不清楚。近年来,pou2[10]、nanos1[11]、dazl/boule[12]和dnd[13]等多个生殖细胞发育调控基因的鉴定为解析中华鲟配子发生规律积累了一定数据。本研究旨在克隆得到中华鲟配子发生过程中起重要作用的piwil1基因,分析其序列特征和系统进化关系,研究其胚胎和组织表达特征,为研究中华鲟配子发生过程中该基因的功能提供基础。
1 材料与方法
1.1 材料
本实验所用子二代中华鲟(3龄,雌、雄各1尾)取自中国水产科学研究院长江水产研究所太湖试验场(湖北荆州)。分别取肝、脾、心、精巢、卵巢、肾、肌肉、肠、垂体、下丘脑、端脑、中脑、小脑和延脑等组织,在液氮中速冻后,然后存放于-80 ℃冰箱备用。用于原位杂交的性腺组织保存于4% 的多聚甲醛溶液中。实验所用的中华鲟胚胎采自2012年全人工繁殖所得胚胎。
1.2 总RNA提取、单链cDNA及SMART cDNA合成
组织总RNA用RNeasy®Plus Mini Kit试剂盒(QIAGEN,德国)提取;按 Super SMART PCR cDNA Synthesis Kit 操作手册的方法合成中华鲟精巢的SMART cDNA;参照PrimeScript® RT reagent Kit With gDNA Eraser (TaKaRa,日本)试剂盒合成cDNA用于qRT-PCR。
1.3 中华鲟Aspiwil1基因全长cDNA克隆及序列分析
在NCBI数据库中搜索已知物种piwil1基因序列,通过ClustalX2分析对比保守区,然后运用Primer Premier 5.0软件设计简并引物,由生工生物工程(上海)有限公司合成(表1)。经PCR扩增反应,克隆获得部分中华鲟piwil1 cDNA序列,根据该序列设计特异引物扩增piwil1 cDNA的5′端和3′端,扩增产物纯化后连入pMD-19T载体,转化大肠杆菌感受态细胞(DH5α),挑取阳性克隆测序。利用DNAStar软件中SeqMan对获得的片段进行拼接,NCBI Blast (http://blast.ncbi.nlm.nih.gov/Blast.cgi)对所得序列进行比对。氨基酸序列同源性的比较采用Clustal W软件,利用 MEGA 6.0软件以邻接法(Neighbor-Joining,NJ)构建系统发生树,自展法(Bootstrap)检验系统分支的置信度(重复次数为1 000)。
1.4 实时荧光定量PCR
根据所得到中华鲟piwil1 cDNA序列,设计定量引物 RT-piwil1 F和RT-piwil1 R (表1),以中华鲟不同组织(心、肝、脾、肾、精巢、卵巢、肌肉、肠、垂体、下丘脑、端脑、中脑、小脑和延脑),以及不同胚胎发育时序(未受精、多细胞、囊胚、原肠胚、神经胚、心脏原基、心跳、出膜)cDNA 为模板进行qRT-PCR反应,按SYBR®Premix Ex TaqTM (Perfect Real Time)试剂盒要求操作,每个样品重复 3 次,以中华鲟内参基因β-actin作对照。扩增反应在 Bio-Rad CFX96TM Real Time System 仪上进行,反应程序为 95 ℃预变性 10 min,95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸15 s,共40个循环。中华鲟Aspiwil1相对表达量采用2-△△Ct的方法计算,实验数据均以平均值±标准差(SD)形式呈现。
1.5 探针合成及原位杂交
根据中华鲟Aspiwil1基因cDNA序列设计一对引物(表1),扩增产物包括Aspiwil1基因的3′ UTR序列。经过PCR扩增之后,割胶回收,将目的条带连接至pGEM-T Easy载体中并测序。按照Plasmid Mini Kit II试剂盒操作说明提取质粒,线性化后作为合成探针的模板。用T7 RNA合成酶,地高辛标记(DIG)合成探针。性腺组织经4%的多聚甲醛固定过夜后,换30%的蔗糖溶液通透过夜,在-20 ℃下连续切片。按照原位杂交的实验步骤,切片加相应的探针60 ℃杂交至少16 h后,加anti-DIG抗体4 ℃孵育过夜,最后用NBT/BCIP显色,并在显微镜下观察拍照。

表1 本研究所用引物
2 结果
2.1 中华鲟piwi基因全长cDNA序列克隆
根据piwi基因的保守序列设计简并引物,以中华鲟的精巢SMART cDNA库为模板,通过PCR扩增得到了一个约700 bp的片段,经测序、BLAST同源比对,确定其为piwi-like1基因。随后,通过末端快速扩增的方法获得了中华鲟piwi-like1 (命名为Aspiwil1)基因的全长cDNA序列。Aspiwil1cDNA全长3 393 bp,包括103 bp 的5′ 非翻译区(Untranslated region,UTR)、2 583 bp开放阅读框(open reading frame,ORF)和687 bp 3′ UTR,编码860个氨基酸(图1)。该序列已提交至GenBank (登录号:KX355457)。
2.2 AsPiwil1氨基酸序列同源性比对及系统发生分析
从NCBI上搜索了其它物种的Piwi氨基酸序列,并用cluster W和boxshade软件进行了Piwi氨基酸的多重对比分析(图1)。结果表明,与其它物种Piwi亚家族的成员一样,中华鲟Piwi蛋白具有高度保守的PAZ (图2绿色方框区域)和PIWI (图1红色方框区域)结构域。中华鲟AsPiwil1与斑马鱼、鲤和青鳉的序列一致性分别为77.38%、77.16%和70.29%;与小鼠(66.16%)和人(65.58%)、鸡(63.49%)及爪蟾(62.21%)序列一致性也较高;但与无脊椎动物的序列一致性最低,低至31.16%。
通过NCBI查找其它物种Piwi的氨基酸序列,接着运用Mega 6.0构建piwi基因的系统进化树。如图2所示,中华鲟piwil1与斑马鱼、青鳉等硬骨鱼类piwil1聚为一个分支,该分支再与爪蟾、鸡、人等高等动物piwil1聚为一支;人Hiwi3(Piwil3)、Hiwi2(Piwil4)及小鼠Miwi2(Piwil4)也均聚于该piwil1分支;脊椎动物piwil2聚于另一分支。
2.3 中华鲟Aspiwil1基因胚胎发育时序表达特征
取中华鲟未受精卵及多细胞、囊胚、原肠胚、神经胚、心脏原基、心跳和出膜期胚胎提取总RNA并逆转录为cDNA,采用荧光定量PCR法检测了各个胚胎发育时期Aspiwil1的表达情况。如图3所示,Aspiwil1基因是母源表达的,在未受精卵中检测到的转录本最多;受精后,随着胚胎的发育,Aspiwil1的转录本呈现逐渐下降的趋势。在多细胞期至原肠胚期间仍可以检测到较多Aspiwil1的转录本存在,大约为未受精卵中的50%;在神经胚期Aspiwil1的转录本急剧下降,在心脏原基期及后续的心跳和出膜期只能检测到微弱Aspiwil1的转录本存在。
2.4 中华鲟Aspiwil1基因的组织表达模式
采用荧光定量PCR法检测了中华鲟心、肝、脾、肾、精巢、卵巢、肌肉、肠、端脑、中脑、小脑、延脑等组织中Aspiwil1基因的表达情况。如图4所示,Aspiwil1基因在精巢和卵巢中大量表达,在垂体、下丘脑、端脑、中脑和小脑等脑组织中有较低水平表达。
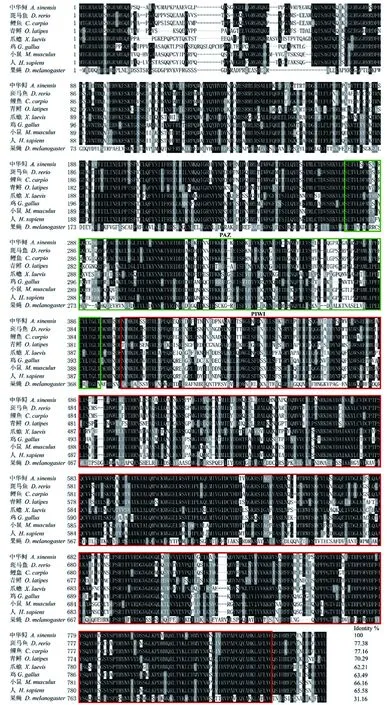
图1 中华鲟和其它物种Piwil1氨基酸序列的多重对比图
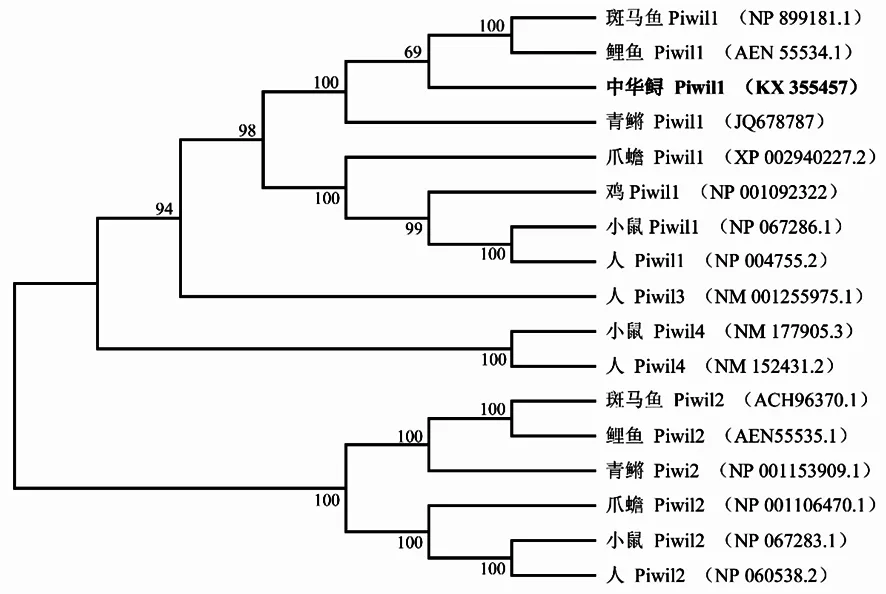
图2 中华鲟及其它物种Piwi氨基酸序列构建的NJ树

图3 中华鲟Aspiwil1基因在胚胎时序中的表达特征
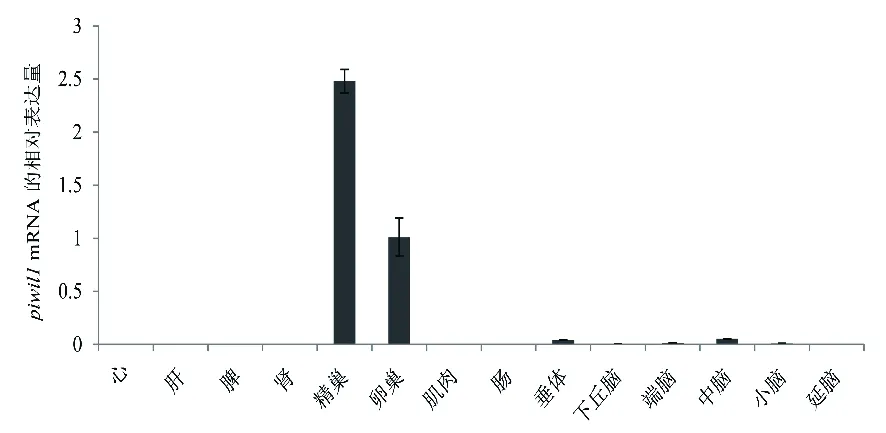
图4 中华鲟Aspiwil1基因在不同组织中的表达特征
2.5 中华鲟Aspiwil1基因在性腺组织中的定位
原位杂交的结果显示,Aspiwil1 mRNA仅在中华鲟性腺组织中的生殖细胞内有表达。用来进行RNA原位杂交的卵巢组织处于II期,精巢组织处于III期;II期卵巢有大量的初级卵母细胞和少量的卵原细胞,III期精巢包含精子发生时期的各种类型细胞。结果表明,卵巢中Aspiwil1 mRNA在卵原细胞中的信号较弱,在初级卵母细胞中的信号较强,并随初级卵母细胞的发育信号逐渐加强(图5A);精巢中,杂交信号在精原细胞较强,在随后的精子发生过程中杂交信号有逐渐减弱的趋势(图5C)。Aspiwil1正义探针均未检测到杂交信号(图B、D)。
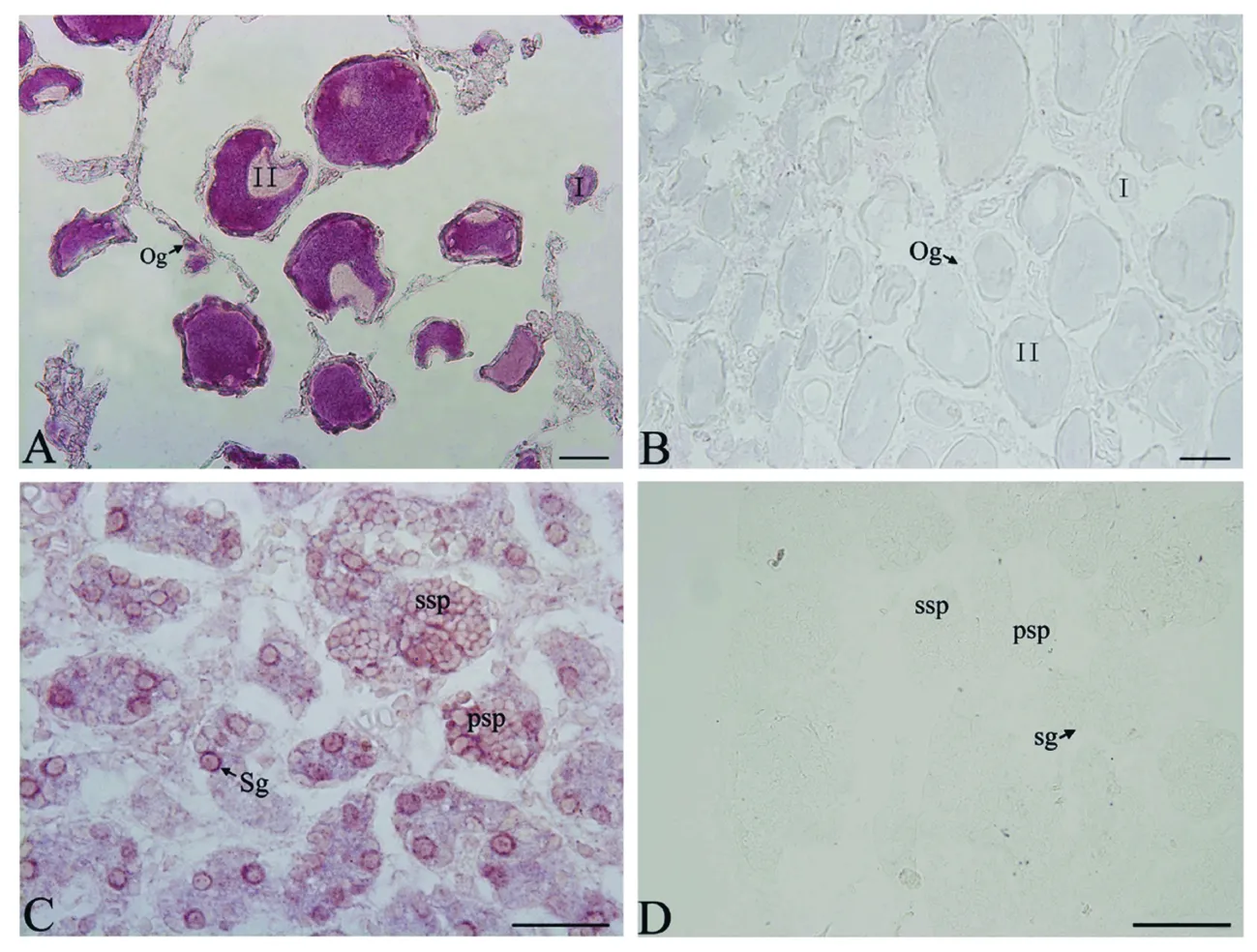
图5 原位杂交检测Aspiwil1 mRNA在中华鲟卵巢(A)和精巢(C)组织切片中的表达
A、C为Aspiwil1反义探针检测到的杂交信号,B和D为Aspiwil1正义探针未检测到信号。og为卵原细胞,罗马数字表示卵细胞发育的不同时期;sg为精原细胞,psp为初级精母细胞,ssp为次级精母细胞,标尺50 μm。
3 讨论
本研究通过基因同源克隆和末端快速扩增的方法获得了Aspiwil1的全长cDNA序列,其编码的蛋白质具有Piwi亚家族所特有的PAZ和PIWI结构域;Aspiwil1与硬骨鱼类等其它物种piwil1具有较高的氨基酸一致性。系统进化分析表明,Aspiwil1与其它物种piwil1、人Hiwi3 (Piwil3)、Hiwi2 (Piwil4)及小鼠Miwi2 (Piwil4)聚于piwil1分支。与哺乳动物中存在3至4个piwi同源基因不同的是,斑马鱼、鲤、牙鲆、奥利亚罗非鱼等硬骨鱼类均只鉴定了2个piwi基因[6]。Piwi在哺乳类等高等脊椎动物中进化为更多分支可能与其复杂的生物学功能相对应。
在斑马鱼中,ziwi是母源表达基因[7];在青鳉中采用RT-PCR研究发现opiwi是母源性的,并在整个胚胎发育时期都有表达[14];olpiwi2在青鳉的胚胎中也有类似的表达模式[15],而在斑马鱼早期发育中没有检测到母源性的zili[8]。本研究发现,Aspiwil1为母源表达,这与piwi1在其它硬骨鱼类胚胎中的表达模式是一致的。Aspiwil1除在精巢和卵巢中有表达外,在脑组织中也有少量的表达。在青鳉和斑马鱼等模式鱼类中也发现了类似的表达模式,青鳉的piwil1不仅在性腺组织中大量表达,在眼和脑组织中也有表达,这表明piwil1除了在生殖细胞的发生发育中起重要做用外,还参与神经组织等体细胞的发育。此外,在禽类中,piwil1除在性腺中有表达外,在肾脏组织中也有表达[16-17];在小鼠等哺乳动物中,piwi仅在精巢中有表达[18]。这些有关piwi基因表达特征的研究结果说明,在进化过程中,piwi的功能在保守中变得更为专一。在青鳉中,原位杂交揭示了piwi基因在精原细胞和精母细胞中大量表达,在更加成熟的精子发生阶段则检测不到piwi基因的信号[9]。与青鳉相似,Aspiwil1仅在达氏鲟两性性腺组织切片中的生殖细胞中有表达,在体细胞中没有表达;且在卵巢中,其杂交信号随卵细胞的发育有增强的趋势;而在精巢中,杂交信号在精子发生的后期有所减弱。上述研究结果为后续中华鲟piwil1基因的功能研究提供了基础。
[1]Houwing S,Kamminga L M,Berezikov E,et al.A role for Piwi and piRNAs in germ cell maintenance and transposon silencing in zebrafish [J].Cell,2007,129(1):69-82.
[2]Bak C W,Yoon T K,Choi Y.Functions of PIWI proteins in spermatogenesis [J].Clin Exp Reprod Med,2011,38(2):61-67.
[3]Lin H,Spradling A C.A novel group of pumilio mutations affects the asymmetric division of germline stem cells in theDrosophilaovary [J].Development,1997,124(12):2463-2476.
[4]Cox D N,Chao A,Baker J,et al.A novel class of evolutionarily conserved genes defined by piwi are essential for stem cell self-renewal [J].Genes Dev,1998,12(23):3715-3727.
[5]Cox D,Chao A H.Piwi encodes a nucleoplasmic factor whose activity modulates the number and division rate of germline stem cells [J].Development,2000,127(3):503-514.
[6]肖 俊,周 毅,陈文治,等.奥利亚罗非鱼Piwi基因的克隆与生物信息学分析[J].激光生物学报,2014,23(4):362-368.
[7]Tan C H,Lee T C,Weeraratne S D,et al.Ziwi,the zebrafish homologue of the Drosophila piwi:co-localization with vasa at the embryonic genital ridge and gonad-specific expression in the adults [J].Mech Dev,2002,119 Suppl 1(2):257-260.
[8]Houwing S,Berezikov E,Ketting R F.Zili is required for germ cell differentiation and meiosis in zebrafish[J].Embo Journal,2008,27 (20):2702-2711.
[9]Li M,Hong N,Gui J,et al.Medakapiwiis essential for primordial germ cell migration [J].Curr Mol Med,2012,12 (8):1040-1049.
[10]Ye H,Du H,Chen X H,et al.Identification of apou2 ortholog in Chinese sturgeon,Acipensersinensisand its expression patterns in tissues,immature individuals and during embryogenesis [J].Fish Physiol Biochem,2012,38 (4):929-942.
[11]Ye H,Chen X H,Wei Q W,et al.Molecular and expression characterization of ananos1 homologue in Chinese sturgeon,Acipensersinensis[J].Gene,2012,511 (2):285-292.
[12]Ye H,Li C J,Yue H M,et al.Differential expression of fertility genesbouleanddazlin Chinese Sturgeon (Acipensersinensis),a basal fish [J].Cell Tissue Res,2015,360 (2):413-425.
[13]Yang X G,Yue H M,Ye H,et al.Identification of a germ cell marker gene,the dead end homologue,in Chinese sturgeonAcipensersinensis[J].Gene,2015,558 (1):118-125.
[14]李名友.青鳉piwi和vasa基因的表达模式和功能分析[D].中国科学院水生生物研究所,2008.
[15]Zhao H,Duan J,Cheng N,et al.Specific expression of Olpiwi1 and Olpiwi2 in medaka (Oryziaslatipes) germ cells.Biochem Biophys Res Commun,2012,418:592-597.
[16]Chen R,Chang G,Zhang Y,et al.Cloning of the quail PIWI gene and characterization of PIWI binding to small RNAs [J].Plos One,2012,7 (12):e51724.
[17]陈 蓉.禽类Piwill基因与piRNAs生物学功能的初步研究[D].扬州大学,2013.
[18]Deng W,Lin H.miwi,a murine homolog ofpiwi,encodes a cytoplasmic protein essential for spermatogenesis [J].Dev Cell,2002,2 (6):819-830.
(责任编辑:张潇峮)
Molecular cloning and expression analysis of piwil1 gene in Acipenser sinensis
LI Chuang-ju1,2,YANG Xiao-ge1,YUE Hua-mei1,2,YE Huan1,WEI Qi-wei1,2
(1.KeyLaboratoryofFreshwaterBiodiversityConservation,MinistryofAgricultureofChina/YangtzeRiverFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Wuhan430223China;2.FreshwaterFisheriesResearchCenter,ChineseAcademyofFisheriesScience,Wuxi214081,Jiangsu,China)
Piwigenes play important roles in regulating the proliferation and division of germline stem cells.Apiwigene,piwi-like1 (Aspiwil1),was cloned through homologous cloning method from the gonad ofAcipensersinensis.The full length ofAspiwil1 was 3 393 bp with an opening reading frame (ORF) of 2 583 bp.Multiple amino acid sequences alignment showed sturgeonAspiwil1 contained the typical conserved PAZ and PIWI motif.Phylogenetic analysis revealed that sturgeonAspiwil1 was clustered into the Piwil1 clade.Aspiwil1 transcripts were found to originate from the maternal parent,of which expression level was gradually decreased with the embryo development by qRT-PCR analyses.In different tissues,Aspiwil1 was distributed in brain besides the gonads.Insituhybridization in gonadal tissues presented thatAspiwil1 transcripts were only detected in germ cells of both sexes.This work would be valuable for further investigation ofpiwigene function in the gonadal development of sturgeon.
Acipensersinensis;piwi;cloning;expression;insituhybridization
2016-06-15;
2016-08-22
中国水产科学研究院淡水渔业研究中心公益性科研院所基本科研业务费专项资金项目(2015JBFM41);公益性行业(农业)科研专项(201203086);国家自然科学基金项目(31472286)
李创举(1980- ),男,博士,副研究员,研究方向为鱼类分子遗传。E-mail:lcj@yfi.ac.cn
危起伟。E-mail:weiqw@yfi.ac.cn
S917.0
A
1000-6907-(2016)06-0020-06

