兴国红鲤AR基因的鉴定及MT暴露对幼鱼肝中AR和vtg表达的影响
李创举,宋明月,2,岳华梅,阮 瑞,叶 欢,杨晓鸽
(1.农业部淡水生物多样性保护重点实验室,中国水产科学研究院长江水产研究所,武汉 430223;2.上海海洋大学水产与生命学院,上海 201306)
兴国红鲤AR基因的鉴定及MT暴露对幼鱼肝中AR和vtg表达的影响
李创举1,宋明月1,2,岳华梅1,阮 瑞1,叶 欢1,杨晓鸽1
(1.农业部淡水生物多样性保护重点实验室,中国水产科学研究院长江水产研究所,武汉 430223;2.上海海洋大学水产与生命学院,上海 201306)
实验克隆了兴国红鲤(Cyprinuscarpiovarsinguonensis)雄激素受体(androgen receptor,AR)基因的全长cDNA序列和卵黄蛋白原(vitellogenin,vtg)基因的部分cDNA序列,并对雌性个体组织及甲基睾丸酮(Methyltestosterone,MT)暴露下幼鱼肝胰腺(以下简称:肝)中AR和vtg的表达进行检测。兴国红鲤AR基因cDNA全长3 229 bp,包括104 bp的5′非编码区(untranslation region,UTR)、编码846个氨基酸的2 541 bp开放阅读框(open reading frame,ORF)和485 bp 3′UTR。氨基酸序列同源性分析表明,兴国红鲤AR与其他鲤科鱼类AR的同源性较高。组织表达特征研究表明,AR在雌性个体的肝、卵巢、中肾、肌肉和端脑中有表达,其中肝中的表达量最高;vtg主要在肝、端脑和鳃中表达。兴国红鲤幼鱼在50 μg/L的MT中暴露4周后,采用qRT-PCR检测了肝中AR和vtg的表达情况。在处理第1、2周,AR的表达受到一定的抑制,而在第3、4周其表达量升高,但其表达无显著性变化;而vtg的表达量在第3、4周均有极显著的升高。
雄激素受体;兴国红鲤(Cyprinuscarpiovarsinguonensis);MT;实时定量PCR;卵黄蛋白原
YangtzeRiverFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Wuhan430223,China;2.CollegeofFisheriesandLife,ShanghaiOceanUniversity,Shanghai201306,China)
环境内分泌干扰物(endocrine disrupting chemicals,EDCs)因其在低剂量下能够干扰野生动物和人类的生理活动而受到广泛关注。EDCs分为环境雌激素和环境雄激素,后者又分为天然雄激素和合成雄激素。甲基睾丸酮(Methyltestosterone,MT)属于天然雄激素,已有报道显示在城市废水和自然界沉积物中可检测到MT[1-2]。MT在鱼类性别分化和发育过程中起重要的作用[3]。
雄激素是一种类固醇激素,在芳香化酶的作用下转化为雌激素,被认为是雌激素的前体物质[4],雄激素的生理作用主要是通过雄激素受体(androgen receptor,AR)介导。AR属于核受体超家族(nuclear receptor super family)中的类固醇受体,该受体家族成员还包括雌激素受体、孕酮受体[5-6]和盐皮质激素受体[7]。鱼类AR基因首先是从日本鳗鲡(Auguillajaponica)中克隆得到的,随后,在黑鲷(Pagrusmajor)[8]、细须石首鱼(Micropogonundulatus)[9]和斑马鱼(Daniorerio)[10]等鱼类中均克隆得到该基因。鱼类卵黄蛋白原(vitellogenin,vtg)主要在肝中由雌激素诱导合成,是卵黄的前体。Matozzo等[11]认为,Vtg可作为水环境中内分泌干扰物污染的一种有用的生物标志物。
兴国红鲤(Cyprinuscarpiovarsinguonensis)是一种温度适应范围广、易于饲养,产卵量大的鱼类。本研究通过RT-PCR和RACE方法获得兴国红鲤AR基因的全长cDNA序列和vtg基因的部分cDNA序列;采用定量PCR(Quantitative real-time polymerase chain reaction,qRT-PCR)方法研究了AR和vtg基因在兴国红鲤雌性成体的组织表达特征及MT暴露对兴国红鲤幼鱼肝胰腺(以下简称:肝)中AR和vtgmRNA表达的影响。
1 材料和方法
1.1 实验鱼和试剂
兴国红鲤成鱼和幼鱼均取自中国水产科学研究院长江水产研究所窑湾试验场。取1龄的兴国红鲤成鱼(♀)的肝、脾、鳃、性腺、中肾、肌肉、肠、端脑、中脑、小脑、延脑等组织。用于暴露的幼鱼(♀)为150日龄。暴露之前将MT(H31020524)(1 mL∶25 mg)溶于二甲基亚砜(Dimethyl Sulfoxide,DMSO)(CAS.No.67-68-5)溶液,避光保存。
1.2 MT暴露实验
MT暴露实验处理组为50 μg/L(处理浓度参照Zheng等[12]),对照组仅加入DMSO(体积分数<0.01%)。暴露时间为四周(28 d)。暴露前将实验鱼在80 L的水箱中暂养10 d,每个处理组/对照组有3个水箱作为平行试验,实验水体体积为60 L,每天更换一半暴露溶液,全天用充气泵增氧,并记录暴露过程中鱼的死亡率,黑暗周期为14 h∶10 h,水温25 ℃。暴露7、14、21、28 d进行采样,每缸随机取三尾雌幼鱼对肝采样,放入RNA Save 溶液中保存备用。
1.3 总RNA的提取、cDNA模板的合成
参照SV Total RNA Isolation System(Promega,美国)试剂盒说明书提取兴国红鲤各组织总RNA并检测其浓度和完整性;用PrimeScriptRT reagent Kit with gDNA Eraser(TaKaRa,Japan)试剂盒合成第一链cDNA,获得各组织的cDNA 模板存于-20 ℃备用。
1.4 兴国红鲤AR和vtg基因cDNA的克隆及序列分析
采用RT-PCR和RACE方法,以肝cDNA为模板克隆AR和vtg的cDNA序列,所用的引物如表1,分别根据GenBank中鱼类AR和vtg的cDNA序列来设计。根据获得AR的cDNA序列设计特异性引物扩增3′和5′端,扩增产物均纯化后连入PMD19-T载体,转化大肠杆菌感受态细胞(DH5α)扩培,通过M13引物进行菌液PCR检测阳性克隆,送上海生工生物工程技术服务有限公司测序。采用Clustal X[1.8]软件将推导的AR氨基酸序列和NCBI公布的同源氨基酸序列比对。利用Mega6.0软件构建系统发生树(邻接法,Neighbor-Joining,N-J)。

表1 本研究所用的引物序列
1.5 AR 和vtg mRNA的组织分布检测
根据所得到的兴国红鲤AR和vtgcDNA序列设计定量PCR引物:qAR-F和qAR-R、qvtg-R和qvtg-F,以兴国红鲤雌性成体组织(肝、脾、鳃、中肾、端脑、中脑、小脑、延脑、卵巢、肌肉、肠)cDNA为模板进行qRT-PCR扩增,并以兴国红鲤β-actin(特异性引物β-actin F和β-actin R,表1)作为内参基因。PCR在Bio-Rad CFX96TM Real Time System仪上进行,反应程序为95 ℃预变性10 min,95 ℃ 变性15 s,58 ℃ 退火15 s,72 ℃ 延伸15 s,循环数为40。
1.6 MT暴露后兴国红鲤幼鱼肝中AR和vtg mRNA表达
参照SV Total RNA Isolation System(Promega,美国)试剂盒说明书提取实验幼鱼肝总RNA。采用qRT-PCR方法检测MT暴露下AR和vtg的表达变化,对照组处理组分别取3个样品,每个样品采用3个平行,PCR反应液包括SYBR Green PCR Master Mix 10 μL,引物(浓度为10 μM)各1 μL,cDNA模板1 μL和双蒸水2 μL。反应程序为95 ℃ 预变性10 min,95 ℃变性15 s,58 ℃退火15 s,72 ℃延伸15 s,循环数为40。数据结果采用ΔCt分析法,相对表达量=2-ΔΔCt。
2 结果
2.1 兴国红鲤AR基因全长cDNA序列克隆
兴国红鲤AR基因的全长cDNA序列为3 130 bp,包括104 bp的5′非编码区(untranslation region,UTR)、编码846个氨基酸的2 541 bp开放阅读框(open reading frame,ORF)和485 bp 3′UTR。该序列已提交GenBank,登录号为KX094549。
2.2 兴国红鲤AR氨基酸序列同源性比对及系统发生分析
将兴国红鲤AR与彭泽鲫(Carassiusauratusvarpengze)等其他鱼类AR进行氨基酸序列比对,结果表明,兴国红鲤AR与彭泽鲫、斑马鱼和黑头软口鲦(Pimephalespromelas)等鲤科鱼类AR的相似性分别为87%、78%、77%。兴国红鲤 AR具有核激素受体所共有的 3 个主要功能区域,即保守性较低的氨基酸结构域(NTD)、高保守的DNA 结合域(DBD)和 C 端配体结合域(LBD)(图1)。以上结果证明本研究克隆所得序列确为兴国红鲤AR基因。

2.3 兴国红鲤AR和vtg的组织表达模式
采用荧光定量PCR法检测了兴国红鲤雌鱼肝、脾、鳃、中肾、端脑、中脑、小脑、延脑、肌、卵巢、肠等组织中AR和vtg基因的表达。AR基因在肝、中肾、卵巢、肌肉和端脑等多个组织有表达,肝中的表达量最高(图3A);vtg在检测的组织中均有表达,肝、端脑和鳃中的表达量较高(图3B)。
2.4 MT暴露对AR和vtg mRNA在兴国红鲤幼鱼肝中的转录水平影响
经过四周50 μg/L MT的暴露,兴国红鲤幼鱼肝中AR和vtg的表达量均有变化。与对照相比,处理第1、2周幼鱼肝中AR的表达受到一定的抑制,但在第3、4周AR的表达高于对照(图4A)。在处理第1、2周幼鱼肝中vtg的表达无明显变化,但在第3、4周表达极其显著的增长,第4周时实验组幼鱼肝中vtg的表达量约为对照组的50倍(图4B)。
3 讨论
在部分硬骨鱼类如虹鳟[7]、细须石首鱼[9]、大西洋黄鱼(Micropogoniasundulates)[13]、鳗[14]等硬骨鱼类中克隆到两种AR亚型:ARα和ARβ,这可能是由于鱼类在进化过程中经历了一次特有的基因组倍增过程,该基因发生了复制。但在本研究中,仅有一种兴国红鲤AR亚型被鉴定,这与斑马鱼[15]、半滑舌鳎[16]等鱼类中的研究结果一致。而且,兴国红鲤性腺转录组测序结果表明,仅有一种AR中被发现(未发表资料)。因此,兴国红鲤中是否存在其他AR亚型还有待于进一步研究。

在虹鳟和日本鳗鲡等鱼类中AR具有两种亚型,ARα和ARβ,但二者的表达模式存在差异。ARα在脑、精巢、卵巢、肝、中肾等多种组织中均有表达,性腺中表达水平较高;而ARβ仅在精巢、脾和肌肉等组织中特异表达[17-18]。本研究中,ARmRNA在各兴国红鲤组织中广泛表达,在肝中的表达量最高,中肾和卵巢中的表达量也很高。这种组织表达模式与斑马鱼[15]和半滑舌鳎[16]中的研究相似。

图1 兴国红鲤与其它4种鱼类及人AR氨基酸序列比对
由于工业废水、生活污水、农牧业排污等人类活动的影响,环境EDCs含量呈增长趋势,对鱼类机体有较大影响。彭泽鲫的研究中,50 μg/L MT暴露对AR的表达无显著影响[12]。本研究中,50 μg/L MT处理前期(第1、2周),兴国红鲤幼鱼肝中ARmRNA表达量受到一定的抑制;但在后期小写字母a、b和c分别表示不同处理浓度组的mRNA表达量的显著性差异(P<0.05)。图4同。
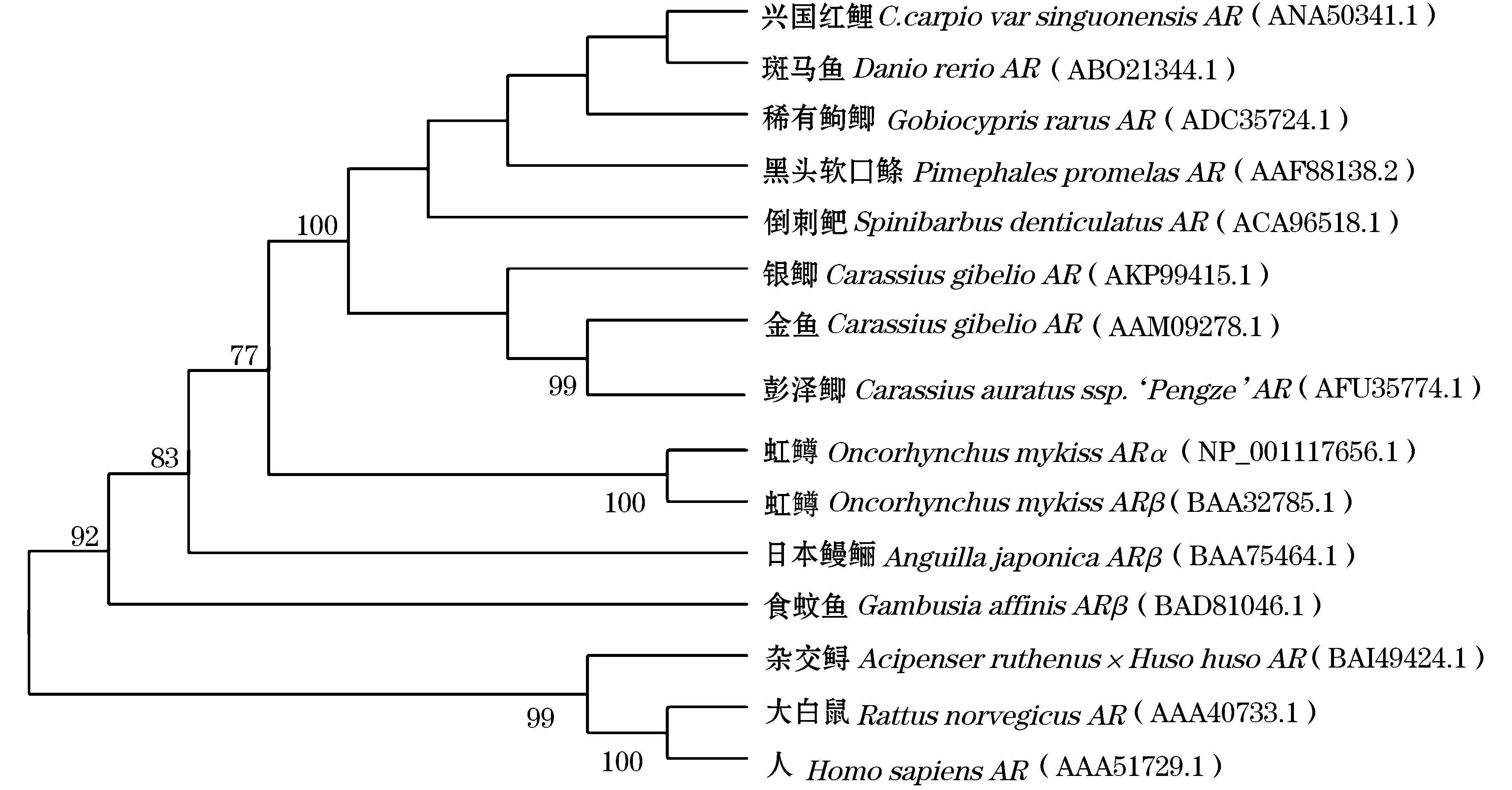
图2 兴国红鲤及其它代表性脊椎动物AR氨基酸序列构建的进化树
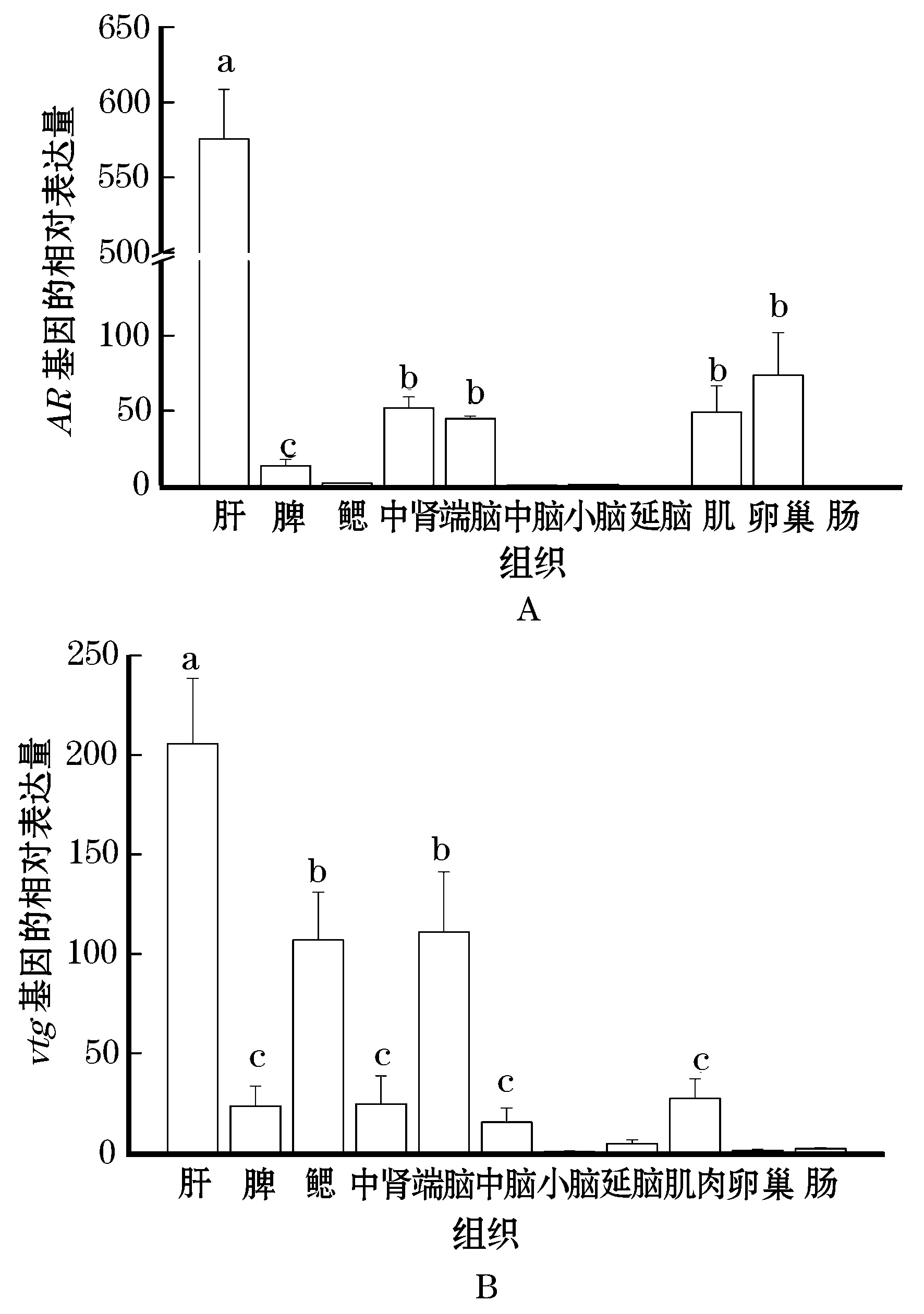
图3 荧光定量PCR检测兴国红鲤成体组织中AR (A)和vtg(B) mRNA的转录水平
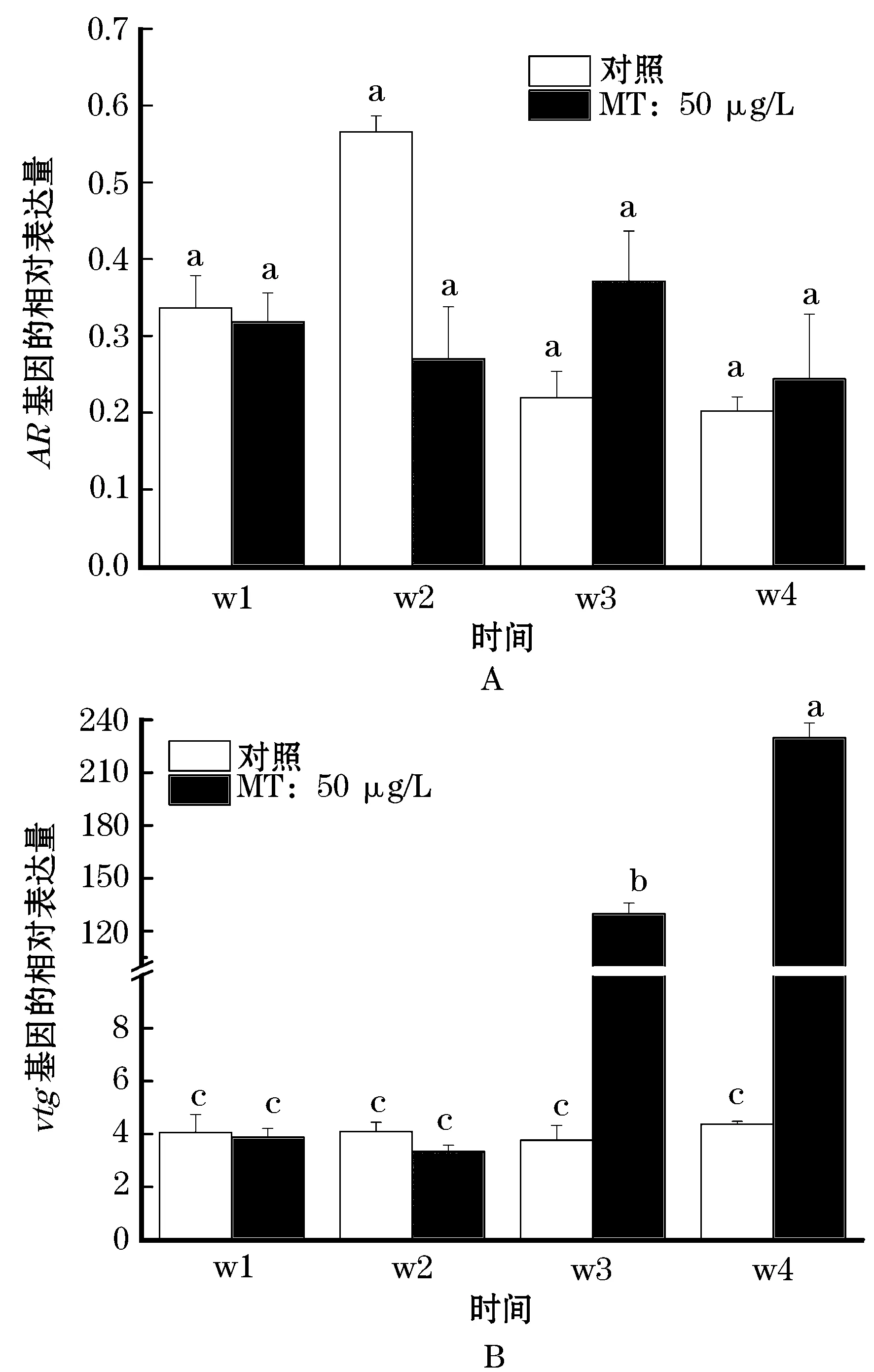
图4 荧光定量PCR检测MT暴露4周兴国红鲤幼鱼肝中AR (A)和vtg (B) mRNA的转录水平
(第3、4周),对AR的表达有一定的促进作用,但作用不显著。vtg基因的表达在MT暴露第1、2周无明显变化,但在第3、4周时显著升高,其表达量分别约为对照组的30、50倍,与黑头软口鲦[19]的研究结果一致。而在彭泽鲫的研究中,50 μg/L MT处理第1、3和4周,vtg的表达显著升高[12]。因此,MT暴露可诱导鱼类vtg的表达,这可能是由于MT被肝转化为内源性雌激素使vtg的转录水平上调,或MT与ESRs结合之后使vtgmRNA表达量增加[19-20]。
[1]Barry M G,Richard J T,Alber Tinka J,et al.Androgenic activity in surface water samples detected using the AR-LUX assay:indication for mixture effects [J].Environ Toxicol Pharmacol,2005,19(2):263-272.
[2]Ke R H,Jiang Y L,Huang Q H,et al.Investigative screening of pharmaceuticals in a municipal wastewater treatment plant in Shanghai [J].Ecotoxicology,2014,9(6):1146-1155.
[3]邹记兴,陶友宝,向文洲,等.人工诱导点带石斑鱼性逆转的组织学证据及其机制探讨[J].高技术通讯,2003,13(6):81-87.
[4]Lassiter C S,Kelley B,Linney E.Genomic structure and embryonic expression of estrogen receptor beta a (ERbetaa) in zebrafish (Daniorerio) [J].Gene,2002,299(1):141-151.
[5]Laudet V,Hänni C,Coll J,et al.Evolution of the nuclear receptor gene family [J].EMBO J,1992,11:1003-1013.
[6]Thornton J W.Evolution of vertebrate steroid receptors from an ancestral estrogen receptor by ligand exploitation and serial genome expansions [J].PNAS USA,2001,98:5671-5676.
[7]Takeo J,Yamashita S.Two distinct isoforms of cDNA encoding rainbow trout androgen receptors [J].Biol Chem,1999,274(9):5674-5680.
[8]Touhata K,Kinoshita M,Tokuda Y,et al.Sequence and expression of a cDNA encoding the red sea bream androgen receptor [J].Biochim Biophys Acta,1999,1449(2):199-202.
[9]Sperry T S,Thomas P.Characterization of two nuclear androgen receptors in Atlantic croaker:comparison of their biochemical properties and binding specificities [J].Endocrinology,1999,140(4):1602-1611.
[10]Hossain M S,Larsson A,Scherbak N,et al.Zebrafish androgen receptor:isolation,molecular,and biochemical characterization [J].Biol Reprod,2008,78 (2):361-369.
[11]Matozzo V,Gagne F,Marin M G,et al.Vitellogenin as a biomarker of exposure to estrogenic compounds in aquatic invertebrates:a review [J].Environ Int,2008,34(4):531-545.
[12]Zheng Y,Wang L H,Li M,et al.Molecular characterization of five steroid receptors from pengze crucian carp and their expression profiles of juveniles in response to 17α-ethinylestradiol and 17α-methyltestosterone [J].Gen Comp Endocrinol,2013,191:113-22.
[13]Sperry T S,Thomas P.Identification of two nuclear androgen receptors in kelpbass (Paralabraxclathratus) and their binding affinities for xenobiotics:comparison with Atlantic croake (Micropogoniasundulates) androgen receptors [J].Biol Reprod,1999,61(4):1152-1161.
[14]Ikeuchi T,Todo T,Kobayashi T,et al.cDNA cloning of a novel androgen receptor subtype [J].Biol Chem,1999,274(36):25205-25209.
[15]Hossain M S,Larsson A,Scherbak N,et al.Zebrafish androgen receptor:isolation,molecular,and biochemical characterization [J].Biol Reprod,2008,78(2):361-369.
[16]温海深,张葭人,陈彩芳,等.雄性半滑舌鳎雄激素受体基因的克隆与表达分析[J].中国海洋大学学报:自然科学版,2009,39(3):387-391.
[17]Smolinsky A N,Doughman J M,Kratzke L T C,et al.Zebrafish (Daniorerio) androgen receptor:sequence homology and up-regulation by the fungicide vinclozolin [J].Comp Biochem Physiol C:Toxicol Pharmacol,2010,151(2):161-166.
[18]Takeo J,Yamashita S.Two distinct isoforms of cDNA encoding rainbow trout androgen receptors [J].Biol Chem,1999,274(9):5674-5680.
[19]Hornung M W,Jensen K M,Korte J J,et al.Mechanistic basis for estrogenic effects in fathead minnow (Pimephalespromelas) following exposure to the androgen MT:conversion of 17a-methyltestosterone to 17a-methylestradiol [J].Aquat Toxicol,2004,66(1),15-23.
[20]Piferrer F,Baker I J,Donaldson E M.Effects of natural,synthetic,aromatizable,and non-aromatizable androgens in inducing male sex differentiation in genotypic female Chinook salmon (Oncorhynchustshawytscha)[J].Gen Comp Endocrinol,1993,91(1),59-65.
(责任编辑:张潇峮)
Characterization of AR gene in Cyprinus carpio var singuonensis and AR and vtg expression in the liver of juveniles upon MT exposure
LI Chuang-ju1,SONG Ming-yue1,2,YUE Hua-mei1,RUAN Rui1,YE Huan1,YANG Xiao-ge1
(1.KeyLaboratoryofFreshwaterBiodiversityConservation,MinistryofAgricultureofChina/
In the study,the full-length cDNA sequence of androgen receptor (AR) and partial sequence of vitellogenin (vtg) were isolated and characterized from the liver ofCyprinuscarpiovarsinguonensis.TheC.carpiovarsinguonensisARcDNA was 3 229 bp in length,including 104 bp 5′-untranslated region (UTR),2 541 bp open reading frame (ORF) encoding 846 amino acid residues,and 485 bp 3′-UTR.Predicted amino acid sequence alignment showed thatC.carpiovarsinguonensisAR shared the highest identities with three cyprinidae species.The expression characterizations ofARandvtgin tissues of mature female fish were analyzed using qRT-PCR.ARwas mainly expressed in liver,ovary,kidney,muscle and cerebrum,with the highest expression level in liver.The mRNA expression ofvtgwas higher in liver,cerebrum and gill.And,the expression profiles ofARandvtgin the liver of juveniles,which was exposed to Methyltestosterone (MT,50 μg/L) for 4 weeks,were detected by qRT-PCR.TheARexpression was down-regulated in the first two weeks and was up-regulated in the 3rd and 4rd weeks,but there were no significant changes in the four weeks.However,the expression ofvtgwas dramatically increased in the 3rd and 4th week.
Androgen receptor;Cyprinuscarpiovarsinguonensis;Methyltestosterone;Quantitative real-time PCR;vitellogenin
2016-05-16;
2016-07-29
国家高技术研究发展计划项目(2011AA100401)
李创举(1980- ),男,博士,副研究员,研究方向为鱼类分子遗传。E-mail:lcj@yfi.ac.cn
S917.0
A
1000-6907-(2016)06-0014-06

