饲料中添加雨生红球藻对七彩神仙鱼生长、体色及抗氧化力的影响
王 磊,陈再忠,冷向军,高建忠,刘 颖,刘汉鹏,宋雪露
(上海海洋大学水产与生命学院,上海 201306)
饲料中添加雨生红球藻对七彩神仙鱼生长、体色及抗氧化力的影响
王 磊,陈再忠,冷向军,高建忠,刘 颖,刘汉鹏,宋雪露
(上海海洋大学水产与生命学院,上海 201306)
为探讨雨生红球藻(Haematococcuspluvialis)对七彩神仙鱼(Symphysodonharaldi)增色效果以及对机体抗氧化力的影响,分别用添加0(对照组)、3.33、6.66、9.99、13.32和16.65 g/kg雨生红球藻(折算成虾青素添加量分别为0、100、200、300、400和500 mg/kg饲料)的饲料饲喂七彩神仙鱼6周,测定七彩神仙鱼皮肤、鳍条、肌肉和肝脏中的虾青素含量、体表的三刺激值和肝脏总抗氧化能力(T-AOC)和谷胱甘肽(GSH)含量。结果显示:饲料中添加雨生红球藻可以显著提高七彩神仙鱼的增重率,当添加量为9.99 g/kg其增重率最大。七彩神仙鱼皮肤、鳍条、肌肉和肝脏虾青素含量随着雨生红球藻添加量的增加而升高,当雨生红球藻添加量超过6.66 g/kg,各组织中虾青素的含量趋于稳定。随着雨生红球藻添加量增加,皮肤L*值(亮度)下降、而a*值(红度)和b*值(黄度)升高,皮肤中虾青素含量与三刺激值间的相关性均达到高度相关,并与a*值的相关性最高。随着雨生红球藻添加量的增加,七彩神仙鱼肝脏的T-AOC和GSH的含量也逐渐升高。结果表明,在饲料中添加雨生红球藻可提高七彩神仙鱼的增重率,提高七彩神仙鱼皮肤虾青素含量,改善七彩神仙鱼体色,增强机体的抗氧化能力;雨生红球藻的添加量建议为6.66~9.99 g/kg(虾青素含量为200~300 mg/kg)。
七彩神仙鱼(Symphysodonharaldi);雨生红球藻(Haematococcuspluvialis);虾青素; 三刺激值;抗氧化力
七彩神仙鱼属于慈鲷科(Cichlidae)盘丽鱼属(Symphysodon),原产于南美亚马逊河流域,共包括3个种,分别是黑格尔七彩神仙(S.discus)、绿七彩神仙(S.aequifasciatus)和蓝棕七彩神仙(S.haraldi)。自1840年被德国人发现之后,经人工养殖和杂交选育,形成了数十个美丽品种,由于其体色鲜艳夺目,花纹变幻,被誉为热带鱼之王。红色系七彩神仙鱼是由野生蓝棕七彩神仙鱼经过长期的杂交选育种而得的人工品系,其主要特征是身体 9条栋线明显退化,体表花纹退化甚至消失,体表色素以红色素细胞为主,黄色素细胞次之,仅背鳍、臀鳍、尾鳍和头部留有少量黑色素细胞,甚至近年来改良形成的红金七彩神仙鱼体表黑色素细胞基本消失[1]。
鱼类自身不具备合成黑色素以外相关色素的能力,所以其遗传特性和外源色素的性质、剂量是影响其色斑形成的主要原因。Liu等[2]报道在饲料中添加350 mg/kg的人工虾青素对盖子红七彩神仙鱼(体长约3 cm)具有较好的着色效果。张晓红等[3]在饲料中添加虾青素和螺旋藻(Spirulinapacifica)均可有效改善血鹦鹉(Cichlasomacitrinellum♀×C.synspilum♂)体色,且虾青素的增色效果显著强于螺旋藻,建议虾青素的适宜添加量为500 mg/kg。李小慧等[4]研究发现基础饲料中添加500 mg/kg的虾青素,或500 mg/kg的虾青素+20 μg/kg甲基睾酮对血鹦鹉具有较好的增色效果。Yang等[5]研究表明饲料中添加一定量的牛黄但酸钠可以促进血鹦鹉对虾青素的吸收,其适宜添加组合剂量为虾青素 400 mg/kg 饲料+牛磺胆酸钠添加量为1 200 mg/kg。
在实际生产中通常在饵料中添加红色素来增加红色系七彩神仙鱼体表色素含量,达到商品要求。然而,由于不同来源的虾青素结构不同,溶解度也不同,所以在增色效果等方面会产生不同差异。而关于天然虾青素对鱼类增色效果的研究较少。雨生红球藻中虾青素含量为1.5%~3.0%,被看作是天然虾青素的“浓缩品”。雨生红球藻所含虾青素及其酯类的配比(约70%的单酯,25% 的双酯及5%的单体)与水产养殖动物自身配比极为相似,这是通过化学合成和利用红发夫酵母等提取的虾青素所不具备的优势[6-7 ]。此外,雨生红球藻中虾青素的结构以3S-3′S型为主,与鲑等水产生物体内虾青素结构基本一致[8]。天然虾青素独特的分子结构,使其具有强大的清除氧自由基、抑制单线态氧的能力[9],是一种比β-类胡萝卜素、维生素E 更为有效的抗氧化剂[10]。因此,本实验以红色系七彩神仙鱼为研究对象,在饲料中添加不同含量雨生红球藻,考察对七彩神仙鱼体色及机体免疫力的影响,可为提高七彩神仙鱼观赏价值和商品价值提供理论基础,为雨生红球藻在观赏鱼饲料中的合理应用提供理论依据。
1 材料和方法
1.1 实验设计与实验饲料
添加雨生红球藻粉(Haematoccuspluvialis)(云南爱尔发生物技术有限公司出产,虾青素含量为30 g/kg)0(C0)、3.33(C1)、6.66(C2)、9.99(C3)、13.32(C4)和16.65(C5) g/kg,折算成虾青素添加量分别为0(对照组)、100、200、300、400和500 mg/kg饲料,经检测,各饲料组中虾青素实际含量依次为2.63、102.21、196.47、301.19、402.47和500.87 mg/kg。各主要原料用绞肉机绞碎混合均匀,冷冻保存,基础饲料组成见表1。
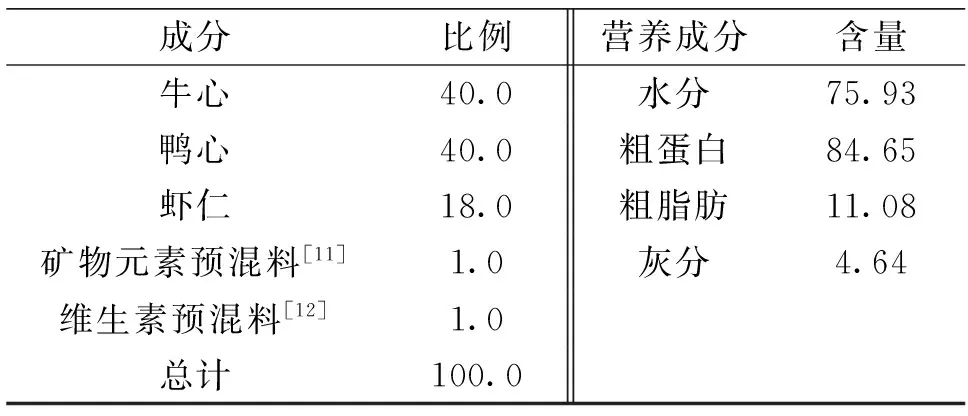
表1 牛心汉堡配方及常规营养组成
注:矿物元素预混料[11](mg/kg饲料):锌,100.00;铁,150.00;铜,3.00;锰,20.00;碘,0.80;钴,0.10;硒,0.10;镁,100.00。[12]维生素预混料(IU/kg饲料):维生素A,2500.00;维生D2,2400.00;维生素预混料(mg/kg 饲料):维生素C,150;维生素E,30.00;维生素K3,10.00;维生素B1,10.00;维生素B2,20.00;维生素B5,40.00;维生素B6,10.00;维生素B7,1.00;维生素B11,5.00;维生素B12,0.02;肌醇,400.00。
1.2 实验鱼及实验管理
实验用七彩神仙鱼来自于本观赏鱼实验室人工繁殖,平均体重(16.74±0.65)g,实验分为6个处理组,每处理组3个重复,每个重复选取体质健壮,外表无伤的鱼20尾,共360尾。
实验用鱼饲养于18个自动充气循环的水族箱中(0.57 m×0.48 m×0.35 m);牛心汉堡冷冻状态下切成0.3~0.5 m3的小块,投饵量为实验鱼体重的3%~4%,以2~3min内吃完为宜,日投喂3次(8:30,12:30,16:30);试验期间水温(27±1)℃,DO>5 mg/L,pH 值为6.9~7.8。养殖周期为6周。
1.3 测定指标与方法
1.3.1 生长指标
于实验结束后饥饿24 h,分别称量实验鱼体重、体长、体高,计算增重率、饲料系数和成活率,主要测定指标如下:
增重率(WG)=(末均重-初均重)(g)/初均重(g)×100%
饵料系数(FCR)=总投饲量/(末体重-初体重)
成活率(SR)=试验末鱼尾数/试验初鱼尾数×100%
1.3.2 基本生化成分的测定
饲养实验结束后,每缸取鱼3尾,取背部肌肉于-20 ℃低温冷冻保存。饲料和肌肉中的粗蛋白质采用凯氏定氮仪测定;水分测定采用105 ℃烘干法(GB/T 6435-2006);粗脂肪测定采用索氏抽提法测定;灰分采用550 ℃马弗炉灼烧法测定。
1.3.3 七彩神仙鱼体表三刺激值( L*、a*、b*值) 的测定
用L*(明度)、a*(+a*偏红,-a*偏绿)、b*(+b*偏黄 -b*偏蓝)代表颜色状态。所用色差计为上海精密科学仪器有限公司物理光学仪器厂生产的WSC-S型测色色差计(o/d光源,带光泽,稳定性ΔY≤0.6)。测定时,先用吸水纸将鱼体表面的水分吸干,再将色差计的探头紧贴于鱼体侧最宽处侧线以上测量,并记录L*、a*、b*值[3]。
1.3.4 虾青素含量测定
养殖实验结束后,每缸取鱼3尾,取侧线以上背部鳞片、皮肤、肌肉及尾鳍,立即测定虾青素含量[12]。称取约2 g皮肤,剪碎,放入25 mL棕色容量瓶中,按质量体积比1∶5加10 mL提取剂(二氯甲烷∶甲醇1∶3),25 ℃超成波萃取9 min,每隔1 h萃取一次,然后3000 r/min离心15 min,收集上清液,再向残渣中加入提取剂,重复萃取离心,直至残渣变为灰白色。合并上清液,及虾青素粗提物。向粗提物中加入1/3 2%氢氧化钾-甲醇溶液,黑暗环境下,室温皂化8 h,2500 r/min离心10 min,在478 nm波长下测定OD值,根据标准曲线计算虾青素含量。
1.3.5 抗氧化力指标测定
采用南京建成生物科技研究所试剂盒测定检测总抗氧化能力(T-AOC)和谷胱甘肽(GSH)活性,采用722 可见分光光度计进行比色定量测定。饲养实验结束后,每缸抽取试验鱼3尾,取两份0.2 g肝脏,用0.85%冰生理盐水冲洗2~3遍,再用吸水纸吸干表面的水分,一份与0.85%冰生理盐水按1∶4在4℃冰水中用手动玻璃匀浆棒研磨至雾状,制成20%的组织匀浆液,冷藏备用,供T-AOC测定,一份与谷胱甘肽试剂盒中的试剂四按1∶4在4 ℃冰水中用手动玻璃匀浆棒研磨至雾状,制成20%的组织匀浆液,-20 ℃冷冻备用,供GSH测定。
1.4 数据统计与分析
实验数据以平均值±标准差表示,采用SPSS11.5统计软件进行单因素方差分析和多重比较。利用EXCEL函数进行相关性分析。
2 结果
2.1 雨生红球藻对七彩神仙鱼生长性能的影响
雨生红球藻对七彩神仙鱼生长性能影响见表2。随着雨生红球藻添加量的增加七彩神仙鱼的增重率显著增加,当添加量为9.99 g/kg 时,增重率最大,随着添加量的继续增加,其增重率又逐渐下降;当雨生红球藻添加量大于3.33 g/kg 时,雨生红球藻添加组饵料系数显著降低,其中添加量为6.66~13.32 g/kg,其饵料系数较其他3组显著降低(P<0.05);各组七彩神仙鱼的成活率很高,各组之间无显著差异(P>0.05)。
2.2 雨生红球藻对七彩神仙鱼体色的影响
各雨生红球藻添加组七彩神仙鱼体表三刺激值见表3。随着雨生红球藻添加量的增加七彩神仙鱼体表的L*值(代表亮度,数值越大,色泽越浅)逐渐下降,对照组的亮度最高,C4和C5组最低(P<0.05);随着雨生红球藻添加量的增加,七彩神仙鱼体表的a*值(代表红色,数值越大,颜色越红)和b*值(代表黄色)也逐渐升高,分别在雨生红球藻添加量达到13.32 g/kg、16..65 g/kg后,保持基本稳定。

表2 饲料中添加雨生红球藻对七彩神仙鱼生长性能的影响
注:同行数据后的不同小写字母表示在P<0.05 水平差异显著。
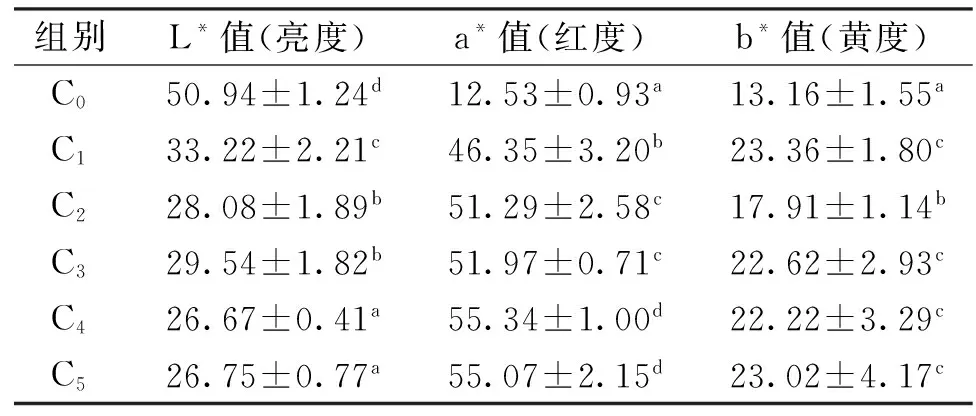
表3 饲料中雨生红球藻粉七彩神仙鱼体表三刺激值的影响
注:同列数据后的不同小写字母表示在P<0.05 水平差异显著。
利用Excel对七彩神仙鱼三刺激值与皮肤中虾青素含量间进行相关性分析,结果显示L*值与虾青素含量相关系数R为-0.957、a*值与虾青素相关系数为0.976、b*值与虾青素相关系数为0.891,三刺激值L*、a*和b*与皮肤虾青素含量的相关性均达到极显著水平(P<0.01),其中a*值与皮肤虾青素含量间的相关系数绝对值最大,相关性最好。
2.3 雨生红球藻对七彩神仙鱼不同组织虾青素含量的影响
投喂添加雨生红球藻的饲料对七彩神仙鱼不同组织虾青素含量的影响见表4。 饲料中添加3.33~16.65 g/kg雨生红球藻,显著增加了肝脏和肌肉中虾青素的含量(P<0.05);当饲料中雨生红球藻添加量由0 g/kg增加到3.33 g/kg时,七彩神仙鱼皮肤和鳍条虾青素含量随雨生红球藻添加量增高而增加,当雨生红球藻添加量超过6.66 g/kg,皮肤和鳍条中的虾青素含量基本趋于稳定。

表4 饲料中添加雨生红球藻对七彩神仙鱼不同组织虾青素含量的影响
注:同行数据后的不同小写字母表示在P<0.05水平差异显著,表5同。
2.4 雨生红球藻对七彩神仙鱼肝脏抗氧化能力的影响
投喂雨生红球藻对七彩神仙鱼肝脏的抗氧化能力影响见表5。雨生红球藻添加组七彩神仙鱼肝脏的总抗氧化能力(T-AOC)和肝脏中谷胱甘肽(GSH)的含量均显著高于对照组(P<0.05),并且随着雨生红球藻添加量的增加七彩神仙鱼肝脏的T-AOC随之升高,其肝脏中GSH的含量也逐渐升高。
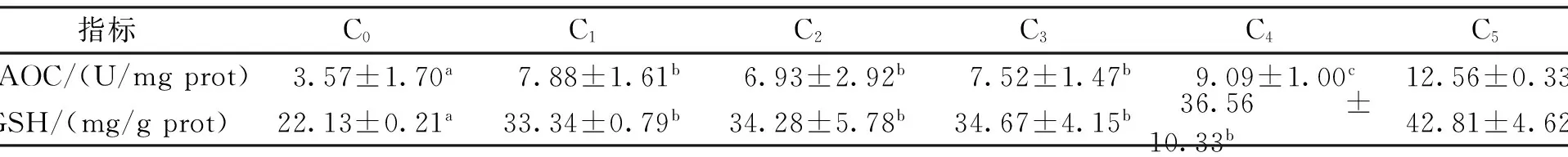
表5 饲料中添加雨生红球藻对七彩神仙鱼肝脏抗氧化力的影响
3 讨论
3.1 雨生红球藻对七彩神仙鱼生长性能的影响
虾青素对养殖生物的生长有显著的促进作用。金征宇等[13]报道了喂食富含虾青素的法夫酵母可使罗氏沼虾(Macrobrachiumrosenbergii)的增重率明显提高,实验表明喂食5周后增重率约达到14.48%。黄璞祎等[14]研究表明在饲料添加一定量的虾青素可以提高七彩神仙鱼的增重率和特定生长率。Zatkova等[15]报道了在瓯鲶(Silurusglanis)饲料中添加富含虾青素的微藻可以提高其特定生长率11%~58%。大西洋鲑(Salmosalar)[16]和虹鳟(Oncorhynchusmykiss)[17]在摄食添加虾青素的饲料时,平均体重较对照组有明显增加。虾青素促进鱼类生长的原因可能是由于虾青素可以促进鱼体组织维生素A蓄积[16],而维生素A是鱼类的生长发育和维持正常生理功能必不可少的营养素[18]。本研究表明饲料中添加6.66~13.32 g/kg的雨生红球藻可以显著提高七彩神仙鱼的增重率,明显地降低饵料系数。本实验中高雨生红球藻添加组(16.65 g/kg)的七彩神仙鱼的增重率显著下降,这与牟文艳等[19]和孔刘娟等[20]报道的高水平虾青素添加组可以抑制血鹦鹉生长结果类似,出现这种现象的原因尚不清楚,有待进一步研究。
3.2 雨生红球藻对七彩神仙鱼体色的影响
鱼类自身不具备合成相关色素的能力,所以外源色素的性质和剂量是影响其色斑形成的重要原因。通过在饲料中添加一定量的色素来调节养殖对象的体色是目前控制水生生物体色的主要手段。吴华昌等[21]在饲料中添加100 mg/kg的叶黄素可以明显的使黄颡鱼体色增黄;史少奕等[22]在杂交鲶(SilurusmeridionalisChen×SilurusasotusLinnaeus)普通虾青素具有较好的增色效果;张晓红等[23]研究了虾青素和螺旋藻均可以有效改善血鹦鹉体色,且虾青素增色效果更好,建议适宜添加量为500 mg/kg;Chien等[24]研究表明饲料中添加天然虾青素(雨生红球藻)和人工虾青素(Carophyll Pink,Roche)可以提高日本对虾(Marsupenaeusjaponicus)肌肉和虾壳中虾青素的含量;Zhang等[12]研究表明饲料中添加不同来源的虾青素(DSM、BASF和广州智特奇)可以提高虹鳟(Oncorhynchusmykiss)肌肉中虾青素含量并可以提高机体的抗氧化能力。本试验中结果表明,饲料中添加一定量的雨生红球藻粉对七彩神仙鱼具有较好的着色效果,尤其是皮肤和鳍条的着色效果尤为显著;相比于低添加量(3.33和6.66 g/kg),高添加剂量(9.99、13.32和16.65 g/kg)对七彩神仙鱼皮肤和鳍条的增色效果没有显著提高(P<0.05)。随着雨生红球藻添加量的增加其肝脏和肌肉中虾青素的含量逐渐升高。而七彩神仙鱼作为观赏鱼,添加雨生红球藻主要目的是为了增色,所以建议七彩神仙鱼的适宜添加量为3.33~6.66 g/kg。
定量评价投喂类胡萝卜素等增色剂对鱼类的增色效果,一般是通过鱼鳞黑色素细胞计数法、分光光度法或高效液相色谱分析测定鱼体的类胡萝卜素[4,25 -26],但这些方法都需要从鱼体身上取下鳞片或皮肤,因而要损伤鱼体。这些方法对于高价值的观赏鱼类显然不适用。
近年来利用测色色差计测定观赏鱼体色的研究越来越多。张晓红等[17]研究表明血鹦鹉体色的三刺激值与皮肤总类胡萝卜素含量有极高的相关性,可用测色色差计测定血鹦鹉的三刺激值,并以此来推算鱼体皮肤总类胡萝卜素含量,定量评价血鹦鹉的体色。冷向军等[27]报道饲料中添加叶黄素0~150 mg/kg时,金鱼体表的+ a*值(红色度)随虾青素添加量的增加而增加,L*值(明度) 随虾青素添加量的增加而降低;当虾青素添加量大于150 mg/kg后,+ a*和L*值基本保持稳定。色差值的变化规律与鳞片、皮肤虾青素含量的变化具有基本一致的趋势,也与肉眼所见色泽变化相一致,可用来对观赏鱼体色进行定量判别。陈林等[28]利用色差仪的三刺激值评价四种黄色增色剂对金鱼体色的增色效果。崔培等[29]利用色差仪的三刺激值研究了在不同蛋白水平下锦鲤对虾青素吸收及体色的影响。本实验用测色色差计测定七彩神仙鱼的体色发现,鱼体体色的三刺激值亮度(L值)随雨生红球藻添加量的增加而减小,红度和黄度(a值和 b值)随随雨生红球藻添加量的增加而增大,与七彩神仙鱼皮肤中虾青素含量的变化存在密切的相关关系,其中 a 值与虾青素含量的相关性最好。因此可用测色色差计测定七彩神仙鱼的三刺激值作为七彩神仙鱼体色的定量指标,从而达到快速和无损定量检测七彩神仙鱼体色和类胡萝卜素含量的目的。
3.3 雨生红球藻对机体的抗氧化能力的影响
总抗氧化能力是用于衡量机体抗氧化系统功能状况的综合性指标,在机体中分为抗氧化酶系统和非酶促系统,其大小可代表和反映机体对外来刺激的代偿能力以及机体自由基代谢的状态,主要作用是分解和清除代谢过程中产生的活性氧自由基[30]。天然虾青素独特的分子结构,使其具有强大的清除氧自由基、抑制单线态氧的能力,是一种比β-类胡萝卜素、维生素E更为有效的抗氧化剂。然而,关于虾青素对水生动物的免疫力的影响报道较少。Nakano等[31]用添加10.87 g/kg红法夫酵母的饲料饲喂虹鳟后显著降低了血清GPT和GOT的活力及脂质过氧化物的产生。崔惟东等[32]研究表明饲料中添加一定量的虾青素和角黄素均可以提高虹鳟的总抗氧化能力。这些研究表明虾青素、角黄素具有提高机体抗氧化能力的作用。本研究结果表明,饲料中添加一定量的雨生红球藻粉可以显著提高机体的抗氧化能力。
[1]刘晓东,陈再忠.七彩神仙鱼皮肤色素细胞观察及类胡萝卜素组分分析[J].上海水产大学学报,2008,17(3):339-343.
[2]Liu X D,Wang H X,Chen Z Z.Effect of carotenoids on body colour of discus fish(Symphysodon aequifasciatus axelrodi Schultz,1960)[J].Aquacult Res,2016,47:1309-1314.
[3]张晓红,吴锐全,王海英,等.虾青素与螺旋藻对血鹦鹉体色的影响[J].大连水产学院学报,2009,24(1):79-82.
[4]李小慧,汪学杰,牟希东,等.饲料中添加虾青素对血鹦鹉体色的影响[J].安徽农业科学,2008,36(20):8606-8607.
[5]Yang H Y,Mu X D,Luo D,et al.Sodium taurocholate,a novel effective feed-additive for promoting absorption and pigmentation of astaxanthin in blood parrot (Cichlasoma synspilum♀× Cichlasoma citrinellum♂)[J].Aquaculture,2012,350:42-45.
[6]Storebakken T,Foss P,Austreng E,et al.Carotenoids in diets for salmonids II.epimerization studies with astaxanthin in Atlantic salmon[J].Aquaculture,1985,44(4):259-269.
[7]Orosa M,Valero J F,Herrero C,et al.Comparison of the accumulation of astaxanthin inHaematococcuspluvialisand other green microalgae under N-starvation and high light conditions[J].Biotechnol Lett,2001,23(13):1079-1085.
[8]Sommer T R,Potts W T,Morrissy N M.Utilization of microalgal astaxanthin by rainbow trout (Oncorhynchus mykiss)[J].Aquaculture,1991,94(1):79-88.
[9]Naguib Y M.Antioxidant activities of astaxanthin and related carotenoids[J].J Agr Food Chem,2000,48(4):1150-1154.
[10]Johnson E A,An G H.Astaxanthin from microbial sources[J].Crit Rev Biotechnol,1991,11(4):297-326.
[11]Zhang J J,Li X Q,Leng X J,et al.Effects of dietary astaxanthins on pigmentation of flesh and tissue antioxidation of rainbow trout (Oncorhynchusmykiss)[J].Aquacult Int,2013,21(21):579-589.
[12]赵立艳,赵广华,陈 芳,等.利用高效液相色谱法测定雨生红球藻中虾青素含量[J].食品工业科技,2006,27(5):177-178.
[13]金征宇,过世东,吕玉华.饲料中添加富含虾青素的法夫酵母对罗氏沼虾的体色及生长状况的影响[J].饲料工业,1999,20(10):29-31.
[14]黄璞祎,贾铭宇,刘 涛,等.虾青素对七彩神仙鱼生长和形体的影响[J].吉林农业,2011,3:93-94.
[15]Zatkova I,Sergejevova M,Urban J,et al.Carotenoid-enriched microalgal biomass as feed supplement for freshwater ornamentals:albinic form of wels catfish (Silurus glanis)[J].Aquacult Nutr,2011,17(3):278-286.
[16]Christiansen R,Torrissen O J.Growth and survival of Atlantic salmon,Salmo salar L.fed different dietary levels of astaxanthin Juveniles[J].Aquacult Nutr,1996,2(1):55-62.
[18]罗 刚.鱼类维生素营养研究概括[J].贵州畜牧兽医,2009,33(2):18-19.
[19]牟文燕,韦敏侠,高 妍,等.虾青素对血鹦鹉生长、体形、体色及抗氧化能力的影响[J].饲料工业,2014,(S1):73-76.
[20]孙刘娟,吴李芸,白东清,等.虾青素对血鹦鹉体色、生长和非特异性免疫指标的影响[J].北方农业学报,2016,44(1):91-95.
[21]吴华昌,邓 静.叶黄素对黄腊丁体色影响的研究[J].粮食与饲料工业,2005,10:37.
[22]史少奕,李小勤,冷向军,等.饲料中添加不同形式叶黄素对杂交鲶体色的影响[J].上海海洋大学学报,2010,19(2):196-200.
[23]张晓红,吴锐全,王海英,等.饲料中添加虾青素对血鹦鹉皮肤类胡萝卜素含量和体色三刺激值的影响[J].广东海洋大学学报,2010,30(4):77-80.
[24]Chien Y H,Shiau W C.The effects of dietary supplementation of algae and synthetic astaxanthin on body astaxanthin,survival,growth,and low dissolved oxygen stress resistance of kuruma prawn,MarsupenaeusjaponicusBate[J].J Exp Mar Biol Ecol,2005,318(2):201-211.
[25]叶元土,郭建林,萧培珍,等.养殖武昌鱼体色与鳞片黑色素细胞初步观察[J].饲料工业,2006,27(22):25-27.
[26]陈晓明,徐学明,金征宇.富含虾青素的法夫酵母对金鱼体色的影响[J].中国水产科学,2004,11(1):70-73.
[27]冷向军,石 英,李小勤,等.饲料中添加叶黄素对金鱼体色的影响[J].浙江大学学报:农业与生命科学版,2010,36(2):168-174.
[28]陈 林,符秋娟.四种食用色素对金鱼体色的影响[J].上海海洋大学学报,2007,16(1):79-82.
[29]崔 培,姜志强,王 雪,等.不同蛋白水平的虾青素饲料对锦鲤体色、生长及免疫的影响[J].上海海洋大学学报,2012,21(3):382-388.
[30]张春玲,胡俊峰,王丕文,等.苯并(a)芘对鲫鱼肝脏总抗氧化能力的影响[J].环境与健康杂志,2004,21(5):325-326.
[31]Nakano T,Kanmuri T,Sato M,et al.Effect of astaxanthin rich red yeast (Phaffia rhodozyma) on oxidative stress in rainbow trout[J].Biochim Biophys Acta,1999,1426(1):119-125.
[32]崔惟东,冷向军,李小勤,等.虾青素和角黄素对虹鳟肌肉着色和肝脏总抗氧化能力的影响[J].水产学报,2009,33(6):987-995.
(责任编辑:邓 薇)
Effect of Haematococcus pluvialis on growth,body color and antioxidation capacity of discus fish Symphysodon haraldi
WANG Lei,CHEN Zai-zhong,LENG Xiang-jun,GAO Jian-zhong,LIU Ying, LIU Han-peng,SONG Xue-lu
(CollegeofFisheriesandLifeSciences,ShanghaiOceanUniversity,Shanghai201306,China)
The present study was conducted to evaluate the effects of dietaryHaematococcuspluvialison body color and antioxidation capacity of discus fishSymphysodonharaldi.Six diets were prepared with the supplementation ofH.pluvialisat levels of 0 (control),3.33,6.66,9.99,13.32 and 16.65 g/kg diet (0,100,200,300,400 and 500 mg/kg astaxanthin),and fed to juvenile discus with initial body weight of 16.74±0.65 g.After 6 weeks rearing,H.pluvialissignificantly stimulated the growth of discus fish,and the discus fish had the highest weight gain when the addition level was 9.99 g/kg.The L*values gradually decreased with the increasingH.pluvialissupplemented level.The a*、b*value and astaxanthin content in skin of fish fedH.pluvialissupplemented diets were significantly higher than those of the control fish (P<0.05).The L*、a*and b*values of skin were highly correlated to the astaxanthin contents in skin of discus fish.The total antioxidation capacity (T-AOC) and glutathione (GSH) of liver in theH.pluvialissupplemental groups was significantly higher than those of control group (P<0.05).The results indicate that supplementingH.pluvialisin diet could enhance the astaxanthin content in skin,improve the body color and promote the antioxidant capacity of discus fish.The supplemental level ofH.pluvialiswas suggested to be 6.66~9.99 g/kg (200~300 mg/kg astaxanthin).
Symphysodonharaldi;Haematococcuspluvialis;astaxanthin;L*,a*,b*score of colorimeter;antioxidation
2016-03-17;
2016-06-20
沪农科种字(2015)第19号;水产动物遗传育种中心上海市协同创新中心(ZF1206)
王 磊(1982- ),男,博士后,专业方向为观赏水族营养与饲料。E-mail:wanglei@shou.edu.cn
冷向军。E-mail:xjleng@shou.edu.cn
S963.73
A
1000-6907-(2016)06-0092-06

