模拟胃肠液环境下Mozzarella干酪提取液抗氧化活性
赵玉明,马玲,谢海军*
(1.山西省生物研究所,山西太原030006;2.山西农业大学食品科学与工程学院,山西太谷030801)
模拟胃肠液环境下Mozzarella干酪提取液抗氧化活性
赵玉明1,马玲2,谢海军1*
(1.山西省生物研究所,山西太原030006;2.山西农业大学食品科学与工程学院,山西太谷030801)
为评价干酪成熟过程中形成的活性肽及存活的发酵剂菌种对人体的抗氧化作用,对不同菌种组合Mozzarella干酪的蒸馏水、pH4.6醋酸缓冲液和12%三氯乙酸(TCA)提取液在模拟胃肠液环境下对DPPH自由基的清除率以及还原力进行测定。结果表明,所有不同菌种组合Mozzarella干酪的不同溶剂提取液在模拟胃肠液的环境下具有一定的抗氧化活性,并且模拟肠液的抗氧化活性大大低于模拟胃液环境,活性下降最高达88.35%。添加干酪乳杆菌(Lactobacillus casei)LPC-37的3号Mozzarella干酪提取液在模拟胃肠液环境下的抗氧化活性高于其他Mozzarella干酪,其水、pH4.6醋酸缓冲液、12%TCA提取液在模拟肠液环境下对DPPH清除率分别为73.96%、30.28%、70.27%,还原力分别为0.37、0.18、0.18。
Mozzarella干酪;发酵剂;模拟胃肠液;抗氧化活性
干酪成熟期间在残留凝乳酶、牛乳中固有的纤维蛋白溶酶、发酵剂及非发酵剂所产生的蛋白酶、肽酶的作用下形成了一系列的功能性活性物质,其中的抗氧化肽在体外有很强的抗氧化活性,相关肽的分离及功能活性已有报道[1],如PRITCHARD S R等[2]报道市售切达奶酪中分子质量>10 ku的肽对DPPH清除率较高,MEIRA S M M等[3]对巴西南部和阿根廷的奶酪水溶性提取液中的生物活性肽的抗氧化活性进行了研究,而国内主要是对蛋白酶解后的成分进行分离及功能验证[4-6],对干酪中的活性成分的研究报道很少。ABAD A-GARC A L等[7]发现在乡村干酪中添加益生菌(干酪乳杆菌、鼠李糖乳杆菌)形成了更多的抗氧化活性肽。有关功能成分在模拟胃肠液中的活性可以间接反映其在体内的活性,相关的报道较多[8-10],但有关干酪成熟过程中提取液在模拟胃肠液环境下的抗氧化活性少见报道,本研究主要就不同菌种制作的Mozzarella干酪提取液在模拟胃肠液下的抗氧化活性进行测定,为评价干酪成熟过程中形成的抗氧化肽及存活的菌种对人体的抗氧化作用提供理论参考,为益生菌在干酪中的应用提供理论支持。
1 材料与方法
1.1材料与试剂
新鲜牛乳:山西农业大学牧站。唾液链球菌嗜热亚种(Streptococcus salivariussubsp.Thermophilus)CH9和保加利亚乳杆菌德氏亚种(Lactobacillus delbrueckilsubsp.Bul-garicus)LB:山西农业大学食品科学与工程学院畜产品加工实验室;干酪乳杆菌(Lactobacillus casei)LPC-37、双歧杆菌(Bifidobacterium bifidum)BI-07、嗜酸乳杆菌(Lactobacillus acidophilus)LA14、凝乳酶Stamix 1150(11 350 IU):丹尼斯克中国有限公司。
氯化铁、铁氰化钾、醋酸、醋酸钠、三氯乙酸(trichloroacetic acid,TCA)、铁氰化钾(K3Fe(CN)6)、盐酸、磷酸二氢钠、磷酸氢二钠:天津市科密欧化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):美国Sigma公司;胰蛋白酶(250U/L)、胃蛋白酶(3 000 U/L):诺维信(中国)生物技术有限公司。
酸化MRS琼脂培养基:蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,磷酸氢二钾2 g,柠檬酸铵2 g,乙酸钠5 g,葡萄糖20 g,吐温-80 1 mL,硫酸镁0.58 g,硫酸锰0.25 g,琼脂15 g,蒸馏水1 000 mL,pH 5.6,121℃灭菌15 min。
M17基础培养基:蛋白胨1(酪蛋白的胰蛋白酶消化物)2.5 g,蛋白胨2(肉的胃蛋白酶消化物)2.5 g,蛋白胨3(大豆的木瓜酶消化物)5 g,酵母提取物2.5 g,牛肉膏5 g,β-磷酸甘油二钠10 g,硫酸镁0.25 g,抗坏血酸0.5 g,琼脂15 g,蒸馏水950 mL,pH 7.1~7.2,121℃灭菌15 min。
乳糖溶液:乳糖10 g,蒸馏水100 mL,121℃灭菌15 min。
M17合成培养基:M17基础培养基95 mL,乳糖溶液5 mL。
1.2仪器与设备
BS 224 S电子天平:北京赛多利斯仪器系统有限公司;HH-4数显恒温水浴锅:江苏省金坛市友联仪器研究所;DL-CJ-2F医疗型洁净工作台:北京东联哈尔仪器制造有限公司;TDL-4台式离心机:上海安亭科学仪器厂;R201D-11旋转蒸发仪:上海亚荣生化仪器厂;精密酸度计pH211:上海雷兹仪器有限公司;721可见分光光度计:上海光谱仪器有限公司。
1.3方法
1.3.1菌种的活化
在液体MRS培养基将冻干菌粉进行活化(42℃,10~12 h),然后在灭菌脱脂乳中依次活化,直到菌种42℃,4 h凝乳良好,适合做发酵剂,再进一步扩大为生产发酵剂。
1.3.2Mozzarella干酪及提取液制备
Mozzarella干酪制作采用无盐渍新工艺[11]。1%(保加利亚乳杆菌∶嗜热链球菌=1∶1)混合发酵剂,成熟四个月,记为1号干酪;1%(保加利亚乳杆菌∶嗜热链球菌=1∶1)混合发酵剂,成熟一年,记为2号干酪;0.5%干酪乳杆菌LPC-37+ 0.5%(保加利亚乳杆菌∶嗜热链球菌=1∶1)混合发酵剂,成熟一年,记为3号干酪;0.5%嗜酸乳杆菌LA14+0.5%(保加利亚乳杆菌∶嗜热链球菌=1∶1)混合发酵剂,成熟一年,记为4号干酪;0.5%双歧杆菌BI-07+0.5%(保加利亚乳杆菌∶嗜热链球菌=1∶1)混合发酵剂,成熟一年,记为5号干酪。
准确称取成熟后的5种干酪各30 g三份,将干酪切碎并充分研磨,分别加入蒸馏水、pH 4.6醋酸缓冲溶液、12% TCA各100 mL,搅匀静置1 h后,用双层滤纸过滤,取下层清液,所得清液用旋转蒸发仪减压浓缩呈黏稠状,用30 mL蒸馏水溶解稀释,并于离心机中1 000 r/min离心10 min,取上层清液,即为干酪提取液,置于4℃冰箱中待用。
1.3.3模拟胃肠液的制备[12-14]
模拟胃液:稀盐酸16.4 mL,加水800 mL、胃蛋白酶10 g,摇匀后加水至1 000 mL。
模拟肠液:取磷酸二氢钾6.8 g,加水500 mL溶解,用0.1 mol/L NaOH溶液调节pH至6.8,另取胰蛋白酶10 g加适量水使之溶解,将两液混合并加水至1 000 mL。
1.3.4干酪提取液在模拟胃肠液中反应
分别取1 mL稀释后的干酪提取液于试管中(标注),置于37℃恒温水浴箱中,一段时间后分别向各试管中加入4 mL胃液(37℃),并于37℃恒温水浴箱中反应30 min,然后至于冰水中终止反应。
用同样的方法将各干酪提取液于模拟肠液中进行反应。
1.3.5干酪提取液对DPPH自由基清除能力的测定[15-17]
在试管中分别加入0.5 mL反应后的样液和1 mL DPPH溶液充分振摇后放于暗处在室温下反应30 min,然后于波长517 nm处测定吸光度值。并测0.5 mL样液加1.5 mL甲醇的吸光度值作对照,用1 mL DPPH溶液加等体积的甲醇作空白,测定时用无水甲醇调零。按照下列公式计算样品对DPPH自由基的清除能力。
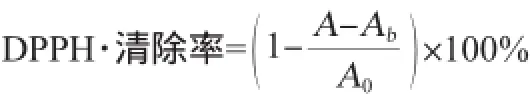
式中:A为样液与DPPH试剂混合液的吸光度值;Ab为样液与空白溶剂混合液的吸光度值;A0为DPPH试剂与空白溶剂混合液的吸光度值。
1.3.6干酪提取液还原力的测定[18-20]
取于模拟胃(肠)中反应后的样液各1 mL,分别加入0.2 mL磷酸盐缓冲液(phosphate buffer solution,PBS)(pH= 6.6,0.2 mol/L)和0.5 mL 1%K3Fe(CN)6于试管中,混匀,在50℃水浴中反应20 min,用流水速冷,而后加入1 mL的10%三氯乙酸混匀,3000r/min离心10min,取上清夜1.5mL,加0.2 mL新配的0.1%FeCl3和3 mL蒸馏水摇匀后,以蒸馏水调零,在波长700 nm处检验溶液的吸光度值。
1.3.7多肽含量及乳酸菌数的测定
多肽含量的测定参考文献[21-22],采用双缩脲法;乳酸菌数的测定参考文献[23-24],采用MRS稀释平板法。
2 结果与分析
2.1不同提取液在模拟胃肠液环境中对DPPH自由基清除率
由图1可知,5种不同发酵剂制作Mozzarella干酪的水溶性提取液在模拟胃液环境下具有较强的清除DPPH自由基的能力,但在模拟肠液的环境下其清除能力都大大降低,可能水溶性提取液中的抗氧化成分在模拟肠液环境下被降解为无抗氧化活性成分,具体机理有待进一步研究。添加0.5%干酪乳杆菌LPC-37制备的3号Mozzarella干酪水溶性提取液在模拟肠液的环境下仍有较高的清除能力,与其他干酪有显著性差异(P<0.05)这可能与特定的发酵剂对干酪基质蛋白质的降解有关,也可能与菌种的耐受不良环境能力有关,因为菌种本身也有一定的抗氧化活性。GUPTAN A等[19,25]报道发酵食品及干酪中分离到的发酵剂和非发酵剂菌种具有一定的抗氧化活性,但植物乳杆菌(L.plantarum)C88在胃蛋白酶和胰蛋白酶处理后其抗氧化活性较对照显著降低,而胰蛋白酶处理后其活性更低。
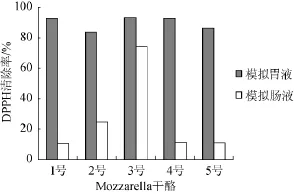
图1 不同Mozzarella干酪水溶性提取液在模拟胃肠液环境下对DPPH自由基清除率Fig.1 DPPH free radical scavenging rate of soluble extracts from different Mozzarella cheeses by distilled water in the simulated gastrointestinal fluid
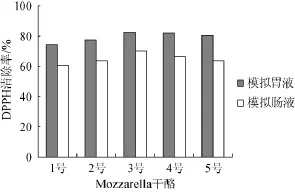
图2 不同Mozzarella干酪12%TCA提取液在模拟胃肠液环境下对DPPH自由基清除率Fig.2 DPPH free radical scavenging rate of soluble extracts from different Mozzarella cheeses by 12%TCA in the simulated gastrointestinal fluid
由图2可知,5种干酪的12%TCA提取液在模拟胃肠液的环境下都具有较高的清除DPPH自由基的能力,模拟肠液环境后较模拟胃液环境对DPPH自由基的清除率有所降低。在模拟胃液的环境下其清除率都低于水溶性提取液,在模拟肠液环境下清除率反而高于水溶性提取液。由于12%TCA提取液中一般包含小肽及氨基酸类,反映干酪基质中蛋白降解的深度,而这些小肽类(特别是N端含有疏水性氨基酸)和氨基酸(尤其是疏水性的氨基酸)有很强的抗氧化活性[3,26]。此外,一些氨基酸如组氨酸(由于其咪唑环分解后可作为氢受体,捕捉自由基)、酪氨酸、蛋氨酸和半胱氨酸本身都具有较强的自由基清除能力[3,26]。在模拟肠液中12%TCA提取液抗氧化活性较高可能与其中溶解的部分具有抗氧化活性的氨基酸有关,因而12%TCA提取液在模拟胃肠液反应后对DPPH自由基的清除率仍然较高。3号干酪12%TCA提取液对DPPH自由基的清除率仍高于其他干酪,但差异不显著(P>0.05),这与3号干酪所添加的干酪乳杆菌有关,干酪乳杆菌不仅降解干酪中的蛋白形成了抗氧化成分,同时干酪乳杆菌能够耐受胃肠道不良环境而存活并发挥抗氧化作用。
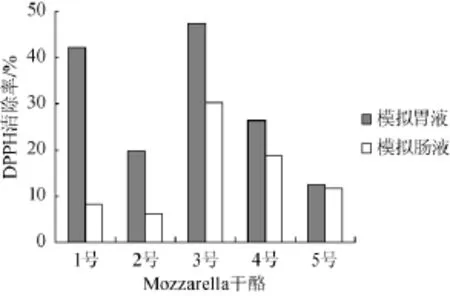
图3 不同Mozzarella干酪pH 4.6醋酸缓冲液提取液在模拟胃肠液环境下对DPPH自由基清除率Fig.3 DPPH free radical scavenging rate of soluble extracts from different Mozzarella cheeses by pH 4.6 acetic acid buffer solution in the simulated gastrointestinal fluid
由图3可知,pH 4.6醋酸缓冲液提取液在模拟胃肠液环境下对DPPH自由基的清除率低于水溶性提取液和12% TCA提取液,模拟肠液环境下对DPPH自由基清除率低于模拟胃液环境下,3号干酪在模拟胃肠液环境下对DPPH自由基的清除率显著高于其他干酪(P<0.05)。pH 4.6醋酸缓冲液提取液能将未降解的酪蛋白沉淀,多肽、氨基酸溶解其中,一般用以反映干酪基质中蛋白降解的广度,所包含的肽段大于12%TCA提取液,因而其抗氧化活性低于12%TCA提取液。
2.2不同提取液在模拟胃肠液环境中的还原力
还原力在一程度上表明了此物质的抗氧化活性大小,但由于评价抗氧化方法的不同,还原力和清除自由基之间有时难以对应。由图4可知,不同菌种组合Mozzarella干酪的水溶性提取液在模拟肠液中的还原力较模拟胃液中低,这与清除DPPH自由基的结果一致。3号干酪水溶性提取液在模拟胃肠液中的还原力高于其他干酪。GARC ARUIZ A等[27]报道在模拟胃液环境下,一般乳酸菌菌数下降3个数量级,而干酪乳杆菌(L.casei)CIAL-51和干酪乳杆菌(L.casei)CIAL-52只下降1个数量级,在模拟肠液环境下也有很高的存活率,充分说明干酪乳杆菌具有耐受不良环境的能力。
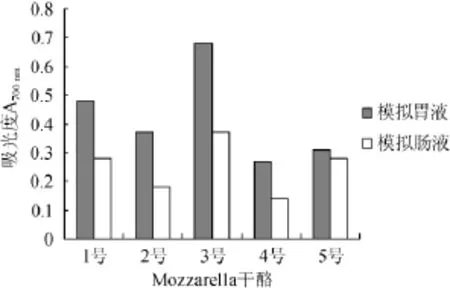
图4 不同Mozzarella干酪水溶性提取液在模拟胃肠液环境中的还原力Fig.4 Reducing power of soluble extracts from different Mozzarella cheeses by distilled water in the simulated gastrointestinal fluid
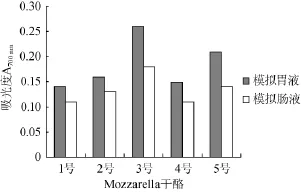
图5 不同Mozzarella干酪12%TCA提取液在模拟胃肠液环境中的还原力Fig.5 Reducing power of soluble extracts from different Mozzarella cheeses by 12%TCA in the simulated gastrointestinal fluid
由图5可知,不同菌种组合Mozzarella干酪的12%TCA提取液在模拟胃肠液中的还原力较水溶性提取液低,在模拟肠液环境下还原力低于模拟胃液环境,可能与抗氧化肽、菌群在肠液不良环境下的降解有关,3号干酪12%TCA提取液在模拟胃肠液中的还原力最高,但差异不显著(P>0.05),可能与12%TCA提取液中较高的多肽含量及其在模拟胃肠液环境中的稳定性有关。
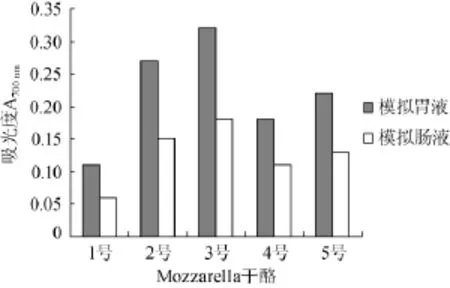
图6 不同干酪pH 4.6醋酸缓冲液提取液在模拟胃肠液环境中的还原力Fig.6 Reducing power of soluble extracts from different Mozzarella cheeses by pH 4.6 acetic acid buffer solution in the simulated gastrointestinal fluid
由图6可知,不同菌种组合Mozzarella干酪的pH 4.6醋酸缓冲液提取液在模拟肠液中的还原力较模拟胃液中有所降低,而2号3号Mozzarella干酪的pH 4.6醋酸缓冲液提取液在模拟胃肠液中还原力高于其他干酪,但差异不显著(P>0.05)。
2.33号Mozzarella干酪提取液模拟胃肠液环境下的多肽含量及乳酸菌数量的测定
由于3号干酪提取液在模拟胃肠液环境下的抗氧化活性较高,而抗氧化活性与提取液中的多肽、乳酸菌数有直接的关系,因而对其提取液中的多肽及乳酸菌数量在模拟胃肠液下的含量进行了测定,结果见表1。
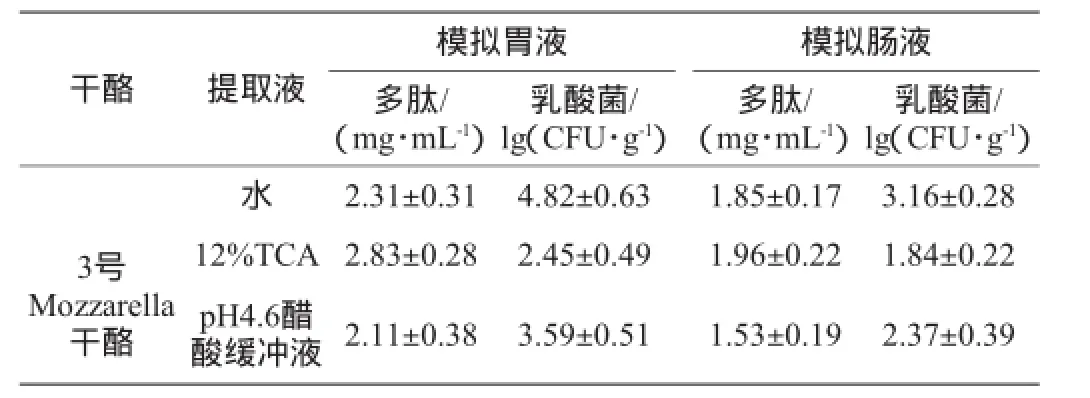
表1 3号Mozzarella干酪提取液模拟胃肠液环境下的多肽含量及乳酸菌数量Table 1 Polypeptide content and lactic acid bacteria colony count of soluble extracts from No.3 Mozzarella cheeses in the simulated gastrointestinal fluid
由表1可知,3号Mozzarella干酪的不同溶剂提取液在模拟胃肠液中的多肽含量不同,12%TCA提取液中的含量最高,pH4.6醋酸缓冲液提取液最低,而乳酸菌数量以水溶性提取液中的最高,12%TCA提取液最低。在模拟肠液环境下多肽含量和乳酸菌数都有一定程度的降低,因而模拟肠液的抗氧化活性较模拟胃液的低,结合前面的抗氧化结果分析,充分说明抗氧化活性的发挥不仅与其中的多肽含量有关而且与提取液中的乳酸菌数量、种类也有关。SAH B N P等[28]发现,添加有干酪乳杆菌(Lactobacillus casei)ATCC 39酸奶发酵粗提液的抗氧化活性大大提高。
不同菌种组合Mozzarella干酪不同提取液的抗氧化活性不同,可能由于不同乳酸菌在代谢过程中形成的一系列胞内外蛋白酶、肽酶活性不同,进而其对干酪中蛋白质的水解程度不同,也可能与不同的菌种产生酶的量以及酶的释放方式与作用方式不同有关,也可能与提取液中成分及菌数有关。尤其在模拟胃肠液不良环境下,各提取液中的肽类、氨基酸、菌数有很大差异。
3 结论
不同菌种组合Mozzarella干酪的不同溶剂提取液在模拟胃肠液的环境下具有一定的抗氧化活性,模拟肠液的抗氧化活性低于模拟胃液环境,水溶性提取液较其他两种提取液在模拟胃液的环境下具有较高的抗氧化活性,3号Mozzarella干酪提取液在模拟胃肠液环境下的抗氧化活性高于其他Mozzarella干酪,在Mozzarella干酪中添加干酪乳杆菌可以提高其对人体的抗氧化作用。
[1]RIZZELO C G,LOSITO I,GOBBETTI M,et al.Antibacterial activities of peptides from water-soluble extracts of Italian cheese varieties[J].J Dairy Sci,2005,88(7):2348-2360.
[2]PRITCHARD S R,PHILLIPS M,KAILASAPATHY K.Identification of bioactive peptides in commercial cheddar cheese[J].Food Res Int,2010, 43(5):1545-1548.
[3]MEIRA S M M,DAROIT D J,HELFER V E,et al.Bioactive peptides in water-soluble extracts of ovine cheeses from southern Brazil and Uruguay [J].Food Res Int,2012,48(1):322-329.
[4]郁晓盼,赵肖蓉,牟光庆.酪蛋白抗氧化肽的制备及初步分离[J].食品科技,2011,36(5):29-31.
[5]毛学英,吴思嘉,范金波,等.牦牛乳酪蛋白酶解产物清除DPPH·自由基活性分析[J].现代食品科技,2007,24(7):624-626.
[6]董晓斌,付丽丽,朴姗善,等.发酵乳清蛋白制取抗氧化肽的研究[J].食品科学,2011,32(S1):172-175.
[7]ABAD A-GARC A L,CARDADOR A,MART N DEL CAMPO S T,et al.Influence of probiotic strains added to cottage cheese on generation of potentially antioxidant peptides,anti-listerial activity,and survival of probiotic microorganisms in simulated gastrointestinal conditions[J].Int Dairy J,2013,33(2):191-197.
[8]RASHIDINEJAD A,BIRCH E J,SUN-WATERHOUSE D,et al.Total phenolic content and antioxidant properties of hard low-fat cheese fortified with catechin as affected byin vitrogastrointestinal digestion[J]. LWT-Food Sci Tech,2015,62(1):393-399.
[9]LIANG L H,WU X Y,ZHAO T,et al.In vitrobioaccessibility and antioxidant activity of anthocyanins from mulberry(Morus atropurpurea Roxb.)following simulated gastrointestinal digestion[J].Food Res Int, 2012,46(1):76-82.
[10]YOU L J,ZHAO M M,REGENSTEIN J M,et al.Changes in the antioxidant activity of loach(Misgurnus anguillicaudatus)protein hydrolysates during a simulated gastrointestinal digestion[J].Food Chem, 2010,120(3):810-816.
[11]刘会平,南庆贤,马长伟.Mozzarella干酪生产工艺的优化[J].中国乳品工业,2003,31(3):3-6.
[12]SENAKA RANADHEERA C,EVANS C A,ADAMS M C,S.K. BAINES.In vitro analysis of gastrointestinal tolerance and intestinal cell adhesion of probiotics in goat's milk ice cream and yogurt[J].Food Res Int,2012,49(2):619-625.
[13]JAOUAD B,LUCIEN H,TORSTEN B.Total phenolics,flavonoids,anthocyanins and antioxidant activity following simulated gastro-intestinal digestion and dialysis of apple varieties:Bioaccessibility and potential uptake[J].Food Chem,2011,128(1):14-21.
[14]LAURA K,JEREMIAH H,SIOBHAN M,et al.The effect of simulated gastrointestinal conditions on the antioxidant activity of herbal preparations made from native Irish hawthorn[J].J Herbal Med,2014,43: 127-133.
[15]吕喜茹,郭亮,常明昌,等.姬松茸多糖抗氧化作用[J].食用菌学报,2010,17(1):69-71.
[16]王辉.绞股蓝乙酸乙酯提取物有效成分的分离及生物活性研究[D].晋中:山西农业大学,2010.
[17]YAMAGUCHI T,TAKAMURA H,MATOBA T A,et al.HPLC method for evaluation of the free radical-scavenging activity of foods by using 1,1-diphenyl-2-picrylhydrazyl[J].Biosci Biotechnol Biochem, 1998,62(6):1201-1204.
[18]FARVIN K H S,BARON C P,NIELSEN N S,et al.Antioxidant activity of yoghurt peptides:Part 2-Characterisation of peptide fractions[J]. Food Chem,2010,123(4):1090-1097.
[19]GUPTAN A,MANN B,KUMA RUMAR R,et al.Antioxidant activity of cheddar cheeses at different stages of ripening[J].Int J Dairy Tech, 2009,62(3):339-347.
[20]SAKANAKAS,TACHIBANAY,ISHIHARAN,etal.Antioxidant properties of casein calcium peptides and their effects on lipid oxidation in beef homogenates[J].J Agr Food Chem,2005,53(2):464-468.
[21]鲁伟,任国谱,宋俊梅.蛋白水解液中多肽含量的测定方法[J].食品科学,2005,26(7):169-171.
[22]LOWRY,O.H.,ROSEBROUGH,N.J.,FARR,A.L.,et al.Protein measurement with the Folin phenol reagent[J].J Biolog Chem,1951,193 (1):265-275.
[23]李影林.培养基手册[M].长春:吉林科学技术出版社,1991:476-478.
[24]苏世彦.食品微生物检验手册[M].北京:中国轻工业出版社,1998:61-64.
[25]LI S Y,ZHAO Y J,ZHANG L,et al.Antioxidant activity ofLactobacillus plantarumstrains isolated traditional Chinese fermented foods[J]. Food Chem,2012,135(3):1914-1919.
[26]FARVIN K H S,BARON C P,NIELSEN N S,et al.Antioxidant activity of yoghurt peptides:Part 2-characterisation of peptide fractions[J]. Food Chem,2010,123(4):1090-1097.
[27]GARC A-RUIZ A,DOLORES G D L,ESTEBAN-FEMÁNDEZ A.Assessment of probiotic properties in lactic acid bacteria isolated from wine[J].Food Microbiol,2014,44(6):220-225.
[28]SAH B N P,VASILJEVIC T,MCKECHNIE S,et al.Effect of probiotics on antioxidant and antimutagenic activities of crude peptide extract from yogurt[J].Food Chem,2014,156(8):264-270.
Antioxidant activity of soluble extracts from Mozzarella cheese in simulated gastrointestinal fluid
ZHAO Yuming1,MA Ling2,XIE Haijun1*
(1.Biology Institute of Shanxi,Taiyuan 030006,China; 2.College of Food Science and Technology,Shanxi Agricultural University,Taigu 030801,China)
In order to evaluate the antioxidant activity of bioactive peptide and viable starter cultures from cheese during ripening process on human body,the DPPH free radical scavenging rate and reduce power of soluble extracts from the Mozzarella cheese with various strains by distilled water, pH 4.6 acetic acid buffer solution and 12%trichloroacetic acid(TCA)in the simulated gastrointestinal fluid were determined.The results showed that the soluble extracts from the Mozzarella cheese with various strains by the different solvents had a certain antioxidant activity in the simulated gastrointestinal fluid,and the antioxidant activity in the simulated intestinal fluid was much lower than that in simulated gastric fluid.The antioxidant activity was up to 88.35%.The antioxidant activity of soluble extracts from No.3 Mozzarella cheese addingLactobacillus casei)LPC-37 in the simulated gastrointestinal fluid was higher than that of other Mozzarella cheese.The DPPH free radical clearance rate of soluble extracts by distilled water, pH 4.6 acetic acid buffer solution and 12%TCA in the simulated gastrointestinal fluid were 73.96%,30.28%and 70.27%,respectively,and the reduce power were 0.37,0.18 and 0.18,respectively.
Mozzarella cheese;starter culture;simulated gastrointestinal fluid;antioxidant activity
TS252.1
0254-5071(2016)10-0107-05
10.11882/j.issn.0254-5071.2016.10.024
2016-08-23
山西省科技攻关项目(20090321107)
赵玉明(1965-),男,副研究员,本科,研究方向为生物技术、食品加工。
谢海军(1962-),男,副研究员,硕士,研究方向为食品加工。

