新疆吐鲁番地区耐热真菌多样性及其功能酶的筛选
殷亚兰,常玮,张涛 ,林青,晁群芳,李春,霍向东
( 1. 新疆大学生命科学与技术学院,乌鲁木齐 830046; 2. 新疆农业科学院微生物应用研究所,乌鲁木齐 830091;3. 北京理工大学生命学院,北京 100081)
新疆吐鲁番地区耐热真菌多样性及其功能酶的筛选
殷亚兰1,2,常玮2,张涛2,林青2,晁群芳1,李春3,霍向东2
( 1. 新疆大学生命科学与技术学院,乌鲁木齐 830046; 2. 新疆农业科学院微生物应用研究所,乌鲁木齐 830091;3. 北京理工大学生命学院,北京 100081)
【目的】了解新疆吐鲁番地区耐热真菌多样性,并对其产酶活性进行研究。【方法】利用平板涂布法从12份土壤样品中分离耐热真菌,基于形态学和18S rDNA基因序列同源性研究耐热真菌多样性;利用6种筛选培养基对分离到的菌株进行产酶活性筛选。【结果】分离得到129株耐热真菌,形态学观察和18S rDNA序列分析表明,这些真菌归于11个属,其中曲霉属(Aspergillus)和裸胞壳属(Emericella)为优势菌群。产酶活性研究表明,13株产糖苷酶,13株产淀粉酶,11 株产维素酶,16 株产木聚糖酶,8株产蛋白酶,10株产脂肪酶,16株产木聚糖酶。【结论】新疆吐鲁番地区耐热真菌资源丰富,产酶种类多样,为开发利用这一类群真菌资源奠定了基础。
耐热真菌;多样性;功能酶
0 引 言
【研究意义】耐热真菌(thermotolerantfungi)是一类最高生长温度在50℃左右(通常为40℃或以上),最低生长温度在20℃以下的特殊真菌类群[1],在高温条件下表现出独特的生存适应能力。吐鲁番地区地处欧亚大陆腹地,由于地势低洼,增温快、散热慢、冷湿空气不易进入,形成了极端干旱的温带内陆荒漠气候,其主要特点是:热量丰富、极端干燥、高温多风、降雨稀少、蒸发强烈、无霜期长、风大风多。全年日照时数2 957.7~3 122.8 h,平均气温13.35℃,35℃ 以上气温可持续165 d,40℃以上高温可达106 d。日温差和年温差均较大,高于10℃年积温为4 525.5~5 733℃[2]。夏季中午地表温度一般在70℃以上,最高曾达到82.3℃[3]。特殊的自然环境为耐热微生物的生长繁殖创造了条件。耐热微生物已成为国际研究的热门领域,日本、美国和欧洲一些国家都启动了耐热微生物研究计划。揭示高温生命形式的奥秘和利用其特殊代谢机制与特殊产物方面的竞争已成为国际趋势。人们对高温生命形式奥秘的揭示,也有可能提供与全球气候变暖进程相关的信息[4]。【前人研究进展】目前,世界上描述和报道的耐热真菌有89种,它们分属于真菌中的接合菌、子囊菌、担子菌、半知菌[5-6]。而我国耐热真菌研究比较薄弱。《中国真菌总汇》中仅收集了此类真菌16种[7],《中国菌种目录》中记载了19种[8],Chen & Zheng[9]报道中国耐热真菌新种1个,张勇、梁茵等[10-12]报道中国耐热真菌新记录种10个。【本研究切入点】目前对耐热真菌多样性的研究较少。研究利用纯培养方法对采自吐鲁番地区的12个土样进行耐热真菌分离,18S rRNA基因序列同源性分析及产酶活性检测。【拟解决的关键问题】研究吐鲁番地区耐热真菌的资源及多样性,为耐热真菌资源的收集、保护、开发利用以及分类专著性研究奠定基础。
1 材料与方法
1.1 材 料
1.1.1 土壤样品
从新疆吐鲁番地区采集得到12份土壤样品,采集后放入无菌50 mL 离心管内,4℃冷藏备用。表1
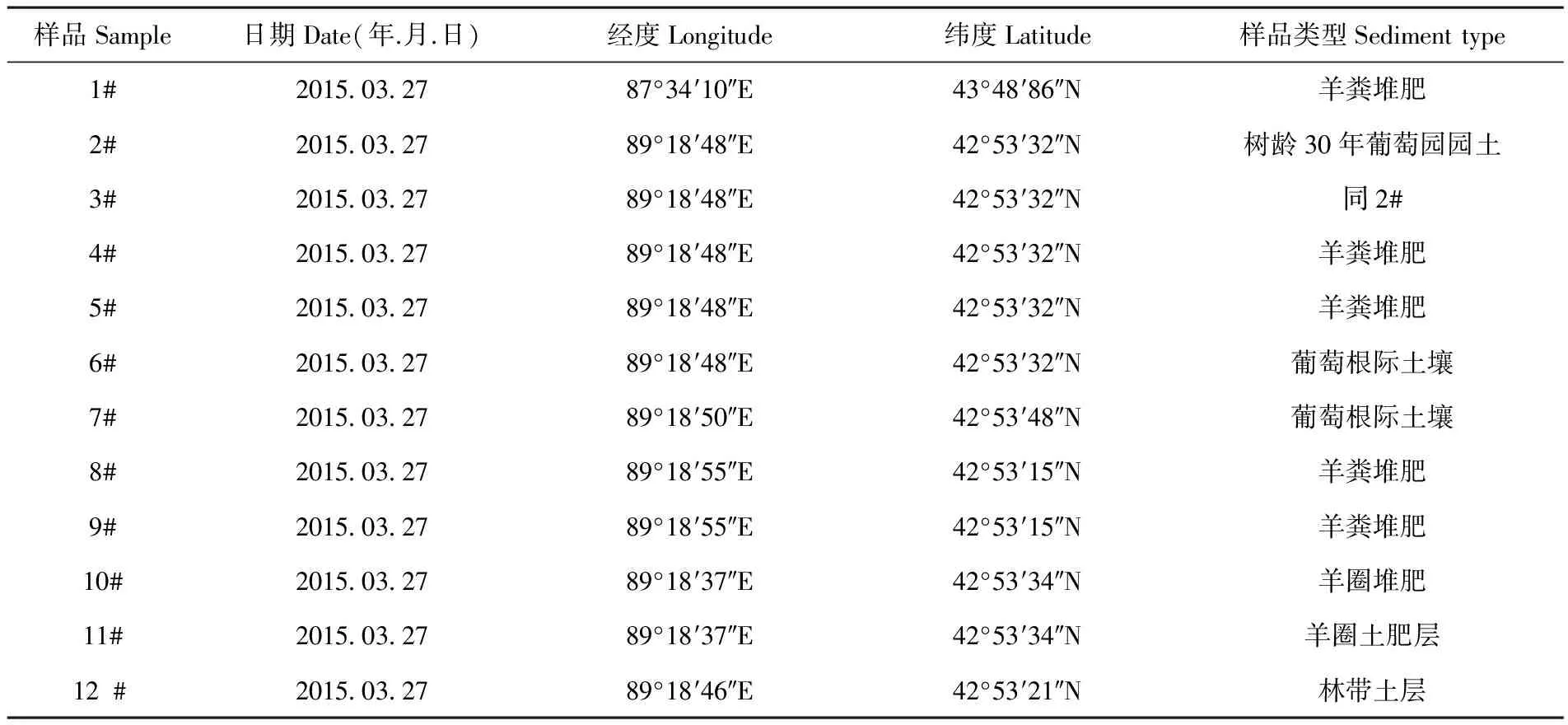
表1 吐鲁番土壤样品采集基本情况
1.1.2 培养基
1.1.2.1 分离培养基
①PDA培养基(g/L):马铃薯 200.0,葡萄糖 20.0,琼脂 20.0,H2O 1 000 mL,pH 6.5。
②孟加拉红培养基(Rose Bengal)(g/L):蛋白胨5.0,葡萄糖10.0, KH2PO41.0,MgSO4·7H2O 0.5,孟加拉红 0.033,氯霉素0.1,琼脂20.0。
1.1.2.2 产酶筛选培养基
①淀粉酶筛选培养基(g/L)[13]:可溶性淀粉 20.0,KCl 0.5,NaNO32.0,K3PO41.0,MgSO4·7H2O 0.5,琼脂 18.0,H2O 1 000 mL,pH 自然。
②纤维素酶筛选培养基(g/L)(参考文献[14]并稍微改动):CMC 0.8%,NaNO30.3%,KCl 0.05%,K2HPO40.1%,FeSO40.001%,MgSO4·7H2O 0.05%,琼脂 2%,氯霉素 0.005%,H2O 1 000 mL,pH 6.0。
③蛋白酶筛选培养基(g/L)[15]:蛋白胨 10.0,葡萄糖 1.0,CaCl20.1,酪氨酸 0.1,酪素 5.0,琼脂 22.0,H2O 1 000 mL,pH 7.0。
④木聚糖酶筛选培养基(g/L)[16]:木聚糖 1%,NaNO30.2%,KH2PO40.2%, K2HPO40.1%,NaCl 0.05%, MgSO4·7H2O 0.05%,琼脂 2%,pH值自然。
⑤糖苷酶筛选培养基(g/L)[17]:乳糖10,NaNO33,K2HPO41, KCl 0.5, MgSO40.5,FeSO40.01,琼脂 15,pH自然。
⑥脂肪酶筛选培养基(g/L)[18]:酵母膏 10,Na2HPO41g ,KH2PO41.5,Mg SO4·7H2O 0.5,(NH4)2SO45,NaCl20.5,三丁酸甘油酯乳化液,去氧胆酸钠1,琼脂 18。
1.1.3 主要仪器和设备
高速冷冻离心机,DYY-III型电泳仪、电泳槽(北京市六一仪器厂),凝胶成像分析系统(Bio-Rad),PCR扩增仪(Biometra TProfessional Trio)。
1.2 方 法
1.2.1 样品处理
将采集的土样、腐殖质等各种样品磨碎进行充分混合后,称取10 g,加入盛有90 mL灭菌水的三角瓶中,将三角瓶置于摇床上150 r/m,振荡2 h,使土壤颗粒均匀分散,备用。
1.2.2 菌株分离
采用平板涂布法对12份样品进行分离,分别取200 μL土壤悬浮液涂布在分离培养基上,置于40℃培养3~8 d,将平板上生长的不同形态的菌落进行分离与纯化。得到的纯菌株切取小块,转移到新的培养基中,19℃培养箱培养3 d以上,生长菌株确定为耐热真菌。4℃保藏备用。
1.2.3 菌株的分类鉴定
采用形态学及分子生物学相结合的方法进行初步鉴定。根据菌落特征、菌丝、孢子及产孢结构等进行形态学鉴定。挑取不同形态类群用真菌基因组提取试剂盒(OMEGA HP Fungal DNA Kit)提取基因组 DNA,PCR扩增 18S rDNA 基因片段,采用真菌通用引物:NS1(5'-GTAGTCATATGCTTGTCTC-3')和 NS8(5'-TCCGCAGGTTCACCTACGGA-3')。PCR 反应体积为30.0 μL 体系:2 × PCR Mix 试剂 15.0 μL(由TaKaRa公司提供),引物NS1和NS8(由上海生工合成)各0.5 μL,模板 1.0 μL,用dd H2O使总体积达到30 μL。PCR扩增反应条件: 94℃ 10 min;94℃ 30s、54℃ 30s、72℃ 2 min,37个循环;72℃ 10 min。凝胶电泳检测扩增产物,并送至上海生工生物工程有限公司测序。将所测序列提交Gen Bank数据库并进行Blast检索下载同源性较高的数据,用Clustal W对所得序列进行人工校正及比对分析,利用 Mega5.02生成Fasta格式的文件,按照邻接法聚类(选择bootstrap检验值≥50%,1 000次重复)构建 N-J系统发育树。
1.2.4 菌株产酶活性
将纯化后的单菌落点接于上述的酶筛选培养基,40℃恒温培养3~7 d。待菌株生长良好时,测量不同菌株的透明圈直径和菌落直径,以透明圈直径与菌落直径的差值(D) 表示酶活大小,D值越大,表明酶活越强。
2 结果与分析
2.1 耐热真菌的分离
利用2种分离培养基从吐鲁番土壤样品中得到129株耐热真菌,共计20个形态类群。其中优势菌株是P5-3-5和P2-2-3,其分离频率分别为24.81%和18.60% ,而分离频率最低的菌株为M7-2-1、M6-2-7、MP13-3-1、M9-3-4、P9-2-6、P5-3-2,分离频率均为0.78%。12个吐鲁番土壤样品分离得到真菌的比例依次是4.65%(6株)、14.73% (19株)、3.88% (5株)、10.85 % (14株)、21.71% ( 28株)、5.43% (7株)、8.53% (11株)、3.10% (4株)、20.16% (26株)、0.78 % (1株)、3.10 % (4株)、3.10% (4株)。其中,5号样分离出的真菌数最多,10号样分离出的真菌最少。图1
A: 菌株P5-3-5; B: 菌株 M5-3-10; C: 菌株P3-2-2; D: 菌株M7-2-9; E: 菌株 P5-3-2
2.2 耐热真菌的多样性
将已纯化的20株耐热真菌各1株接种在PDA培养基上,观察菌株的形态特征并进行18S rDNA序列分析,初步确定真菌的分类地位。结果表明,20株真菌分属于3个纲。其中,粪壳菌纲(Sordariomycetes)包含6个形态类群,占30%,散囊菌纲(Eurotiomycetes) 12个,占60% ,座囊菌纲 (Dothideomycetes) 2个,占10%。这些菌株归类于11个属,其中,曲霉属(Aspergillus)和裸胞壳属(Emericella)为优势菌群,分别占总分离菌数的55.04%和30.23%;帚霉属(Scopulariopsis)、樟绒枝霉(Malebranche) 均占2.33%;毛壳菌属(Chaetomium)、嗜热真菌属(Thermomyces)、木霉属(Trichoderma)、假霉样真菌属 (Pseudallescheria)、链格孢属 (Alternaria)和小裸囊菌属(Gymnascella)均占1.55%;青霉属(Penicillium)占0.78%。表2
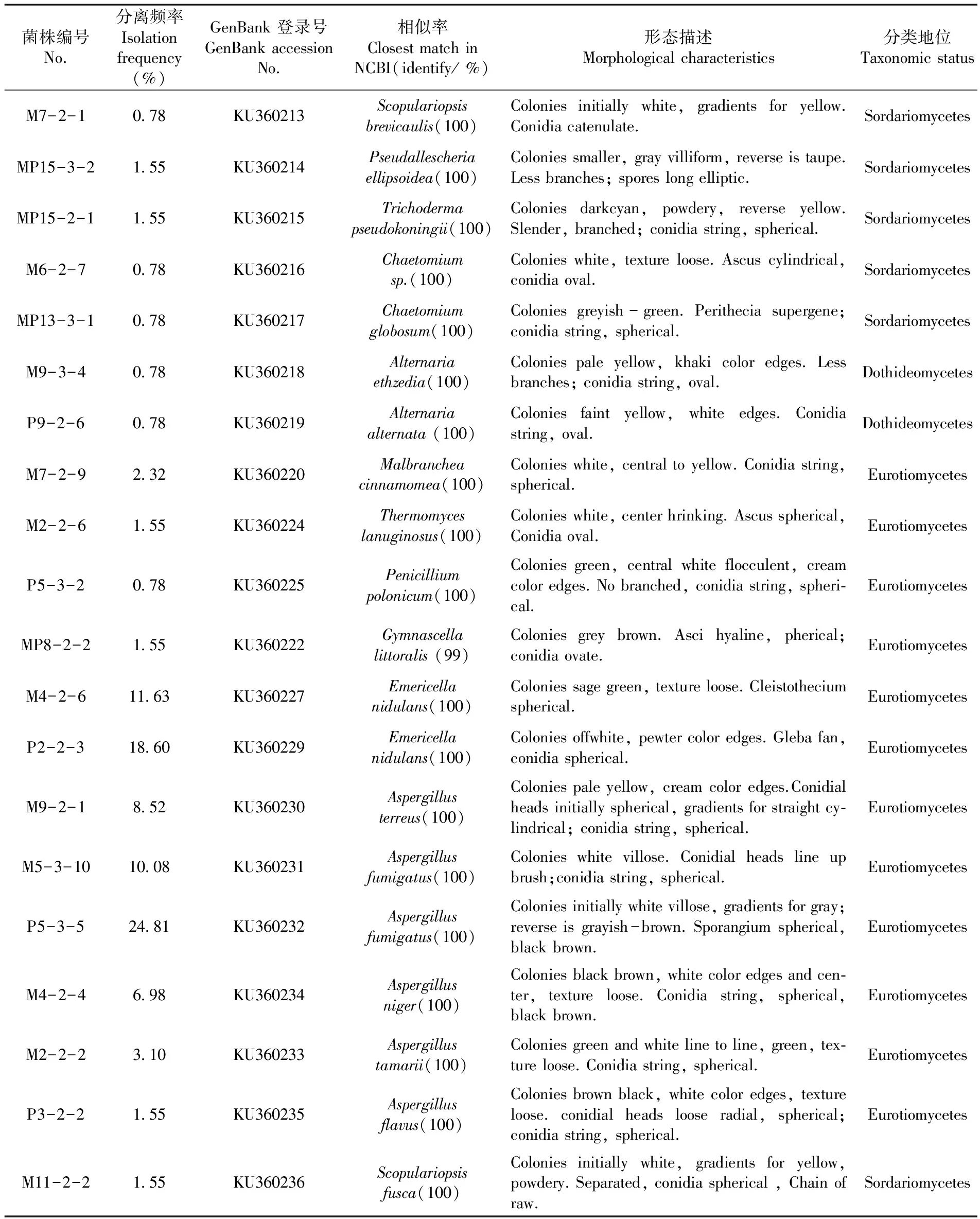
表2 20株耐热真菌的形态特征及分类学地位
通过PCR扩增18S rDNA 基因片段,对所测序列用ClustalW 比对后构建邻接(N-J)树。分离到的耐热真菌明显分为三大类,分别为散囊菌纲、座囊菌纲、粪壳菌纲。20个形态类群隶属于5个目8个科11个属。图2
2.3 培养基分离效果比较
研究表明,孟加拉红培养基共分离到88株耐热真菌,分布在10个属,共计18个形态类群;PDA培养基分离到41株菌,分布在4个属,共计10个形态类群。由此可看出,孟加拉红培养基分离得到的耐热真菌菌株和形态类群最多,分离效果最好。表3

表3 2种培养基分离的耐热真菌菌株数及种属分布

图2 基于18S rDNA序列采用N-J法构建的耐热真菌系统发育树
2.4 菌株产酶活性研究
对129株菌进行产酶活性初筛。研究表明,产酶菌株共有24株。13株产糖苷酶,13株产淀粉酶,11株产维素酶,16株产木聚糖酶,9株产蛋白酶,11株产脂肪酶,16株产木聚糖酶。其中,菌株M9-2-5、P7-2-1可产5种酶。菌株M9-2-1产纤维素酶和木聚糖酶的活性相对较高;菌株M7-2-4具有较高的淀粉酶活性;菌株 M9-2-9具有较高的淀粉酶活性和蛋白酶活性;脂肪酶活性普遍较低,其水解圈直径都在0~5 mm。表4
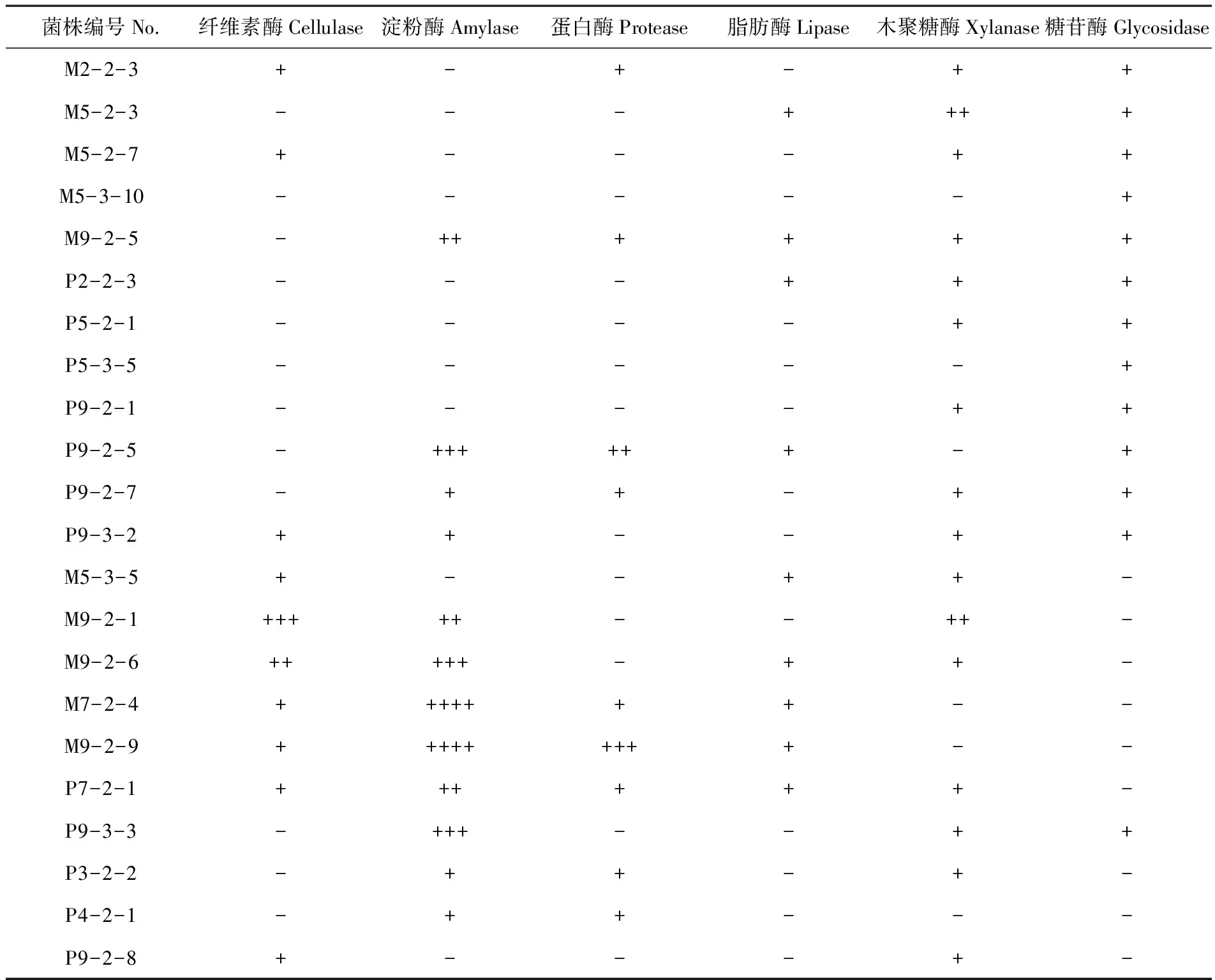
表4 新疆吐鲁番地区耐热真菌产酶特性
注:“ + + + + + ”表示透明圈D值为20~25 mm;“ + + + + ”表示D值为15~20 mm;“ + + + ”表示D值为10~15 mm;“ + +”表示D值为5~10 mm;“ +”表示D值为0~5 mm;“-”表示不产生透明圈。其中糖苷酶筛选中“+”表示结果为阳性,“-”为阴性
Note:“ + + + + + ”: 20-25 mm; “ + + + + ”: 15-20 mm; “ + + +”: 10-15 mm;“ + +”: 5-10 mm;“ + ”: 0-5 mm;“-”: No transparent circle.Glycosidase: “-” :negative; “ + ”:positive
3 讨 论
高温真菌是微生物中重要的一个类群,在有机物质的生物转化和物质循环中的作用是难以估量的。近年来中国微生物学者开展了高温真菌的分类研究。赵春青[19]利用PDA及其他4种分离培养基从400多份样品中分离出嗜热真菌17种,耐热真菌4种。张勇[20]利用PDA培养基从800多份样品中分离出耐热真菌25属51种。研究从新疆吐鲁番地区采集的12份土壤样品中分离得到129株耐热真菌,共20个形态类群。其中孟加拉红培养基分离出88株耐热真菌(分布在10个属),表明孟加拉红培养基也适合于高温真菌的分离,且分离效果良好。经形态学研究和18S rDNA序列分析分析表明,吐鲁番地区土壤样品中的耐热真菌物种多样性较为丰富,归类于11个属,曲霉属(Aspergillus)和裸胞壳属(Emericella)为优势菌群,分别占55.04%和30.23%,但有些种属在中国耐热真菌中未见报道,Malbranchea、Alternaria两个属的菌株在国内首次报道为耐热真菌,菌株M9-3-4、P9-2-6、M7-2-9可能为潜在的中国新记录种。这些发现丰富了我国耐热真菌多样性的内容,值得进行更深入的研究。
高温真菌所产生的热稳定、高活性酶及其他代谢产物都很有实用价值。傅力等[21]选育出高产蛋白酶的米曲霉AspergillusOryzae突变菌株UF366, 在pH 7.2、40℃时其蛋白酶活力最高,是一株有应用前景的酱油生产菌株。周亚飞等[22]分离到耐酸(最适pH为4.5)和耐高温 (最高达60℃)的具有降解棉秸秆纤维素功能的真菌菌株Z2,该菌株在秸秆生物质利用方面有很大的应用潜力。Peixoto等[23]从分离自土壤的小孢根霉须状变种Rhizopusmicrosporusvar.rhizopodiformis中分离到热稳定性的淀粉酶,该酶在45℃下表现出高活性。Kitpreechavanich等[24]分离到米根霉Rhizopusoryzae,其产生的葡糖糖化酶可将淀粉降解为L-乳酸,且在40℃具有高活性,适合工业上生产乳酸。研究中功能酶筛选结果表明,产酶菌株共有24株。13株产糖苷酶,13株产淀粉酶,11株产纤维素酶,16株产木聚糖酶,9株产蛋白酶,11株产脂肪酶,16株产木聚糖酶,部分菌株可产多种酶活。其中,菌株M9-2-5、P7-2-1可产5种酶。极个别菌株具有较强的酶活。这些菌株为进一步开发和利用功能酶提供了良好的研究材料,有待进一步的开发和挖掘。
4 结 论
从新疆吐鲁番地区采集12份土壤样品,分离鉴定耐热真菌11属20种。其中曲霉属(Aspergillus)和裸胞壳属(Emericella)为优势菌群,分别占总分离菌数的55.04%和30.23%,少数菌株具有产高温条件下热稳定、高活性酶的潜力,新疆吐鲁番地区耐热真菌资源丰富,产酶种类多样,为开发利用这一类群真菌资源奠定了基础。
References)
[1] Cooney, D. G., & Emerson, R. (1964). Thermophilic fungi:an account of their biology,Activities,andclassification. , 6(2):292.
[2] 冶永新, 杜丽娟, 张宝忠, 等. 吐鲁番及周边地区气候及径流演变特征分析[J].水资源与水工程学报,2014,25(6):61-67.
YE Yong-xin, DU Li-juan, ZHANG Bao-zhong, et al. (2014). Analysis on feature of climate and runoff evolution inTurpan and its surrounding areas [J].JournalofWaterResourcesandWaterEngineering, 25(6):61-67.(in Chinese)
[3] 袁军."火洲"-吐鲁番[J].地理教育,2002,(5):31.
YUAN Jun.( 2002). "Huozhou" - Turpan [J].GeographicalEducation, (5):31.(in chinese)
[4] O'Neill, B. C., & Oppenheimer, M. (2002). Dangerous climate impacts and the kyoto protocol.Science, 296(5575):1,971-1,972.
[5] Mouchacca, J. (2000). Thermotolerant fungi erroneously reported in applied research work as possessing thermophilic attributes.WorldJournalofMicrobiology&Biotechnology, 16(8-9): 869-880.
[6] Mouchacca, J. (2007). Heat tolerant fungi and applied research: addition to the previously treated group of strictly thermotolerant species.WorldJournalofMicrobiology&Biotechnology,23(12):1,755-1,770.
[7] 戴芳澜. 中国真菌总汇[M].北京:北京科学出版社, 1979.
NAI Fang-lan. (1979).Syllogefungorumsinicorum[M].Beijing: Science Press.(in chinese)
[8] 周宇光. 中国菌种目录[M].北京:化学工业出版社, 2007.
ZHOU Yu-guang. (2007).Chinacatalogueofcultures[M]. Beijing: Chemical Industry Press. (in Chinese)
[9] Chen, G. Q., & Zheng, R. Y. (1999). A new thermophilic variety of absidia idahoensis from China.Mycotaxon, (69):173-179.
[10] 张勇, 李多川. 中国耐热真菌三个新记录种[J].菌物学报, 2011,30 (1):116-122.
ZHANG Yong, Li Duo-chuan. (2011). Three new records of thermotolerant fungi from China [J].Mycosystema, 30(1):16-122. (in Chinese)
[11] 梁茵, 王芳, 李安娜, 等. 耐热真菌的分类鉴定及rDNA-ITS系统发育分析[J].菌物学报,2011,30(4):542-550.
LIANG Yin, WANG Fang, LI An-na, et al.(2011). Thermotolerant fungi and their phylogenetic analyses based on rDNA-ITS sequences [J].Mycosystema, 30(4):542-550. (in Chinese)
[12] 张勇, 李多川. 中国耐热真菌五个新记录种[J].菌物学报,2013,32(1):142-149.
ZHANG Yong, LI Duo-chuan. (2013). Five new records of thermotolerant fungi from China [J].Mycosystema, 32(1):142-149. (in Chinese)
[13] 周茂洪, 肖为, 周林, 等. 产淀粉酶的海洋曲霉菌的分离及酶学特性初步研究[J].海洋学研究, 2007,25(3):59-65.
ZHOU Mao-hong,Xiao-Wei,ZHOU Lin,et al. (2007). Screening of amylase-excreting marine Aspergillus sp.Andpreliminary studies on the characteristics of the amylases [J].JournalofMarineSciences,25(3):59-65. ( in Chinese)
[14] 蒋琼凤,张金金,周斌, 等. 一株产纤维素酶真菌的筛选和诱变[J].湖南农业科学, 2010,(11):24-27.
JIANG Qiong-feng,ZHANG Jin-jin, ZHOU Bin, et al. (2011). Screening and Mutation of a Strain of Cellulase-producing Fungus [J].HunanAgriculturalSciences, (11):24-27. (in Chinese)
[15] 廉立慧, 高丽君, 王德才, 等. 高温蛋白酶产生菌的筛选及其产酶条件和酶学性质分析[J].生物技术通报, 2011,(3):175-179.
LIAN Li-hui, GAO Li-jun, WANG De-cai, et al. (2011). Screening of thermostable protease-producing bacterium and analysis of fermentation conditions and protease properties [J].BiotechnologyBulletin, (3):175-179. ( in Chinese)
[16] 郄卫那, 张兰英, 何健, 等. 1株饲用木聚糖酶产生菌的分离、鉴定、发酵、酶学性质及应用[J].江苏农业科学, 2014,42(10):196-200.
QIE Wei-na, ZHANG Lan-ying, HE Jian,et al.(2014). Isolation, identification, fermentation, enzymatic, properties, and application of an xylanasc-producing strain for feed [J].JiangsuAgriculturalSciences, 42(10):196-200.( in Chinese)
[17] 李德荣, 郑海艳, 谢庆武. β-半乳糖苷酶产生真菌的筛选及酶学性质研究[J].广西轻工业,2010,(5):3-5.
LI De-rong, ZHENG Hai-yan, XIE Qing-wu. (2010). Beta - galactose glucoside enzyme screening of fungi and enzymology properties [J].GuangxiJournalofLightIndustry, (5):3-5. (in Chinese)
[18] 王斌. 脂肪酶高产菌的筛选及酶学性质和发酵条件研究[D].四川师范大学硕士学位论文, 2011.
WANG Bin. (2011).Screeningoflipase-producingstrainsandstudyingonpropertiesoflipaseandfermentingconditions[D]. Master Dissertation. Sichuan normal university, Chengdou. (in Chinese)
[19] 赵春青.中国嗜热真菌分类研究[D]. 山东农业大学研究生学位论文, 2006.
Zhao Chun-qing.(2006).TaxaonomicstudiesonthethermophilicfungifromChina[D]. Shandong agricultural university graduate dissertation. (in Chinese)
[20] 张勇. 耐热真菌多样性及分子系统学研究[D].泰安:山东农业大学研究生学位论文博士论文,2012.
ZHANG Yong. (2012).Thermotolerantfungidiversityandmolecularphylogeny[D]. PhD Dissertation. Shandong agricultural university,Tai'an. (in Chinese)
[21] 傅力, 章运, 涂振东, 等. 米曲霉高产蛋白酶菌株的选育及在酱油酿造中的应用研究[J].新疆农业科学,2009,46(6):1 274-1 278.
FU Li, ZHANG Yun, TU Zhen-dong, et al. (2009). A Study on Screening of High Productive Proteinase Strain of Aspergillus Oryzae and Its Application in Soy Sauce Brewing [J].XinjiangAgriculturalSciences, 46(6):1,274-1,278. (in Chinese)
[22] 周亚飞,詹发强,侯新强,等. 棉秸秆降解高温菌株的筛选及产酶分析[J].微生物学通报, 2011,38(2):206-213.
ZHOU Ya-Fei, ZHAN Fa-Qiang, HOU Xin-Qiang, et al. (2011). Isolation and characterization of four cellulose-decomposing thermophilic fungal strains from Xinjiang [J].MicrobiologyChina,38(2):206-213. (in Chinese)
[23] Peixoto, S. C., Jorge, J. A., Terenzi, H. F., & Polizeli, M. D. L. T. M. (2003). Rhizopus microsporus, var. rhizopodiformis : a thermotolerant fungus with potential for production of thermostable amylases.InternationalMicrobiology, 6(4):269-273.
[24] Kitpreechavanich, V., Maneeboon, T., Kayano, Y., & Sakai, K. (2009). Comparative characterization of l -lactic acid-producing thermotolerant rhizopus, fungi.JournalofBioscience&Bioengineering, 106(6):541-546.
Fund project:Supported by the Special Funds for key laboratory of the Xinjiang Uygur Autonomous Region "Biodiversity and enzyme screening of thermotolerant fungi from Xinjiang special environment" )(2014KL003) ; The National Natural Science Foundation of China "Study on Xinjiang metagenomic library construction of rumen microbes in Bactrian camel and cellulase system" (31160027)
Thermotolerant Fungi Diversity and Enzyme Activities in Turpan Prefecture, Xinjiang
YIN Ya-lan1,2, CHANG Wei2, ZHANG Tao2, LIN Qing2, CHAO Qun-fang1,LI Chun3, HUO Xiang-dong2
(1. College of Life Science and Technology, Xinjiang University, Urumqi 830046, China;2.ResearchInstituteofMicrobiology,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China;3.SchoolofLifeScienceandTechnology,BeijingInstituteofTechnology,Beijing100081,China)
【Objective】 This research aims to study species diversity and enzyme activities of the thermotolerant fungi isolated from Turpan area of Xinjiang.【Method】Total 12 soil samples were collected from Turpan areaof Xinjiang. Thermotolerant fungi were isolated using dilution-plate method. The diversity was analyzed based on morphology and 18S rDNA sequences. Enzyme activities were detected using six special selective media.【Result】A totals of 129 strains of thermotolerant fungi were isolated. The analysis of morphology and 18S rDNA sequence showed that these strains were distributed within 11 described genera, of whichAspergillussp. andEmericellasp.were the dominant populations. Studies on enzyme activities of the isolated strains showed that 13 strains produced glycosidase, 13 strains produced amylase, 11 strains produced cellulose, 16 strains produced xylanase, 8 strains produced protease, 10 strains produced lipase, 16 strains produced xylanase.【Conclusion】The thermotolerant fungi were abundant in soils in Turpan area of Xinjiang and can produce various enzymes. This research has laid the foundation for the development and utilization of this fungus resource.
thermotolerant fungi; diversity; enzyme activities
10.6048/j.issn.1001-4330.2016.07.016
2016-02-04
新疆维吾尔自治区重点实验室专项资金资助项目“新疆特殊环境耐热真菌多样性及其功能酶筛选”(2014KL003) ;国家自然科学基金项目“新疆双峰驼瘤胃微生物宏基因组文库构建和纤维素酶系的研究”(31160027)
殷亚兰(1989-),女,河南人,硕士研究生,研究方向为环境与资源微生物,(E-mail) yinyalan6807@163.com
霍向东(1974-),男,甘肃人,副研究员,研究方向为微生物资源,(E-mail)xiangdonghuo@163.com
S182
A
1001-4330(2016)07-1288-09

