苜蓿根腐病多种病原菌的分子检测
魏然,郭庆元,白剑宇, 张山河
(新疆农业大学农学院,乌鲁木齐 830052)
苜蓿根腐病多种病原菌的分子检测
魏然,郭庆元,白剑宇, 张山河
(新疆农业大学农学院,乌鲁木齐 830052)
【目的】研究苜蓿根腐病病原菌种类和各种病原菌在病株中的出现频率,以及单一病株受到多种病原菌复合侵染的情况,并为该病复合侵染规律及防治奠定基础。【方法】利用已报道的7种病原菌的7对特异性引物,分别对新疆北疆主要苜蓿种植区采集的根腐病混合病样,及单一重病田分单株采集的根腐病病样进行PCR检测。【结果】新疆北疆主要苜蓿种植区根腐病病样中可检出的根腐病病原种类主要有5种镰刀菌和1种丝核菌;其中,立枯丝核菌、木贼镰刀菌、锐顶镰刀菌、茄腐镰刀菌、尖孢镰刀菌5种病原菌在病株样品中普遍存在,是新疆北疆部分地区苜蓿根腐的主要病原菌;侵染根部的病原菌中以尖孢镰刀菌、锐顶镰刀菌和立枯丝核菌为优势种群,侵染茎基部病原菌中以茄腐镰刀菌和木贼镰刀菌为优势种群。检测结果还表明苜蓿根腐病病样中两种及两种以上病原菌复合侵染的的比率达到83%。【结论】木贼镰刀菌、锐顶镰刀菌、茄腐镰刀菌、尖孢镰刀菌和立枯丝核菌是新疆北疆部分地区苜蓿根腐病的主要病原菌,拟知孢镰刀菌是出现频率较低的次要病原菌;根部病斑与茎基部病斑中优势病原菌种类有所不同;田间病株中多病原复合侵染的情况非常普遍。
苜蓿;根腐病;镰刀菌;立枯丝核菌;PCR检测
0 引 言
【研究意义】苜蓿是世界上种植面积最广、最重要的一种多年生豆科牧草。随着苜蓿种植面积的进一步扩大及管理和收割方式的改变,病害问题已经极大的限制了苜蓿的生产[1]。我国苜蓿主要产区西北、东北和华北都存在较严重的苜蓿病害。据不完全统计,全国的苜蓿病害大约有90种,新疆苜蓿病害大约有25种[2]。其中,根腐病是一种常年发生,年年累积且很难防控的严重病害,尤其在5年生以上的苜蓿田中发生严重,甚至不得不毁田改种。根据已有的经验和研究观察与调查,种植密度大、整地不平、积水及收割机的碾压是根腐病发生的重要原因。苜蓿在大田生产中一次种植可多年利用,但由于其利用年限较长,根腐病己成为引起苜蓿产量下降和植株衰败的一个极其重要的原因[3-4]。因此,苜蓿根腐病的研究对苜蓿产业的开发和生态环境的建设具有重大意义。【前人研究进展】南志标等[3](1991)对新疆阿勒泰紫花苜蓿种植区的苜蓿根部病害进行了调査,结果表明了苜蓿的根茎和根腐综合症发生频率很高,几乎年年均有发生。据陈耀等[5]报道,苜蓿根腐病不仅降低了苜蓿的产量和品质,甚至使其丧失了加工利用的价值[5-6]。赵宗峰等[7]对新疆呼图壁县种用苜蓿根部病害进行了调查、对相关致病菌进行了分离和致病性鉴定,查明了种用苜蓿的真菌病害病原种类;并对种用苜蓿根腐病病原菌进行了形态鉴定和分子鉴定,初步明确了新疆部分地区苜蓿根腐病的病原菌种类。【本研究切入点】目前针对蓿根腐病的病原、危害性及苜蓿的品种抗性评价和抗性利用的研究较多,而针对该病的多病原复合侵染规律的研究鲜有报道。研究利用已报道的新疆苜蓿根腐病7种病原菌的七对特异性引物[7]对所采集的多病田混合样品和单一重病田分株采集的30份样品(15份根部,15份茎基部)进行PCR检测。【拟解决的关键问题】通过分子检测的方法进一步明确新疆部分地区苜蓿根腐病的主要病原种类、优势致病种群,并分析苜蓿根腐病多病原复合侵染情况,为该病复合侵染规律、防治研究及有效防控提供依据。
1 材料与方法
1.1 材 料
1.1.1 供试菌株
供试单孢菌株由新疆农业大学植物病理实验室提供,包括立枯丝核菌(RhizoctoniasolaniKuhn)、燕麦镰刀菌(Fusariumavenaceum(Corda&Fr.)Sacc)、木贼镰刀菌(Fusariumequiseti(Corda)Sacc.)、锐顶镰刀菌(FusariumacuminatumElls&Everhart.)、茄腐镰刀菌(Fusariumsolani(Mart.)Sacc.)、尖孢镰刀菌(FusariumoxysporumSchlecht.)和拟知孢镰刀菌(FusariumsporotrichioidesSherb.) 的7种菌株;这些菌株均为赵宗峰等[7]经病株分离、单孢纯化、致病性回接以及形态鉴定和分子鉴定,确定为苜蓿根腐病病原菌的菌株;研究中,对这些保存菌株进行活化和进一步的纯化后,从各种病原菌菌株中挑选出2个菌株作为检测体系验证过程中的供试菌及检测过程中的阳性菌株。
1.1.2 供试样品
2014年10月,于昌吉、呼图壁及三坪农场等10余块紫花苜蓿根腐病普通发病田,随机采集的根腐病病株样品,因病斑较小,经病斑刮取制成的根部混合病样和茎基部混合病样;以及2015年5月,在新疆呼图壁县紫花苜蓿单一重病田,分株采集的根部病样和茎基部病样品各15份。各样品经干燥、碾碎后装入1.5 mL离心管中,-20℃保存备用。
1.1.3 供试培养基
WA培养基用于立枯丝核菌的纯化;PDA培养基用于镰刀菌的纯化及各菌株的扩繁。
1.1.4 主要试剂与设备
1.1.4.1 试剂
植物基因组DNA提取试剂盒由天根生物科技有限公司提供;特异性引物:选用赵宗峰等[7]的报道的新疆根腐病的7种主要病病菌的特异性引物(RSF/RSR、FAF/FAR、FEF/FER、FACF/FACR、FSF/FSR、FOF/FOR、FSPF/FSPR),并由上海生工生物工程技术有限公司合成提供。表1
1.1.4.2 设备
PCR扩增仪(VERITI2.0),高速冷冻离心机(AIIegra 25R),电泳仪(HE99),凝胶成像系统(G:BOXEF),紫外透射仪(WD-9403C)。

表1 立枯丝核菌及各种镰刀菌特异性检测引物[7]
1.2 方 法
1.2.1 DNA提取
菌株DNA及病株样品的DNA提取均参照植物总DNA提取试剂盒上的操作说明进行。
1.2.2 PCR反应体系的优化及灵敏度检测
参考赵宗峰等[7]报道的PCR反应体系,利用梯度 PCR 优化退火温度。然后用特异性引物对0.5、1、2、5和10 ng/μL的苜蓿根腐病菌DNA进行PCR,以确定其检测灵敏度。
1.2.3 苜蓿根腐病田间样品检测
利用表1中的7对特异引物及优化后的检测体系对多地随机采集的苜蓿根腐病根部和茎基部混合病样及单一重病田分株采集的30份苜蓿根腐病病样进行检测,记录检测结果。
2 结果与分析
2.1 PCR反应体系的优化及检测体系的建立
研究表明,在选用的供试引物及所用PCR反应体系下,立枯丝核菌特异性扩增的最佳退火温度为59℃,尖孢镰刀菌特异性扩增的最佳退火温度为54℃,茄腐镰刀菌特异性扩增的最佳退火温度为58℃,燕麦镰刀菌特异性扩增的最佳退火温度为58℃,拟知孢镰刀菌特异性扩增的最佳退火温度为51℃,木贼镰刀菌特异性扩增的最佳退火温度为54℃,锐顶镰刀菌特异性扩增的最佳退火温度为52℃。
当DNA 模板为0.5 ng/μL以上时,均可以扩增出稳定的特异性条带,说明该反应体系下检测灵敏度等于或小于0.5 ng/μL。其灵敏度较高,且不受寄主 DNA 的干扰, 可用于根腐病菌的分子检测。
由此确定特异性引物 PCR 扩增的最佳反应体系为:总体积为25 μL,含MgCl2的10×PCR Buffer 2.5 μL,dNTPs1.0 μL,10 μM上游引物1.0 μL,10 μM下游引物1.0 μL,TaqDNA聚合酶(5 U/μL)0.2 μL,ddH2O 18.0 μL。;反应程序为:95℃预变性3 min,94℃变性40 s,退火温度51~59℃(因特异性引物不同而不同),退火30 s,72℃延伸40 s,32个循环;72℃延伸10 min,4℃保存备用。在这一反应体系下,各菌株均能扩增出明显的稳定的清晰条带。并以此体系作为病样的检测体系。图1

M:100 bp ladder maker;1~2:立枯丝核菌;3~4:木贼镰刀菌;5~6:燕麦镰刀菌;7~8:尖孢镰刀菌;9~10:茄腐镰刀菌;11~12:锐顶镰刀菌;13~14:拟知孢镰刀菌
M:100bp ladder maker; 1-2:R.solani、3-4:F.equiseti、5-6:F.avenaceum、7-8:F.oxysporum、9-10:F.solani、11-12:F.acuminatum、13-14:F.sporotrichoides
图1 7种病原菌在扩增条件优化后的PCR扩增条带
Fig.1 PCR amplification bands of seven species pathogenic fungus after amplification conditions optimized
2.2 混合样品中的病原菌种类
采用经优化的PCR反应体系作为对病样的检测体系,用7对特异性引物(RSF/RSR、FAF/FAR、FEF/FER、FACF/FACR、FSF/FSR、FOF/FOR、FSPF/FSPR)对采自北疆部分地区的苜蓿根腐病普通过发病田的根部和茎基部混合样品进行的分子检测结果显示:苜蓿根部样中有茄腐镰刀菌F.solani、锐顶镰刀菌F.acuminatum、尖孢镰刀菌F.oxysporum的清晰条带;苜蓿茎基部病样中有立枯丝核菌R.solani、锐顶镰刀菌F.acuminatum、尖孢镰刀菌F.oxysporum、木贼镰刀菌的清晰条带。图2
立枯丝核菌、茄腐镰刀菌、锐顶镰刀菌、尖孢镰刀菌和木贼镰刀菌这5种致病菌普遍存在于北疆部分地区的苜蓿根腐病根部或茎基部中,是北疆部分地区的苜蓿根腐病的主要病原菌,而燕麦镰刀菌和拟枝孢镰刀菌在混合样中未检测到其存在,可能与其致病性较弱有关,在自然条件下主要以次生感染参与到多病原复合侵染中,因而在普通发病田中的小病斑病样中存在的几率和菌量较小,不易检测到。
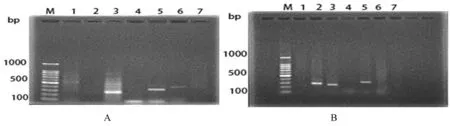
A茎基部混合样品中的特异性条带; B根部混合样品中的特异性条带;1~7:分别为样品中的立枯丝核菌、茄腐镰刀菌、锐顶镰刀菌、燕麦镰刀菌、尖孢镰刀菌、木贼镰刀菌和拟知孢镰刀菌检测结果
A:Specific bands in mixed samples from basal Stem ofAlfalfaroot rot B:Specific bands in mixed samples from roots ofalfalfaroot rot, M:100 bp ladder maker;M:100 bp ladder maker;lane1-7: Respectively, the detection results ofR.solani、F.solani、F.acuminatum、F.avenaceum、F.oxysporum、F.equiseti、F.sporotrichoides
图2 苜蓿根腐病根部混合样品和茎基部混合样品中的致病菌特异性条带
Fig.2 The specific bands of pathogenic fungus in the mixed samples from root and the mixed samples from stem base of Alfalfa root rot
2.3 重病田30份单株病样中的致病菌种类、优势种群及复合侵染
分别利用7对特异性引物(RSF/RSR、FAF/FAR、FEF/FER、FACF/FACR、FSF/FSR、FOF/FOR、FSPF/FSPR)对采自重病田的30份苜蓿根腐病根部病样茎基部病样进行特异性引物PCR检测。研究表明,在根部病样和茎基部病样中均检测到除燕麦镰刀菌F.avenaceum外的6种病原菌的特异性条带,这些检测到的病原菌分别为立枯丝核菌R.solani、木贼镰刀菌F.equiseti、锐顶镰刀菌F.acuminatum、茄腐镰刀菌F.solani、尖孢镰刀菌F.oxysporum和拟知孢镰刀菌F.sporotrichoides;在30份病样中各种病原菌的检出株数及检出株率分别为:立枯丝核菌16份(53%)、木贼镰刀菌17份(57%)、锐顶镰刀菌15份(50%)、茄腐镰刀菌18份(60%)、尖孢镰刀菌18份(60%)、拟知孢镰刀菌8份(27%);在15份根部病样中各种病原菌的检出株数及检出株率分别为:立枯丝核菌8份(53%)、木贼镰刀菌7份(47%)、锐顶镰刀菌8份(53%)、茄腐镰刀菌7份(47%)、尖孢镰刀菌10份(67%)、拟知孢镰刀菌5份(33%);在15份茎基部病样中各种病原菌的检出株数及检出株率分别为立枯丝核菌8份(53%)、木贼镰刀菌10份(67%)、锐顶镰刀菌7份(47%)茄腐镰刀菌11份(73%)、尖孢镰刀菌8份(53%)、拟知孢镰刀菌3份(20%);其中,立枯丝核菌R.solani、木贼镰刀菌F.equiseti、锐顶镰刀菌F.acuminatum、茄腐镰刀菌F.solani、尖孢镰刀菌F.oxysporum5种病原菌在根部病样及茎基部病样中均有较高的检出率(47%~73%),再次说明这5种病原菌普遍存在于苜蓿根腐病病株当中,是苜蓿根腐病的主要病原菌,其中又以茄腐镰刀菌F.solani、尖孢镰刀菌F.oxysporum在30份病样中检出率最高(60%),为苜蓿根腐病的优势病原菌种群;而拟知孢镰刀菌F.sporotrichoides的检出率较低(20%~33%),燕麦镰刀菌F.avenaceum的检出率为0%,说明这两种病原菌在田间病株只有少量感染或极少量感染,是7种病原菌中的弱势种群。此外,比较根部病样和茎基部病样的检出结果可以看出,根部病样和茎基部病样中优势病原菌种群有所不同,根部病样中以尖孢镰刀菌F.oxysporum、锐顶镰刀菌F.acuminatum和立枯丝核菌R.solani为优势种群,茎基部病样中以茄腐镰刀菌F.solani和木贼镰刀菌F.equiseti为优势种群。
再从单株病样中检出的病原菌种类可以看出,无论在根部病样还是在茎基部病样中两种以上的病原菌复合侵染单一植株,并引起根部病斑或茎基部病斑的情况非常普遍;在30份病样中,2种及2种以上的病原菌复合侵染的比率约为83%,3种及3种以上的病原菌复合侵染的比率约为67%,4种及4种以上的病原菌复合侵染的比率约为47%,5种病原菌复合感染的比率为23%。表2~3,图3~4
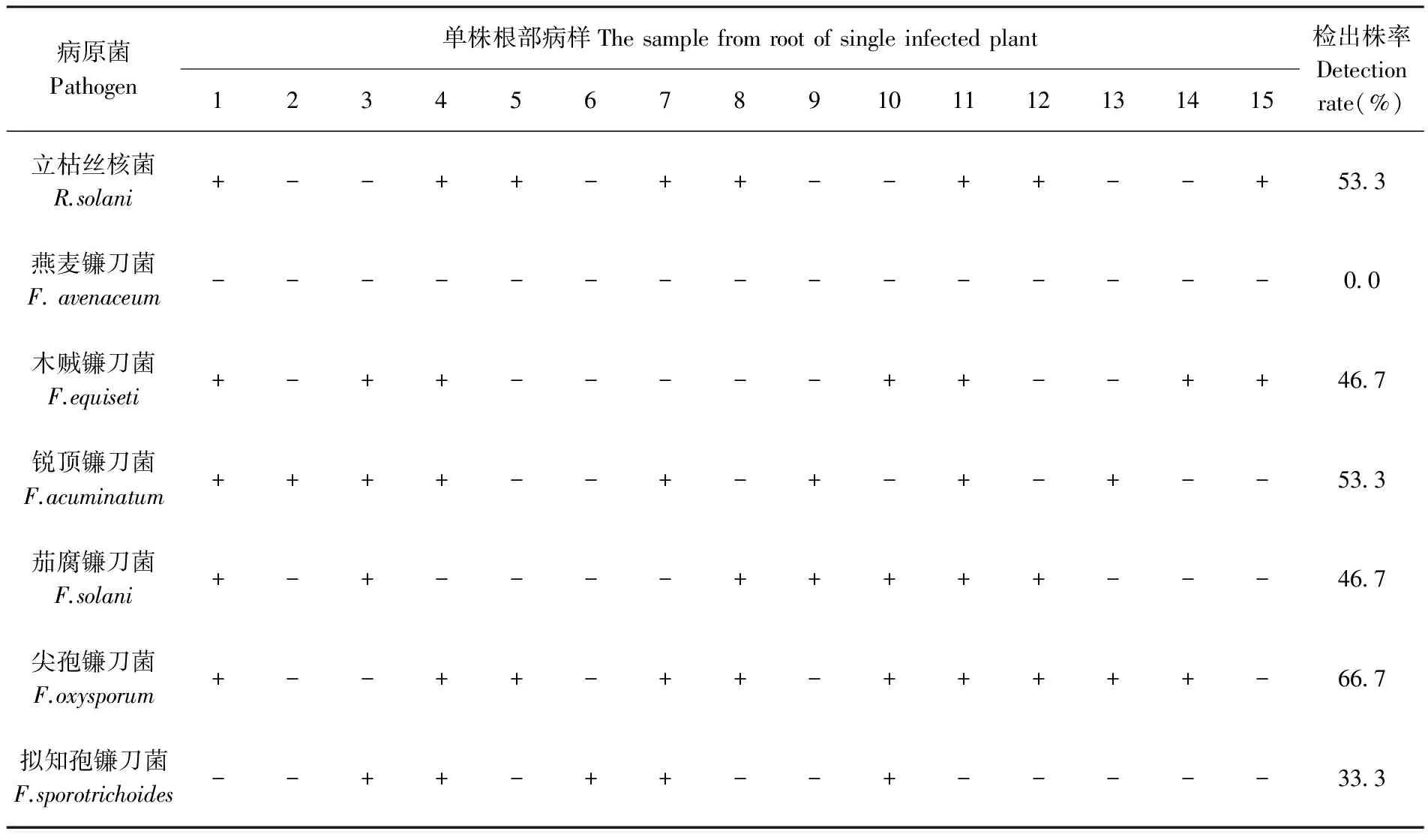
表2 新疆呼图壁县苜蓿根腐病根部病样检测结果
注:“+”表示检测出该菌;“-”表示未检出该菌,下同
Note: “+”shows that the Pathogen is detected, “-”shows that the Pathogen is not detected, the same as below

表3 新疆呼图壁县苜蓿根腐病茎基部病样检测结果
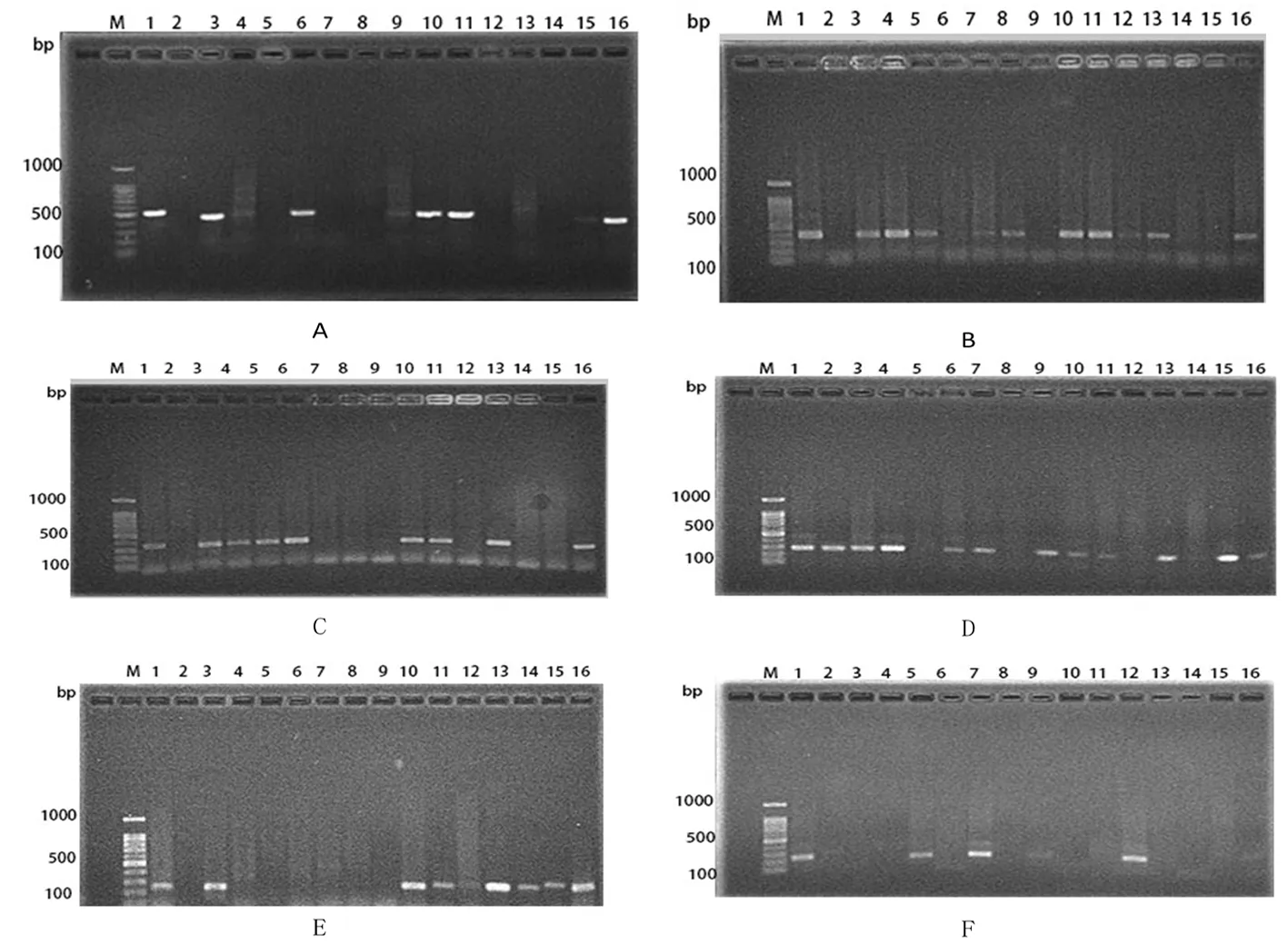
A~F:分别为茎基部样品中的立枯丝核菌、木贼镰刀菌、尖孢镰刀菌、茄腐镰刀菌、锐顶镰刀菌和拟知孢镰刀菌特异性条带;M:100 bp ladder maker;1:阳性对照,2~16:茎基部样品
A-F: Respectively,the specificity bands ofR.solani、F.equiseti、F.oxysporum、F.solani、F.acuminatum、F.sporotrichoidesinsamples from basal stem; M:100 bp ladder maker;lane1positive control lane 2-16:Stem base samples 2-16 specific bands
图3 茎基部病样中病原菌特异性条带
Fig.3 The specificity bands of pathogenic fungus in samples from basal stem

A~F:分别为根部样品中的立枯丝核菌,木贼镰刀菌,尖孢镰刀菌,茄腐镰刀菌,锐顶镰刀菌和拟知孢镰刀菌特异性条带);M:100 bp ladder maker;1:阳性对照,2~16:茎基部样品
A-F: Respectively, the specificity bands ofR.solani、F.equiseti、F.oxysporum、F.solani、F.acuminatum、F.sporotrichoidesin samples from root; M:100 bp ladder maker;lane1positive control lane 2-16:Stem base samples 2-16 specific bands
图4 田间根部病样中病原菌特异性条带
Fig.4 The specificity bands of pathogenic fungus in samples from root
3 讨 论
基于特异性引物PCR进行病原菌分子检测技术已经比较成熟,研究检测结果表明,通过特异性引物的PCR扩增可以准确地检测出引起苜蓿根腐病的多种致病菌,并由此分析其病原菌种类及优势致病种群,从而为该病的有效防控提供依据。研究以分子检测手段较好地证实了赵宗峰等[7]关于新疆苜蓿根腐病病原种类的研究结果,但研究局限于已报道的新疆苜蓿根腐病的7种病原菌,对更多和种病菌复合侵染的可能性还在进一步研究中,且在研究中,始终未检测到赵宗峰[7]报道的7种病原菌之一的燕麦镰刀菌,这一差异是否与采样地点不同、前作不同,或与其真实的致病性有关值得进一步研究。
苜蓿根腐病确为多病原复合侵染引起的病害,在田间受多病原复合侵染的情况非常普遍,因而应该加强苜蓿根腐病的田间监测和引种检验工作。
利用特异性引物分子检测手段来监测复合侵染病害的病原种类及优势致病种群的可能性。如能对复合侵染病害的各病原菌进行动态的检测,可更好地分析这些病害的复合侵染规律,分析其先导因素,主导因素,从而为该类病害的高效防控提供更好的防控方法及防控切入点。
4 结 论
利用特异性引物分子检测方法从新疆北疆部分地区苜蓿根腐病病样中,至少可检测出5种镰刀菌(木贼镰刀菌F.equiseti、锐顶镰刀菌F.acuminatum、茄腐镰刀菌F.solani、尖孢镰刀菌F.oxysporum、拟知孢镰刀菌F.sporotrichoides)和1种丝核菌(立枯丝核菌R.solani);其中,立枯丝核菌 R. solani、木贼镰刀菌F.equiseti、锐顶镰刀菌F.acuminatum、茄腐镰刀菌F.solani、尖孢镰刀菌F.oxysporum5种病原菌在病株样品普遍存在,是新疆北疆部分地区苜蓿根腐的主要病原菌;侵染根部的病原菌中以尖孢镰刀菌F.oxysporum、锐顶镰刀菌F.acuminatum和立枯丝核菌R.solani为优势种群,侵染茎基部病原菌中以茄腐镰刀菌F.solani和木贼镰刀菌F.equiseti为优势种群。苜蓿根腐病中多病原菌复合侵染的情况非常普遍。
References)
[1] 耿华珠. 中国苜蓿[M]. 北京:中国农业出版社,1995:114-130.
GENG Hua-zhu. (1995).ChineseAlfalfa[M]. Beijing:China Agriculture Press:114-130. (in Chinese)
[2] 袁庆华. 我国苜蓿病害研究进展[J]. 植物保护,2007,33(1):66.
YUAN Qing-hua. (2007). Research progress of Alfalfa diseases in our country [J].PlantProtection, 33 (1):66. (in Chinese)
[3] 南志标,李春杰. 中国牧草真菌病害名录 [J]. 草业科学(增刊),1994:25-28.
NAN Zhi-biao, LI Chun-jie. (1994). China grass fungus diseases list [J].Prataculturalscience, (Sup):25-28. (in Chinese)
[4] 王雪薇. 新疆阿勒泰新垦区苜蓿病害调查与分析[J]. 新疆农业大学学报,1996,19(3):40-44.
WANG Xue-wei. (1996). Investigation and analysis of Alfalfa disease in the new reclamation area in Altai, Xinjiang [J].JournalofXinjiangAgriculturalUniversity, 19(3):40-44. (in Chinese)
[5] 陈耀,闵继淳,肖凤,等. 新疆苜蓿根腐病研究初报[J]. 中国草地,1989,(2): 71-76.
CHEN Yao, MIN Ji-chun, XIAO Feng, et al. (1989). Preliminary report on the study of Alfalfa root rot in Xinjiang [J].ChinaGrassland, (2):71-76. (in Chinese)
[6] 孟嫣,李敏权,苜蓿根和根颈腐烂病病原及防治研究进展[J]. 草业科学, 2005,22(5):89-92.
MENG Yan, LI Min-quan. (2005). Research progress of pathogen and controlling of alfalfa root rot and alfalfa neck rot [J].PrataculturalScience, 22(5):89-92. (in Chinese)
[7] 赵宗峰. 新疆呼图壁县种用苜蓿主要真菌病害及其病原菌初步研究[D]. 乌鲁木齐:新疆农业大学硕士论文,2011:1-2,39-49.
ZHAO Zong-feng. (2011).PreliminarystudyonmajorfungaldiseasesandpathogensofalfalfainHutubiCountryofXinjiang[D]. Master Dissertation. Xinjiang Agricultural University, Urumqi:1-2,39-49. (in Chinese)
Fund project:Doctoral Fund Project of Ministry of Education, P. R. China. "Research on the molecular detection of the main pathogens of alfalfa root rot in Xinjiang "
Molecular Detection of Various Pathogens of Alfalfa Root Rot
WEI Ran, GUO Qing-yuan, BAI Jian-yu, ZHANG Shan-he
(College of Agronomy,Xinjiang Agricultural University,Urumqi 830052,China)
【Objective】 This paper attempts to identify the pathologic species of the alfalfa root rot, the occurrence frequency of various pathogens in the infected plants, status of the compound infection of pathogenic bacteria by multiple pathogens in the single infected plant in order to lay the foundation for research on the infection regularity and prevention of the alfalfa root rot.【Method】The 7 pairs of specific-primer of the 7 species of reported pathogens were made use of to carry out PCR detection of the mixed disease samples of the root rot collected from the main planting areas in Northern Xinjiang and so did root rot samples as individual plant collected from the single heavily infected field.【Result】The results showed that the pathogenic species could be detected from the disease sample from the main planting areas of Norther Xinjiang including 5 species ofFusariumand 1 species ofRhizoctonia; Among which,Rhizoctoniasolani,Fusariumequiseti,Fusariumacuminatum,FusariumsolaniandFusariumoxysporumwere prevalent in the infected plants; which were the main pathogens of the alfalfa root rot in Northern Xinjiang; For the pathogens in the infected root, the dominant species wereFusariumoxysporum,FusariumacuminatumandRhizoctoniasolani; For the pathogens in the infected basal stem, the dominant species wereFusariumsolaniandFusariumequiseti. The detected results also showed that the mixed infected ratio of 2 species and above pathogens is up to 83%, among the disease samples of alfalfa root rot.【Conclusion】Thus it can be seen that theFusariumequiseti,Fusariumacuminatum,Fusariumsolani,FusariumoxysporumandRhizoctoniasolaniare the main pathogens of alfalfa root rot in the Norther Xinjiang region, from which we can infer thatFusariumoxyspariumis a secondary pathogen which has a low occurrence frequency; dominant pathogenic population differs in the disease spot of the root and the basal stem; the status of the mixed infection of various pathogens is very common for the diseased plant in the field.
alfalfa; root rot;Fusarium;Rhizoctoniasolani; PCR
10.6048/j.issn.1001-4330.2016.07.013
2016-02-20
教育部博士点基金项目“新疆苜蓿根腐病主要病原菌的分子检测技术研究”
魏然(1992-),女,河南商丘人,硕士研究生,研究方向为植物病害检测
郭庆元(1962-),男,四川雅洪人,教授,博士生导师,研究方向为植物病理学, (E-mail)guoqingyuan3009@sina.com
S435.4
A
1001-4330(2016)07-1268-08

