新疆变色石竹繁殖生物学特性研究
马际凯,董连新
(新疆农业大学林学与园艺学院,乌鲁木齐 830052)
新疆变色石竹繁殖生物学特性研究
马际凯,董连新
(新疆农业大学林学与园艺学院,乌鲁木齐 830052)
【目的】观察变色石竹花期动态,分析花粉活力、柱头可授性的发生规律,为野生石竹种质资源利用及杂交育种提供理论依据。【方法】观测记录变色石竹花期。以变色石竹花粉为材料,采用L9(33)正交设计研究蔗糖、硼酸、氯化钙对变色石竹花粉离体萌发的影响。运用碘-碘化钾染色法、TTC染色法、花粉萌发法动态测定花粉活力,采用联苯胺过氧化氢法测定柱头可授性。【结果】变色石竹开花在5月中下旬,盛花期从6月延续到9月,花期持续时长为165 d左右;10 g/L蔗糖+0.1 g/L硼酸+0.05 g/L氯化钙为比较适合变色石竹花粉萌发培养基;花粉在开花第6 h至第6 d花粉都具有活力,开花第2 d花粉活力最高;柱头从开花第3 d逐渐具有可授性,到第8 d可授性消失。【结论】变色石竹花部图案多变,花期较长具有一定的观赏价值。蔗糖、硼酸、氯化钙均对花粉萌发具有促进作用,TTC染色法测定花粉活力相对便捷准确,开花第4~6 d内柱头可授性最强。
石竹;培养基;花粉活力;柱头可授性
0 引 言
【研究意义】石竹(Dianthus)属植物叶形优美,花团锦簇,花色丰富,一直以来被认为是既可作切花、盆花,又可作花坛植物和地被植物的优良观赏花卉。目前很多商品石竹经过多次杂交出现雄蕊瓣化,产生花粉少,子房发生畸变的现象,很大程度上影响到育种效率[1]。而野生石竹由于地理隔离避免了杂交后出现的品种退化现象,经过长期的自然选择野生石竹具备一些栽培品种无法比拟的优势。因而对野生石竹属植物开展研究和新种类新品种的开发利用日显迫切。新疆是我国石竹属植物的分布中心,新疆的天山山脉和阿尔泰山山脉分布着丰富的野生石竹种质资源[2]。变色石竹(Dianthusversicolor)就是一种广泛分布于天山山脉,花色多变的野生石竹,除花喉部图案多变花形优美外,还是名贵的蒙药材,可以用于调节血压治疗心脑血管疾病[3],对肺炎、伤寒有一定的疗效[4]。研究变色石竹开花生物学特性对于野生石竹杂交育种、资源开发以及种质资源创新具有一定的参考价值。【前人研究进展】有关植物开花生物学特性方面的研究有很多,肖真真等[5]通过运用几种花粉活力测定法测定核桃花粉活力筛选出最适宜核桃花粉活力测定的方法。孙强[1]研究了地被香石竹花粉形态和生物学特性,为地被香石竹的杂交育种提供了便利依据。前人对野生樱桃花粉活力与授粉结实特性进行了研究,为野生樱桃人工栽培和选育给出了理论参考[6]。【本研究切入点】周旭红等[7]仅对香石竹花粉萌发进行了研究,而对野生石竹开花繁育系统方面的研究还未见报道。研究在前人研究的基础上,对变色石竹花期进行观测,筛选出变色石竹花粉最适萌发培养基配方。【拟解决的关键问题】研究比较分析变色石竹花粉活力测定方法,对花粉活力、柱头可授性进行动态测定,为野生石竹的杂交育种和种质资源创新提供科学依据。
1 材料与方法
1.1 材 料
供试材料为天山山脉西缘自然分布的变色石竹(Dianthusversicolor)花材,2013年整株引种至新疆农业大学实验苗圃(N 44°05'48.07'',E87°03'11.23'';海拔848 m)。2014年6月于盛花期选取无病害、虫害的健壮植株,10:00~11:00采集实验所需时期的花朵置于冰盒中备用至实验[8]。表1

表1 变色石竹引种来源
1.2 方 法
1.2.1 花期观察与记录
根据Dafni花期观察标准[9]:全柱约有5%的花蕾出现为现蕾期;25%花朵开放为初花期;50%花朵开放为盛花期;50%花朵脱落为落花期。从花蕾期开始到末花期观察变色石竹开花动态,记录连续花期。
1.2.2 花粉活力测定
1.2.2.1 花粉离体萌发
正交试验设计:液体培养基主要成分为蔗糖、硼酸、氯化钙。采用L9(33)正交试验设计,研究培养基中蔗糖(A)、硼酸(B)、氯化钙(C),3个因素对变色石竹花粉离体萌发的影响。每个处理做3个玻片重复,每片选取3个视野,选取视野花粉总数不少于50个,统计花粉萌发率。表2
花粉活力测定采用液体培养法[10],将开花第6 h、12 h、1 d、2 d、3 d、4 d、5 d、6 d的花药置于凹玻片中央,用镊子碾碎使花粉粒充分释放,加2~3滴正交试验中选出的最佳培养基,于35℃人工气候箱中培养4 h,取出在显微镜下观察。
萌发率=(已萌发花粉数/观测花粉总数)×100%.
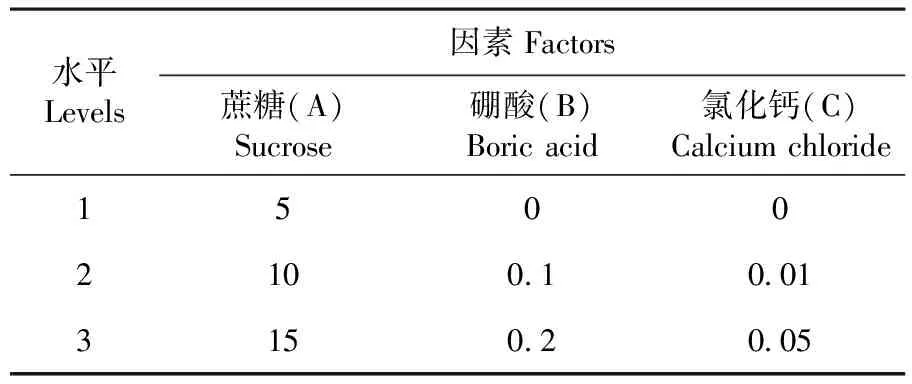
表2 不同培养基对变色石竹花粉离体萌发影响的正交设计
1.2.2.2 碘-碘化钾染色法
采用碘-碘化钾染色法测定花粉活力[11],将开花第6 h、12 h、1 d、2 d、3 d、4 d、5 d、6 d的花药置于载玻片中央,滴1~2滴蒸馏水,用镊子碾碎使花粉粒充分释放,加1~2滴1%碘-碘化钾染色液于25℃恒人工气候箱染色20 min后于显微镜下观察花粉染色情况并计数。每个时期花粉做3个片,每片选取3个视野,选取视野花粉总数不少于50个,具活力的花粉呈蓝色,统计染色比率。
花粉活力比率=(染色花粉数/花粉总数)×100%.
1.2.2.3 TTC染色法
采用TTC染色法测定花粉活力[12],将开花第6 h、12 h、1 d、2 d、3 d、4 d、5 d、6 d的花药置于载玻片中央,用镊子碾碎使花粉粒充分释放,加1~2滴0.5%TTC染色液,在35℃人工气候箱中染色30 min于显微镜下观察。每个时期花粉做3个片,每片选取3个视野,选取视野花粉总数不少于50个,具活力的花粉呈红色,统计染色比率。
花粉活力比率=(染色花粉数/花粉总数)×100%.
1.2.3 柱头形态观察及可授性测定
1.2.3.1 柱头形态
用镊子将花瓣剥离使柱头完全露出,观察柱头长度、颜色、柱头弯曲程度以及柱头绒毛发育情况[13]。
1.2.3.2 柱头可授性
采用联苯胺-过氧化氢法测定柱头可授性[14],溶液配制:称取1 g过氧化氢溶于100 mL蒸馏水中,将30%过氧化氢稀释到3%,按照联苯胺∶过氧化氢∶水=4∶11∶22的比例配置好反应液。可授性观察:将开花第1、2、3、4、5、6、7、8、9 d的柱头剥离出的柱头置于凹玻片中央,加入联苯胺-过氧化氢反应液后直接置于显微镜下观察。根据产生气泡量判断柱头可授性强弱。
1.3 数据统计
试验数据采用Excel 2003及SPSS 17.0分析处理,花粉萌发率数据若不符合方差齐性要求则经过平方根反正弦转换后再进行分析。
2 结果与分析
2.1 变色石竹花期
变色石竹花期从花蕾期到末花期持续时间共162 d左右,花蕾期在5月中下旬,6月初花蕾量逐渐增多并开放达到初花期;6月初直到10月中上旬为盛花期此时开花量最大,在7月底开花量达到峰值;从10月下旬开始开花量减少直至11月初不再开花。表3
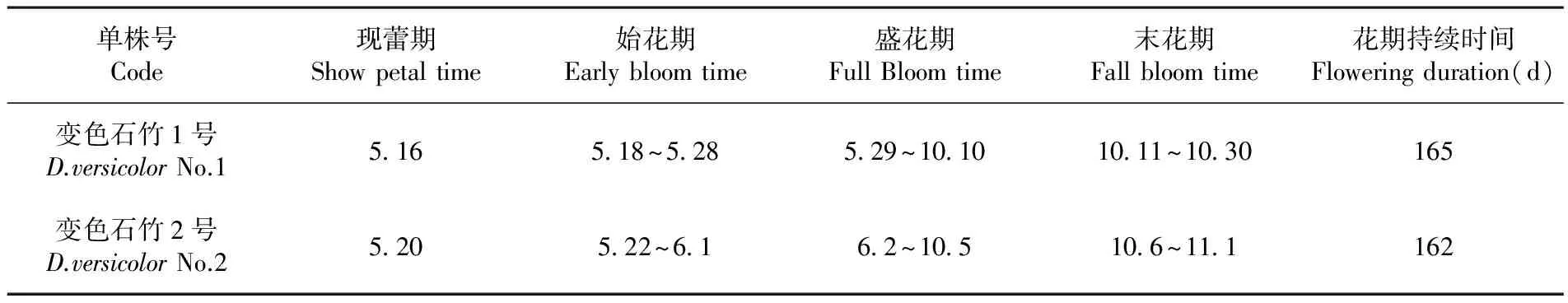
表3 变色石竹花期(月·日)
2.2 各因素质量浓度对变色石竹花粉萌发的影响
研究表明,参试组平均花粉萌发率分别为:4.32%、5.15%、5.36%、23.62%、48.60%、32.85%、25.76%、29.57%、26.61%,花粉萌发率最高的为A2B2C3培养基,萌发率达到48.60%。A1B3C1、A1B1C1培养基萌发率较低,花粉萌发不均匀。根据多重比较发现,蔗糖三个水平间相互差异显著,A2水平下萌发率最高。硼酸B1和B3水平间没有显著差异,而B2与B1、B3差异显著。氯化钙C1与C2、C3间差异不显著,而C2与C3间具有显著差异,在C3水平下萌发率较高。多重比较结果得出,花粉萌发培养基最佳组合为A2B2C3。表4
研究表明,蔗糖浓度对花粉萌发的影响极显著,硼酸浓度对花粉萌发影响极显著,氯化钙浓度对花粉萌发有显著性影响。适宜浓度的蔗糖对于变色石竹花粉萌发具有明显促进的作用,适宜浓度的硼酸对花粉萌发的作用很明显,氯化钙对变色石竹花粉萌发有一定的促进作用。表5
2.3 花粉染色及花粉寿命
对于变色石竹,从开始散粉到散粉第2 d花粉活力呈上升趋势,第3至第6 d花粉活力总体呈下降趋势直到第6 d花粉不具活力。研究表明,开花后6 h变色石竹开始散粉,此时花粉具一定活力,随着散粉量增多花粉活力逐渐上升于第2 d达到峰值,花粉活力开始迅速下降直至花药干枯。三种方法测定花粉活力均值,碘-碘化钾法>TTC法>花粉萌发法。图1
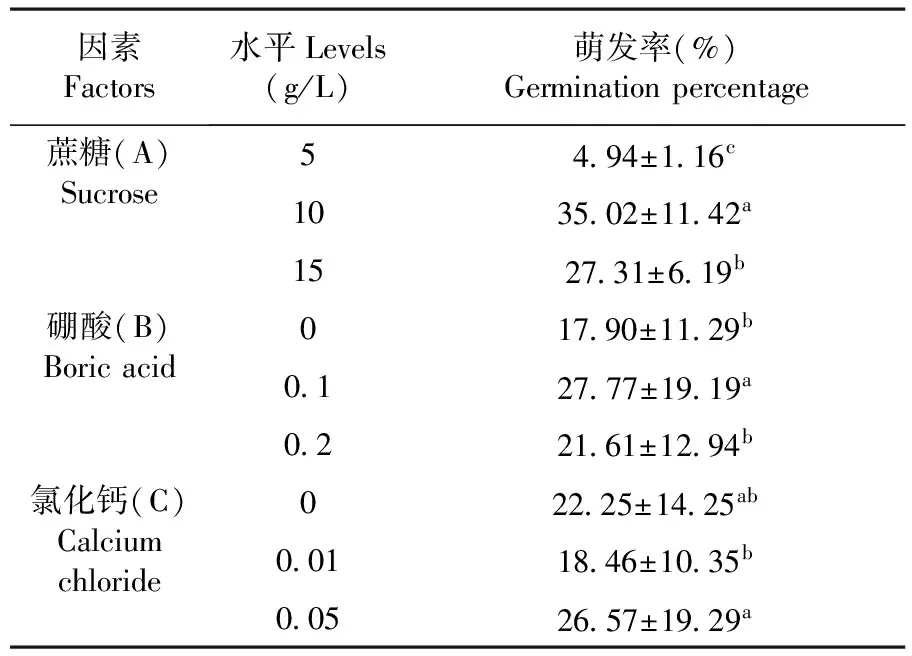
表4 各因素质量浓度变色石竹花粉离体萌发率
注:A表示三个水平蔗糖浓度:B表示三个水平硼酸浓度,C表示三个水平氯化钙浓度
Note:A presents three levels of sucrose concentration;B presents three levels of boric acid concentration; C presents three levels of calcium chloride concentration
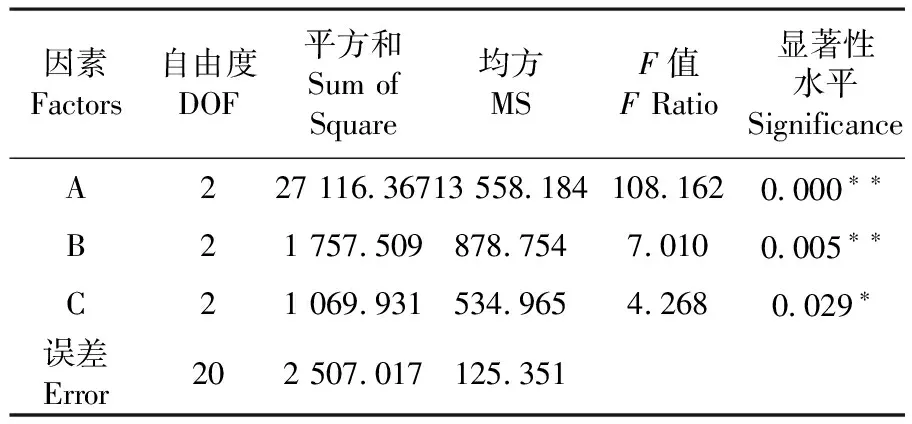
表5 L9(33)正交试验方差
2.4 柱头形态及可授性
研究表明,开花第1~2 d,花柱较短长度约为4.2 mm,柱头白色无绒毛,不具有可授性;开花第3 d,花柱明显增长,长度达到7.4 mm,柱头微绒毛呈白色,部分柱头具有可授性;开花第4 d,花柱长达8.4 mm,柱头微绒毛呈淡粉色,具有可授性但可授性较弱;开花第5~7 d,花柱长度达到峰值8.6 mm,柱头绒毛量明显增多呈现粉色,形态表现为逐渐弯曲,可授性较强并在第6 d达到最强;开花第8天,花柱长度为8.1 mm,柱头弯曲度增大,多绒毛呈粉色,柱头具有可授性,可授性减弱;开花第9 d,花柱长度约为7.9 mm,柱头弯曲度严重,部分绒毛出现干枯情况,柱头可授性消失。表6
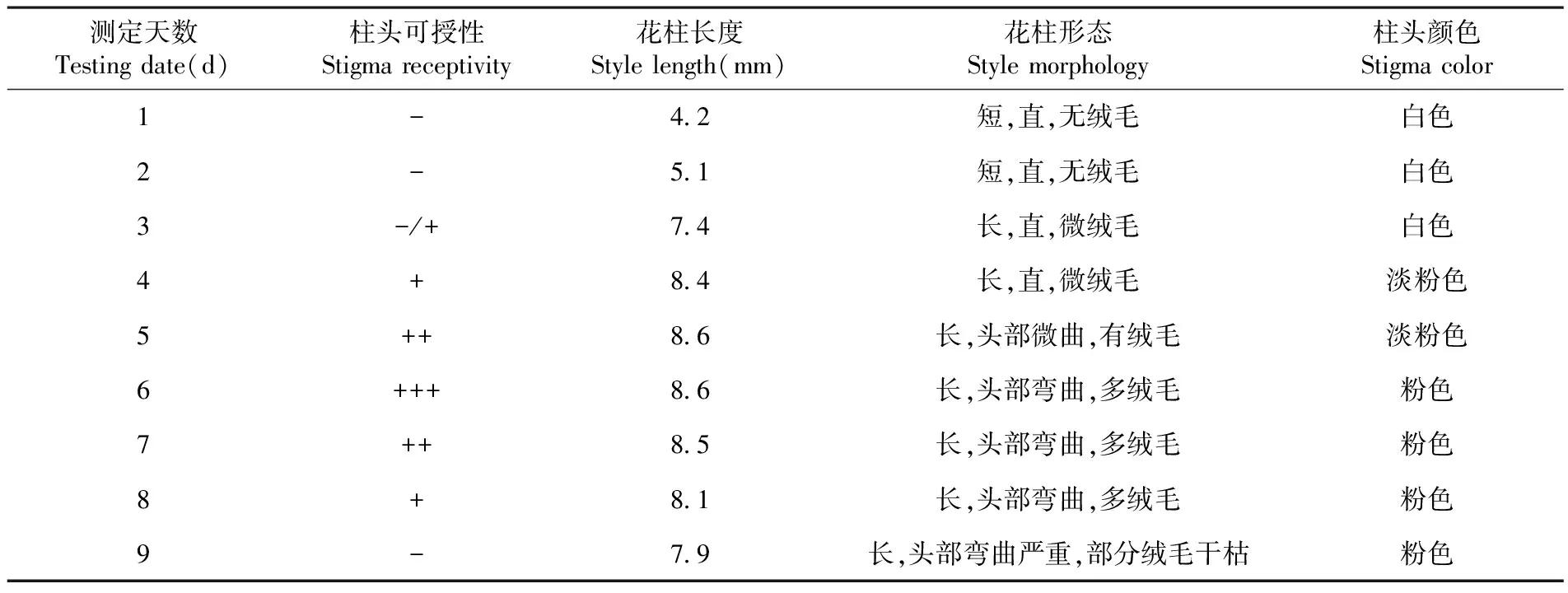
图1 花粉萌发和染色比率
注:“-”表示柱头不具可授性:“-/+”表示部分柱头不具可授性;“+”表示柱头具可授性;“++”表示柱头可授性较强;“+ + +”表示柱头可授性最强
Note: “-”represents it is without stigma receptivity any more;“-/+”represents it is with partial stigma receptivity;“+”represents it is with stigma receptivity;“+ +”represents it is with strong stigma receptivity;“+++”represents it is with the strongest stigma receptivity
3 讨 论
蔗糖作为花粉萌发的碳源,也是花粉萌发及花粉管壁合成的主要营养物质来源,对花粉萌发具有重要的作用[15],适当浓度的蔗糖还能够平衡细胞内外的渗透压。当蔗糖浓度过高时,细胞会发生质壁分离现象,而在试验中并未发现有质壁分离的花粉细胞,说明蔗糖的浓度在合理范围内。硼元素能够与蔗糖形成络合物,促进糖分的吸收和代谢,从而增加花粉糖含量,加强代谢活动[16];此外,郭光明等[17]通过研究百合花粉发现硼对质外体结合钙离子和游离钙离子有影响,硼有可能对细胞内游离钙离子也产生影响。英国学者通过观察花粉管生长的全过程,得出一定浓度的钙离子有利于合成膜蛋白,并且能够调控花粉管生长的结论[18]。一定浓度的硼酸和氯化钙能够促进花粉萌发,有关花粉萌发的研究表明,花粉萌发是多个因子共同作用的结果,不同因素不同梯度对萌发的花粉具有促进或是抑制作用。
花粉生活力强弱,一方面由遗传因素决定,另一方面又受到环境因素的影响。目前,在短时间内测定花粉活力的方法主要有离体萌发法和非萌发染色分析法[19]。
花粉活力及柱头可授性研究是一个动态的过程,柱头可授性是花朵成熟过程中的一个重要时期,它在很大程度上影响着授粉成功率[20]。变色石竹花粉活力较强时,柱头不具有可授性,这可能与变色石竹避免自花传粉的适应机制相关。
4 结 论
通过对变色石竹花期动态记录得出,变色石竹开花期在5月下旬,最佳观赏时间即盛花期于6月初一直延续到9月底,连续花期长达165 d左右,并且花形优美,花部图案多变,花期较长,具备一定的观赏价值。
比较适合变色石竹花粉培养配方为:蔗糖10 g/L+硼酸0.1 g/L+氯化钙0.05 g/L。其中,蔗糖、硼酸对花粉萌发影响较大,氯化钙对花粉萌发具有一定的影响。
运用三种方法测定变色石竹花粉活力,两种染色法测得花粉活力均高于体外萌发法,但三者趋势保持一致,并从不同角度反映花粉活力。花粉萌发法对花粉活力测定较为准确,但不同植物花粉萌发培养基差异较大,操作起来比较繁琐;碘-碘化钾染色法简便易行,但对花粉的生活力估计偏高,会使没有活力的花粉着色;TTC染色法操作简便并能够较好的反应花粉活力情况。
对柱头可授性测定得出,变色石竹花粉活力最高时柱头还不具有可授性,而柱头可授性最强表现在第6 d,此时花粉活力较低。
References)
[1] 孙强. 地被香石竹花粉形态和生物学特性[J]. 林业科技开发, 2014,28(3):75-77.
SUN Qiang. (2014). Pollen morphologic and biological characteristics of theDianthuscaryophyllus×Dianthuschinensis[J].ChinaForestryScienceandTechnology,28(3):75-77. (in Chinese)
[2] 董连新. 新疆野生石竹种质资源收集、保存、评价及利用研究[D]. 南京:南京林业大学博士论文,2009.
DONG Lian-xin. (2009).Studiesongermplasmcollection,evaluation,preservationanduseofwildDianthusfromXingjian[D]. PhD Dissertation. Nanjing Forestry University, Nanjing. (in Chinese)
[3] Obmann, A., & Glasl-Tazreiter, S. (2012). Dianthus versicolor, fisch.ZeitschriftFürPhytotherapie, 33(6):302-306.
[4] Obmann. (2009). Uterus activity of the mongolian medicinal plant dianthus versicolor fisch.ScientiaPharmaceutica, 77:269-269.
[5] 肖真真, 陈虹, 潘存德, 等. 新新2号核桃花粉活力测定方法比较[J]. 新疆农业科学, 2014,51(10):1 777-1 781.
XIAO Zhen-zhen, CHEN Hong, PAN Cun-de, et al. (2014). Comparison on Juglans regia 'Xinxin 2' by Pollen Viability Determination Method [J].XinjiangAgriculturalSciences, 51(10):1,777-1,781. (in Chinese)
[6] 廖康, 李会芳, 许正, 等. 野生樱桃李花粉活力与授粉结实特性初报[J]. 新疆农业科学, 2008,45(3):393-397.
LIAO Kang , LI Hui-fang, XU Zheng. et al. (2008). Primary Report on Pollen Vitality and Property of Pollination and Fruiting of Wild Cherry Plum [J].XinjiangAgriculturalSciences, 45(3):393-397. (in Chinese)
[7] 周旭红, 桂敏, 莫锡君. 香石竹花粉生活力的研究[J]. 西南师范大学学报(自然科学版),2008,33(5):108-111.
ZHOU Xu-hong, GUI Ming, MO Xi-jun. (2008). Study on Pollen Viability ofDianthuscaryophyllus[J].JournalSouthwestChinaNormalUniversity(NaturalScienceEdition), 33(5):108-111. (in Chinese)
[8] 刘自刚, 呼天明, 杨亚丽, 等. 桔梗花粉萌发与花粉管生长研究[J]. 植物研究, 2011,31(3):271-276.
LIU Zi-gang, HU Tian-ming, YANG Ya-li, et al. (2011). Pollen Germination and Growth ofPlatycodongrandiflorum[J].BulletinofBotanicalResearch, 31(3):271-276. (in Chinese)
[9] Dafni, A. (1994). Pollination ecology: a practical approach.Brittonia,46(46):20-25.
[10] 刘宝, 赵志刚, 程伟, 等. 光皮桦花粉离体萌发试验[J]. 广西植物, 2009,29(2):264-268.
LIU Bao, ZHAO Zhi-gang, CHENG Wei, et al. (2009). Tests on in vitro germination ofBetulaluminiferapollens [J].Guihaia, 29(2):264-268. (in Chinese)
[11] 刘帮龙, 张晓慧, 干友民, 等. 野生马蹄金花粉生活力检测方法比较[J]. 草业科学, 2011,28(11):1 941-1 944.
LIU Bang-long, ZHANG Xiao-hui, GAN You-ming, et al. (2011). Detection methods of pollen viability of wildDichondrarepens[J].PrataculturalScience, 28(11):1,941-1,944. (in Chinese)
[12] 胡春, 刘左军, 李富香, 等. 钝裂银莲花花粉活力测定方法的研究[J]. 植物研究, 2013,33(5):582-586.
HU Chun, LIU Zuo-jun, LI Fu-xiang, et al. (2013). Detection Methods for Pollen Viability ofAnemoneobtusiloba[J].BulletinofBotanicalResearch, 33(5):582-586. (in Chinese)
[13] 刘林德, 张萍, 张丽, 等. 锦带花的花粉活力、柱头可授性及传粉者的观察[J]. 西北植物学报, 2004,24(8):1 431-1 434.
LIU Lin-de, ZHANG Pin, ZHANG Li, et al. (2004). Pollen viability, stigma receptivity and pollinators ofWeigelaflorida[J].ActaBot.Boreal,Occident.Sin, 24(8):1,431-1,434. (in Chinese)
[14] 孙颖, 马翠青, 严俊鑫, 等. 大花百子莲的花粉活力与柱头可授性[J]. 东北林业大学学报, 2013,41(7):89-92.
SUN Ying, MA Cui-qing, YAN Jun-xin, et al. (2013). Pollen Viability and Stigma Receptivity ofAgapanthuspraecoxssp.orientalis'Big Blue'[J].JournalofNortheastForestryUniversity, 41(7):89-92. (in Chinese)
[15] 蒲光兰, 周兰英, 李瑾宵, 等. 温度、蔗糖和硼酸对麻疯树花粉离体萌发的影响[J]. 西北林学院学报, 2011,26(3):55-58.
PU Guang-lan, ZHOU Lan-ying, LI Jin-xiao, et al. (2011). Effects of Temperature, Sucrose and Boric Acid on Vitro Pollen Germination ofJatrophacurcas[J].JournalofNorthwestForestryUniversity, 26(3):55-58. (in Chinese)
[16] Steinhorst, L., & Kudla, J. (2012). Calcium - a central regulator of pollen germination and tube growth.BiochimicaEtBiophysicaActa, 1833(7):1,573-1,581.
[17] 郭光明, 张福锁, 尚忠林, 等. 硼对百合花粉萌发过程中细胞内游离钙离子的影响[J]. 中国农业大学学报, 2002,7(5):32-37.
GUO Guang-ming, ZHANG Fu-suo, SHANG Zhong-lin, et al. (2002). Effects of Boron on Cytosolic Ca2+in Germinating Pollen Grain Cells ofLiliumdavidiiDutchartre [J].JournalofChinaAgriculturalUniversity, 7(5):32-37. (in Chinese)
[18] Franklintong, V. E. (1999). Signaling and the modulation of pollen tube growth.PlantCell, 11(11):727-738.
[19] 胡适宜. 植物胚胎学实验方法(一):花粉生活力的测定[J]. 植物学报, 1993,10(2):60-62.
Hu Shi-yi. (1993). Experimental Methods in Plant Embrology (I):Determination of Pollen Viability [J].ChineseBulletinBotany, 10(2):60-62. ( in Chinese)
[20] 翟飞飞, 巨关升, 李伟, 等. 多年生黑麦草花粉活力和柱头可授性 [J]. 东北林业大学学报, 2015,43(3):75-78.
ZHAI Fei-fei, JU Guan-sheng, LI Wei, et al. (2015). Pollen Viability and Stigma Receptivity of Lolium perenne [J].JournalofNortheastForestryUniversity, 43(3):75-78. (in Chinese)
Fund project:Supported by Shanghai scientific technology agriculture development project(207110008)and College students' innovative entrepreneurial training program of Xinjiang Agricultural University(201510758003)
Pollen Viability and Stigma Receptivity of Dianthus versicolor in Xinjiang
MA Ji-kai, DONG Lian-xin
(College of Forestry and Horticulture Xinjiang Agricultural University,Urumqi 830052,China)
【Objective】 The project aims to measure the flower biological characteristics, regulation of pollen viability and stigma receptivity in order to provide basic theory toDianthusversicolorgermplasm utilization and cross pollination.【Method】By observing dynamicD.versicolorflower bloom and surveying organ of flower to research the effects of sucrose, boric acid and calcium chloride onD.versicolorpollen germination, the trial usesD.versicolorpollen by L9 (33) orthogonal design.【Result】(1)D.versicolorbloomed in the middle of May. The peak of flowering was from June to September and flowering duration lasted 165 days in total. (2) The best pollen medium component was that 10 g/L sucrose, 0.1 g/L boracic acid, 0.05 g/L calcium chloride. (3) Pollen viability had vitality after flowering 6 hour to 6 days, and the highest pollen viability appeared two days after the flowering. (4) Stigma receptivity enhanced gradually from the third flowering day and disappeared 8 days later.【Conclusion】D.versicolorflowering patterns are changeable with a long time flowering period so it is a kind of valuable ornamental plant. Sucrose, boric acid and calcium chloride could promote the pollen germination. TTC staining method is an easy and accurate method to test pollen viability. This method tells us that stigma receptivity is the highest within the 4-6 flowing days.
Dianthusversicolor; culture media; pollen viability; stigma receptivity
10.6048/j.issn.1001-4330.2016.07.018
2016-03-16
上海科技兴农项目(214110008);新疆农业大学大学生创新创业训练计划项目(201510758003)
马际凯(1990-),男,贵州人,硕士研究生,研究方向为野生花卉引种栽培,(E-mail)xj_mjk@163.com
董连新(1963-),男,江苏人,副教授,博士,硕士生导师,研究方向为植物野生资源及分类,(E-mail)dlx-xj@163.com
S682.1+9
A
1001-4330(2016)07-1303-07

