丁苯酞对Wistar大鼠血管性痴呆模型中海马区OX-42的影响
姚 娟,高小平
(1.湖南省妇幼保健院特检科,长沙 410008;2.湖南省人民医院神经内科,长沙 410002)
丁苯酞对Wistar大鼠血管性痴呆模型中海马区OX-42的影响
姚 娟1,高小平2
(1.湖南省妇幼保健院特检科,长沙 410008;2.湖南省人民医院神经内科,长沙 410002)
目的:通过检测Wistar大鼠血管性痴呆模型中小胶质细胞表面补体III型受体OX-42在脑海马组织中的动态变化,探讨丁苯酞在血管性痴呆中的作用。方法:双侧颈总动脉永久结扎术(2-VO)建立Wistar大鼠血管性痴呆模型。设立正常对照组、假手术组、VD模型组、药物干预组。水迷宫试验对大鼠进行学习和记忆成绩测试。应用免疫组织化学法方法检测OX-42的表达。结果:模型组大鼠学习和记忆成绩下降,海马区OX-42的表达较正常对照组、假手术组均明显增加;药物干预组大鼠学习记忆能力明显改善,海马区OX-42的表达下降,与模型组比较差异有统计学意义。结论:慢性脑缺血血管性痴呆大鼠海马区OX-42表达升高;丁苯酞可能通过抑制了血管性痴呆大鼠海马区OX-42的表达,从而改善大鼠的学习记忆能力。
血管性痴呆;OX-42;丁苯酞;Wistar大鼠
血管性痴呆(vascular dementia,VD)是因各种原因导致的脑缺血缺氧性损害而引起的以认知功能障碍为主的一组临床综合征,而慢性脑缺血是血管性痴呆形成和发展的重要前提。近年来,越来越多的学者开始认为炎症反应对脑缺血后继发神经损伤、对血管性痴呆的发生发展起了重要作用[1]。海马对慢性脑缺血缺氧最为敏感,海马神经元受损可能是认知功能障碍的病理基础。研究发现[2],慢性脑缺血后神经胶质细胞的活动异常活跃,对学习记忆有很大影响。小胶质细胞(microglial cell,MG)在脑缺血后数小时内即可被激活,24h达到高峰,同时,MG的活化程度与慢性脑灌注不足所致脑损害的严重性是相平行的[3]。OX-42是小胶质细胞表面补体III型受体,激活小胶质细胞可导致OX-42的显著增加[4]。丁基苯酞(丁苯酞,3-n-butylphathlide,NBP)是我国自主开发的一类抗脑缺血药物,对急性缺血性脑卒中有明显疗效[5]。然而大量临床及动物研究表明[6-8],丁苯酞具有改善微循环和脑血流、抑制血小板聚集、减少氧化损伤、抗缺血后炎症反应、改善脑组织能量代谢、
抑制神经细胞凋亡等多种作用。因此推测其在血管性痴呆中可能具有抗炎症反应作用,其对OX-42表达的影响国内外尚未见有文献报道。本实验以OX-42为指标,研究它在不同时期海马组织中的表达;探讨丁苯酞对OX-42表达的影响,从而为临床血管性痴呆的防治寻找新的思路及理论依据。
1 资料与方法
1.1 实验动物 健康雄性wistar大鼠88只,体重约250~300g,12~14周龄,由湖南省人民医院动物实验室提供。
1.2 主要药品和试剂 OX-42小鼠抗大鼠单克隆抗体(sc-53086);丁苯酞原液。
1.3 动物分组和模型的制作 Wistar大鼠适应性喂养一周后随机分为4组:正常组8只、假手术组16只、VD模型组32只、药物干预组32只,其中每组又随机分为4个亚组:3天组、1周组、2周组、4周组,VD模型组和药物干预组各亚组每组8只。采用改良的双侧颈总动脉永久结扎术制作VD模型:正常组不予手术;假手术组仅作颈部皮肤切开,暴露双侧颈总动脉即可,不结扎;其他各组均行双侧颈总动脉永久结扎术(2-VO)。药物干预组予灌胃给药,将丁苯酞原液(98.9%)预先在药用植物油中稀释,按6mg/kg每天灌胃两次,于术后第2天即开始给药;VD模型组和正常组、假手术组大鼠灌饲等体积的药用植物油。
1.4 大鼠学习和记忆成绩测试 正常组、假手术组、VD模型组、药物干预组的4周组大鼠均在手术后第24天进行水迷宫试验,测试大鼠学习记忆成绩;根据Morris水迷宫原理,自制简易水迷宫。任意将水池分为4个象限。在任意一个象限内置1个直径为10cm,高15cm平台,使平台潜在水下约2cm,并在水中放入大量泡沫屑,使平台隐蔽。试验中环境保持不变,试验时使水温保持在25±2℃。将三角形、四方形、圆形等参照线索贴在水池周围固定的位置,使大鼠用来定位平台。试验包括①适应性训练:试验前一天让动物在无平台的水中适应性游泳2min。②定位航行试验:历时4天,每日3次,随机从之前划分的4个不同象限将大鼠面向池壁放入水中;倒计时120s,计算大鼠从入水到找到平台并爬上站稳的时间,即逃避潜伏期(Escape latency EL),站稳后必须停留10s;如果大鼠在120s内没有找到平台,我们则用手将大鼠牵引到平台上,让大鼠停留10s,再放回笼中,此情况成绩则计为120s;将EL作为大鼠的学习成绩,每天3次潜伏期的算术均值作为这一天的成绩进行统计分析。③空间探索试验:所有大鼠在定位航行试验全部完成后的第2天,任意选一个相同的入水点将大鼠放入池中,测定其120s内跨越平台的次数,此作为大鼠的记忆成绩。
1.5 标本的留取 3天组、1周组、2周组大鼠及4周组大鼠水迷宫实验完成后分别断头取脑。先用10%水合氯醛,剂量为0.3mL/100g,进行腹腔麻醉;迅速打开胸腔,暴露心脏;将9号穿刺针经左心室行主动脉插管,剪开右心耳,灌注生理盐水,至右心房流出的冲洗液转清后换4%多聚甲醛快速灌注。当颈部及前肢僵硬后开始断头取脑。取海马区脑组织放入4%多聚甲醛固定液浸泡固定24 h后,乙醇梯度脱水,常规石蜡包埋,制成4微米连续冠状切片。
1.6 观察指标 石蜡切片使用图像分析软件(Image-Pro Plus6.0 software)进行数据测量,在高倍镜下(×400)随机选取3个视野,测定每个视野的阳性反应面积百分比(阳性反应面积/视野面积×100%),取平均值表示阳性染色强度。所有测量均在相同的条件下进行。
1.7 统计学处理 所有实验数据输入SPSS13.0统计软件包进行统计分析,数据以均数±标准差表示,P<0.05认为差异有统计学意义。
2 结果
2.1 大鼠学习和记忆成绩测定结果 造模后第24天将4周组大鼠行Morris水迷宫实验,历时5天,将前4天测得的逃避潜伏期作为大鼠的学习成绩,将第5天测得的大鼠穿越平台的次数作为记忆成绩,穿越次数越多表示记忆功能越好。与正常组及假手术组比较,VD模型组和药物干预组的逃避潜伏期明显延长,穿越平台的次数明显减少(P<0.05);与VD模型组比较,药物干预组的逃避潜伏期缩短,穿越平台的次数增多,两者之间比较差异具有统计学意义(P<0.05)。见表1。
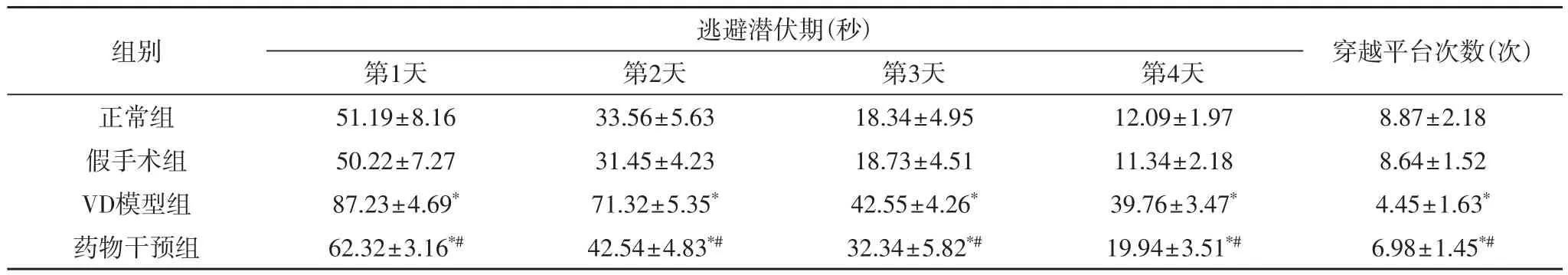
表1 4组大鼠水迷宫实验数据
2.2 OX-42免疫组化检测结果 正常组(图1 A)和假手术组(图1 B)海马区小胶质细胞活化数量少,仅见少量OX-42阳性细胞表达,胞体较小,分支少,染色较浅。
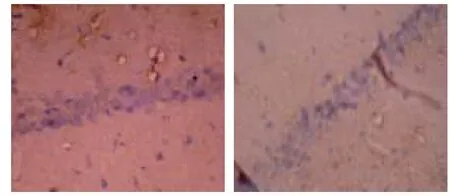
图1 正常组和假手术组OX-42免疫组化检测结果
VD模型3天组(图A)OX-42阳性细胞表达开始增加;1周组(图B)海马区小胶质细胞数量明显增多,胞体肥大,呈圆形,呈阿米巴状或多分支状,胞浆呈棕黄色深染,较3天组阳性细胞面积比明显升高并达到高峰,2周组(图C)、4周组(图D)阳性细胞数逐渐减少;图a-d分别是各时间点的药物干预组,其阳性细胞表达较VD模型组均有减少。
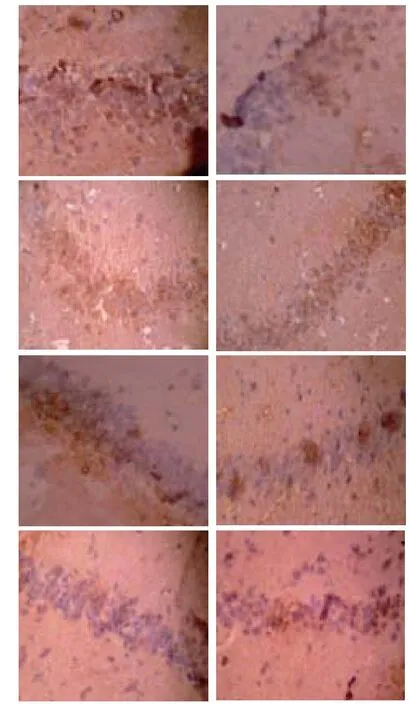
图2 VD模型3天组、1周组、2周组OX-42免疫组化检测结果(DAB染色10×40)
2.3 各组大鼠海马组织中OX-42阳性细胞面积百分比比较 OX-42为小胶质细胞表面补体III型受体,大多在活化的小胶质细胞中表达,为细胞膜或细胞浆染色,以出现棕褐/黄色染色为阳性信号。正常组和假手术组海马区小胶质细胞活化数量少,仅见少量OX-42阳性细胞表达,胞体较小,分支少,染色较浅,通过计算阳性细胞面积百分比,正常组和假手术组之间没有显著性差异(P>0.05);在VD模型3天组中OX-42阳性细胞表达开始增加,1周组较3天组阳性细胞面积比明显升高并达到高峰,与正常组及假手术组比较差异均有统计学意义(P<0.01),与3天组比较,差异亦有统计学意义(P<0.01);2周组OX-42阳性细胞较1周组有所减少,4周组阳性细胞数较2周组也有明显减少,与正常组及假手术组阳性细胞面积比的比较差异均有统计学意义(P<0.01),与3天组、1周比较,差异亦有统计学意义(P<0.01)。药物干预组各个时间点的阳性细胞表达均比VD模型组的下降,并且下降的趋势与峰值时间点均与VD模型组相似,各组小胶质细胞的上述改变明显减轻,与正常组及假手术组比较,阳性细胞面积比差异有统计学意义(P<0.01);与VD模型组的各个相同时间点的阳性细胞面积比比较差异均有统计学意义(P<0.05)。见表2。
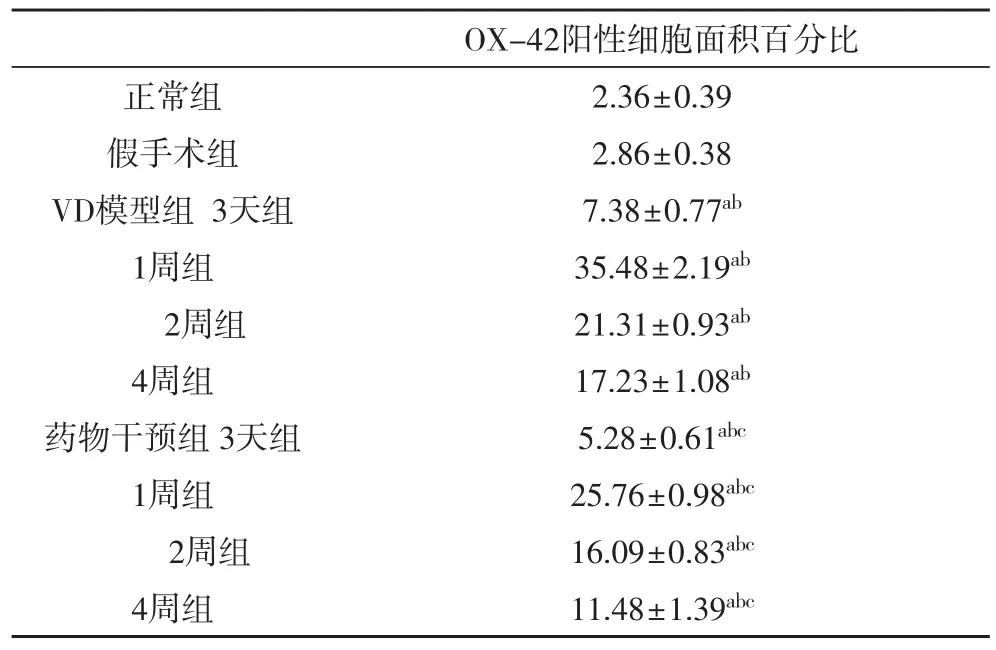
表2 各组大鼠海马组织中OX-42阳性细胞面积百分比
3 讨论
丁基苯酞(丁苯酞,3-n-butylphathlide,NBP)又名芹菜甲素,是从芹菜种籽中分离出的有效成分,是我国自主开发的一类抗脑缺血药物,具有改善微循环和脑血流、抑制血小板聚集、减少氧化损伤、抗缺血后炎症反应、改善脑组织能量代谢、抑制神经细胞凋亡等多种作用。
小胶质细胞是中枢神经系统中最小的一种胶质细胞,约占全部胶质细胞的5%,一般处于静止或休眠状态[9,10]。作为中枢神经系统重要的免疫活性细胞,被视为“大脑中的清道夫”[4]。在一些病理改变如感染、损伤、缺血和炎症的作用下可被迅速激活[11]。活化的小胶质细胞呈阿米巴样形态的转变,促进这些细胞迁徙
到损伤区域。OX-42是其表面补体III型受体,为活化的小胶质细胞的特异性标记。
作为中枢神经系统病理事件的传感器,小胶质细胞的活化是在损伤的早期阶段。其在脑缺血后数小时内即可被激活,24h达到高峰,刺激活化后,其抗原性增强,形态伸展呈阿米巴样,发挥吞噬作用。小胶质细胞激活后,能释放和激活细胞毒性产物,如活性氧、氮、促炎症因子、蛋白酶等,从而启动炎症反应和诱导细胞凋亡[12]。慢性脑缺血时,可通过以下途径启动炎症级联反应:①慢性脑缺血时缺血脑组织(小胶质细胞、星型胶质细胞、神经元等)中存在的Toll样受体可与内源性配体(损伤、坏死的细胞产生的热休克蛋白、胞外基质降解产物、神经介质、细胞因子、DNA和RNA等物质)相结合,受体-配体结合后通过细胞内信号转导通路使转录因子NF-κB从细胞质迅速转入核内,从而调节下游炎症基因(TNF-α、IL-1β等)的表达,激活炎症细胞,引起正反馈式的炎症级联反应,加重慢性脑缺血神经元的损伤[13,14];②慢性脑缺血后,由于内皮细胞粘附分子上调,促使炎症细胞的浸润(先中性粒细胞浸润,进而巨噬细胞和单核细胞),同时大脑中定植的小胶质细胞与星型胶质细胞等因能量障碍等各种因素被过度激活,引起促炎症因子(TNF-α、IL-1β、IL-8等)及神经毒素(NO、活性氧等)的释放,从而引起神经元的损害[15,16]。研究认为[17],小胶质细胞激活、增殖后通过自分泌或旁分泌方式产生神经毒物/炎症介质如白细胞介素(interleukin,ILs)、干扰素(interferon)、肿瘤坏死因子(tumor necrosis factor,TNFs)、NO等;同时,由于缺血所产生的兴奋性氨基酸、炎性因子、自由基、NO等,也反馈性加重小胶质细胞活化的效应,进而导致恶性循环。
本实验免疫组化结果显示,正常组和假手术组海马区仅见少量OX-42阳性细胞表达,在VD模型3天组表达开始升高,随着时间的延长至1周时OX-42阳性细胞表达达到高峰,之后呈逐渐下降趋势,提示小胶质细胞的活化不仅在脑缺血的早期发生反应,而是贯穿于慢性脑缺血的整个病理过程。同时小胶质细胞能调节脑内免疫炎症反应,它分泌的抗炎物质和神经保护物质如神经营养因子又能促进神经细胞功能的恢复[18]。小胶质细胞活化后产生的一系列细胞因子和神经毒性物质,在慢性脑缺血期能抑制小胶质细胞的活性,减少炎症介质过度的释放,小胶质细胞在脑缺血的不同时间起到不同的作用,在慢性脑缺血后数天甚至数周有神经保护作用[19],因此OX-42的表达在慢性脑缺血后期呈逐渐下降趋势。
本次实验用2-VO法建立大鼠血管性痴呆模型,它能减少大鼠1/3的脑血流量,其中对海马组织缺血影响较大[20],而空间学习和记忆主要取决于海马的完整性,因此能导致渐进性的认知功能下降。4周组水迷宫实验结果显示丁苯酞药物干预组大鼠逃避潜伏期较模型组短,穿越平台的次数多,可说明丁苯酞能减小慢性脑缺血所致的学习和记忆损害。Suh[21]等研究提出脑血流量的减少,以及慢性脑缺血伴随的能量代谢障碍可导致选择性的神经损伤,尤其在对缺血敏感的海马区。我们从免疫组化的结果中可发现,丁苯酞药物干预组中OX-42的表达明显低于VD模型组,说明丁苯酞可能通过抑制小胶质细胞的激活,从而起到脑保护作用。
本实验通过建立大鼠血管性痴呆模型,研究了慢性脑缺血后OX-42的表达变化及丁苯酞干预后两者的表达情况。通过实验结果我们可以看出,丁苯酞抑制了OX-42的表达,提示可能对脑神经细胞有保护作用。
[1] Kettenmann H, Hanisch UK, Noda M, et al. Physiology of microglia[J]. Physiol Rev, 2011, 91(2): 461–553.
[2] Dheen ST, Kaur C, Ling EA. Microglialactivation andits implications in thebrain diseases[J]. Curr Med Chem, 2007, 14(11): 1189-1197.
[3] Block ML, Zecca L, Hong JS. Microglia-mediated neurotoxicity: uncovering the molecular mechanisms[J]. Nat Rev Neurosci, 2007, 8(1): 57-69.
[4] Liu B, Gao HM, Hong JS. Parkinson's disease and exposure to infectious agents and pesticides and the occurrence of brain injuries: role of neuroinflammation[J]. Environ Health Perspect, 2003, 111(8): 1065-1073.
[5] 王松柏, 姚咏明, 董宁, 等. JAK/STAT通路介导脓毒症大鼠肝组织高迁移率族蛋白B1mRNA表达的研究[J]. 中国危重病急救医学, 2003, 15(3): 147-149.
[6] Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necroticcells triggers inflammation[J]. Nature, 2002, 418(6894): 191-195.
[7] Yang H, Wang H, Czura C, et al. The cytokine activity of HMGB1[J]. J Leukoc Biol, 2005, 78(1): 1-8.
[8] Yang QW, Wang JZ, Li JC, et al. High-mobility group protein box-1 and its relevance to cerebral ischemia[J]. J Cereb Blood Flow Metab, 2010, 30(2): 243-254.
[9] Walter L, Neumann H. Role of microglia in neuronal degeneration and regeneration[J]. Semin Immunopathol, 2009, 31(4): 513-525.
[10] Nakajima K, Kohsaka S. Microglia: activation and their significance in the central nervous system[J]. J Biochem, 2001, 130(2): 169-175.
[11] Lotze MT, Tracey KJ. High-mobility group box 1 protein(HMGB1): nuclear weapon in the immune arsenal[J]. Nat Rev Immunol, 2005, 5(4): 331-342.
[12] Dumitriu IE, Baruah P, Manfredi AA, et al. HMGB1: guiding immunity from within[J]. Trends Immunol, 2005, 26(7): 381-387.
[13] Ulloa L, Messmer D. High-mobility group box 1(HMGB1)protein: friend and foe[J]. Cytokine Growth Factor Rev, 2006, 17(3): 189-201.
[14] Oppenheim JJ, Yang D. Alarmins: chemotactic activators of immune responses[J]. Curr Opin Immunol, 2005, 17(4): 359-365.
[15] Bianchi ME. DAMPs, PAMPs and alarmins: all we need to know about danger[J]. J Leukoc Biol, 2007, 81(1): 1-5.
[16] Wang H, Vishnubhakat JM, Bloom O, et al. Proinflammatory cytokines(tumor necrosis factor and interleukin 1)stimulate release of high mobility group protein-1 by pituicytes[J]. Surgery, 1999, 126(2): 389-392.
[17] Agnello D, Wang H, Yang H, et al. HMGB-1, a DNA-binding protein
with cytokine activity, induces brain TNF and IL-6 production, and mediates anorexia and taste aversion[J]. Cytokine, 2002, 18(4): 231-236.
[18] O'Connor KA, Hansen MK, Rachal Pugh C, et al. Further characterization of high mobility group box 1(HMGB1)as a proinflammatory cytokine: central nervous system effects[J]. Cytokine, 2003, 24(6): 254-265.
[19] Passalacqua M, Patrone M, Picotti GB, et al. Stimulated astrocytes release high-mobility group 1 protein, an inducer of LAN-5 neuroblastoma cell differentiation[J]. Neuroscience, 1998, 82(4): 1021-1028.
[20] Takata K, Kitamura Y, Tsuchiya D, et al. High mobility group box protein-1 inhibits microglial Abeta clearance and enhances Abeta neurotoxicity[J]. J Neurosci Res, 2004, 78(6): 880-891.
[21] Goldstein RS, Gallowitsch-Puerta M, Yang L, et al. Elevated highmobility group box 1 levels in patients with cerebral and myocardial ischemia[J]. Shock, 2006, 25(6): 571-574.
The effect of NBP on the expression of OX-42 of hippocampus in wistar rats with vascular Dementia
Yao Juan1, Gao Xiao-ping2
(1. Hunan Provincial Maternal and child health care hospital, Changsha 410008, China; 2. Hunan Provincial People's Hospital, Changsha 410002, China)
Objective To investigate the dynamic variation of OX-42 in hippocampus tissue after vascular dementia(VD) model in Wistat rats, to explore their effects in vascular dementia. To investigate the effects of Butylphthalide(NBP)on OX-42 after VD model in rats, and clarify the possible mechanism of NBP. Methods The vascular dementia modelin Wistar rats were established bypermanentbilateral commoncarotid arteryocclusion method. Wistar rats were divided into 4 groups: normal group, sham-operated group, VD model groupand NBP treatment group. Then the learning and memory capabilities of rats were tested by Morris water maze. Meanwhile, the expression of OX-42were measured with methods of immunohistochemistry. Results Compared with the normal group and sham-operated group, the abilities of learning and memory apparently decresed in VD model group, and the expression of OX-42 significantly increased in VD model group. Besides, NBP treatment groupsignificantlyimproved learning and memory abilities, and compared with the VD model group, the expression of OX-42 significantlyreduced in NBP treatment group. Conclusion OX-42 expression were significantly increased in hippocampusof chronic cerebral ischemia rats. Butylphthalidemight reduced expression of OX-42, and could improve learning and memory abilities of VD rats.
vascular dementia; OX-42; butylphthalide; wistar rat
R743;R96
A
1673-016X(2016)05-0133-05
2016-07-26
高小平,E-mail:gaoxiaoping1962@126.com

