改良的硼替佐米联合方案治疗多发性骨髓瘤患者的疗效评价
陈 丽,胡国瑜,袁朝晖
(株洲市中心医院血液科,株洲 412000)
改良的硼替佐米联合方案治疗多发性骨髓瘤患者的疗效评价
陈 丽,胡国瑜,袁朝晖
(株洲市中心医院血液科,株洲 412000)
目的:探讨改良的硼替佐米联合方案治疗多发性骨髓瘤患者的临床价值。方法:选取我院2010年4月~2016年4月多发性骨髓瘤患者共60例,其中改良组28例采用改良的硼替佐米联合化疗方案,常规组32例采用硼替佐米常规方案治疗,观察其疗效和不良反应。结果:随访3~48(平均23)个月后,改良组有效率为78.6%,与对照组有效率78.1%比较差异无统计学意义。硼替佐米不良反应主要包括周围神经病变(PN)、血小板减少、粒细胞减少、疱疹、肺部感染、胃肠道反应等。改良组PN发生率10.7%,明显低于对照组PN发生率31.3%,其它不良反应发生率无明显差异。对照组1例因肺部严重感染抢救无效死亡,观察组无死亡病例。结论:多发性骨髓瘤患者采用改良的硼替佐米联合方案不影响疗效,且不良反应少,安全性更高,患者耐受性更好。
多发性骨髓瘤;硼替佐米;不良反应
多发性骨髓瘤(MM)是属于浆细胞恶性增殖性疾病,约占血液系统恶性肿瘤的10%,是中老年人群常见的血液肿瘤之一。中位发病年龄57~63岁,其发病率随年龄增加而增加[1]。随着MM新药的开发和应用,极大的提高了多发性骨髓瘤的疗效,其中以硼替佐米为基础的联合化疗方案更是使MM的有效率得到很大的提高,生存时间明显的延长[2-3]。但其也存在一些严重不良反应如周围神经病变、感染、带状疱疹等,甚至影响多发性骨髓瘤患者的继续治疗。怎么选取一种有效,且患者能很好耐受的化疗方案是保证患者治疗、延长患者生存期的关键。在本研究中,我们在常规的硼替佐米为基础的联合化疗方案的基础上对其改良,调整硼替佐米的用药频率、剂量和给药方式,并与常规硼替佐米联合方案进行对比,观察其疗效和不良反应,现报告如下。
1 资料与方法
1.1 一般资料 选取于2010年4月~2016年4月在我院接受硼替佐米为基础的联合方案治疗的多发性骨髓瘤患者共60例。诊断依据国际骨髓瘤工作组(IMWG)2003年提出的诊断标准,分期分别采用Durie-Salmon(D-S)分期和2005年IMWG提出的国际分期系统(ISS)。其中男35例,女25例,初治43例,复发/难治17例。接受硼替佐米改良方案(改良组)28 例,硼替佐米常规方案32例(常规组),组间一般资料比较无统计学差异(P>0.05),具有可比性。
1.2 实验分组与处理 将60例多发性骨髓瘤患者分为改良组和常规组,观察组(28 例),采用硼替佐米1.6mg/m2/d,于第1、8天皮下注射,地塞米松 20mg/d,第1~4、9~12天静脉滴注。对照组(32例),采用硼替佐米 1.3mg/m2/d,第1、4、8、11天静脉注射,地塞米松20mg/d 第1~2、4~5、8~9、11~12天静脉滴注。两组患者均加用蒽环类药物或环磷酰胺。所有病例均21天为1个疗程。治疗期间若出现严重的感染或是IV级骨髓抑制,需在基本控制感染和血象达标后再行化疗。若出现严重不能耐受的不良反应须停药。
1.3 疗效判定和不良反应评价 疗效判断参照国际多发性骨髓瘤(IMWG)标准[4],每个疗程结束后进行评估。疗效分为CR即完全缓解,VGPR即非常好的部分缓解,PR即部分缓解,MR即轻微反应,SD即病情稳定,PD即病情进展。有效率为CR+VGPR+PR,不良反应参照美国国立癌症肿瘤研究所常见毒性反应标准(NCICTCAE)3.0版进行判定[5]。所有患者通过随访观察治疗效果,随访时间不一,短则3个月,长则48个月,平均为23个月。有效例数为CR、VGPR、PR总和。
1.4 统计学方法 采取统计学软件SPSS16.0对上述数据处理,计量资料以均数±标准差形式表示,实施t检验。计数采取率(%),组间率对比采取χ2检验,对比以P<0.05有统计学意义。
2 结果
2.1 两组患者疗效比较 通过治疗后随访3~48个月不等,结果发现,改良组28例患者治疗有效例数为22例,有效率为78.6%,而常规组32例患者治疗有效例数为25例,有效率为78.1%,两组比较无明显差异(P>0.05)。结果见表1。
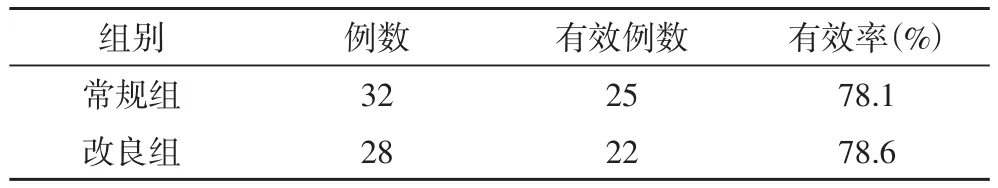
表1 两组患者的疗效比较
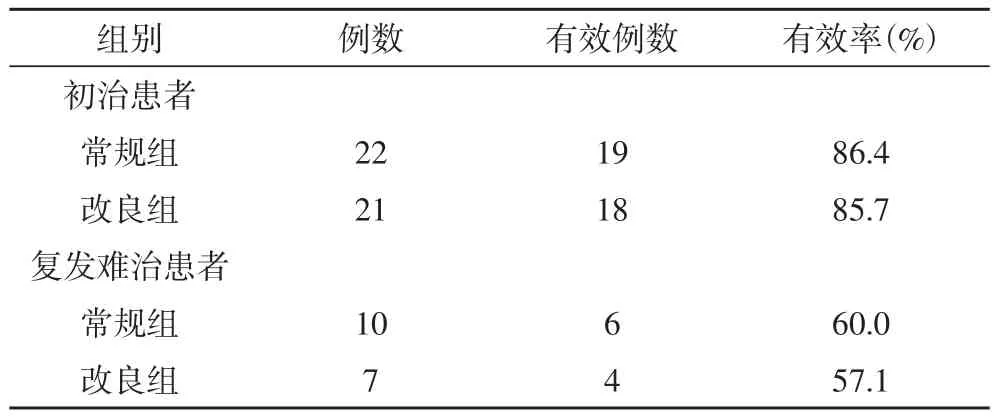
表2 两组初治、复发难治患者疗效比较
2.2 两组初治、复发难治患者疗效比较 表2结果显示,对于初治患者来说,改良组21例,有效例数为18例,有效率为85.7%,常规组22例,有效例数为19例,有效率为86.4%,两组比较无明显差异(P>0.05);在复发难治患者中,改良组7例,有效例数为4例,有效率为57.1%,常规组10例,有效例数6例,有效率为60%,两组比较差异无统计学意义(P>0.05)。中位显效时间分别为4(2~6)周和4(3~6)周,组间比较差异无统计学意义(P>0.05)。
2.3 两组患者不良反应比较 硼替佐米不良反应主要包括周围神经病变(PN)、血小板减少、粒细胞减少、疱疹、肺部感染、胃肠道反应等。表3结果显示,改良组血小板减少、粒细胞减少、疱疹、肺部感染和胃肠道反应的发生率,与常规组比较差异无统计学意义(P>0.05);改良组PN发生率明显低于常规组,差异有统计学意义(P<0.05)。改良组中有1例出现3级以上PN,经对症治疗后症状缓解,接受继续治疗。常规组中有3例发生3级以上PN不良反应,经对症治疗后,1例症状好转,2例终止治疗;常规组1例因肺部严重感染抢救无效死亡,观察组无死亡病例。
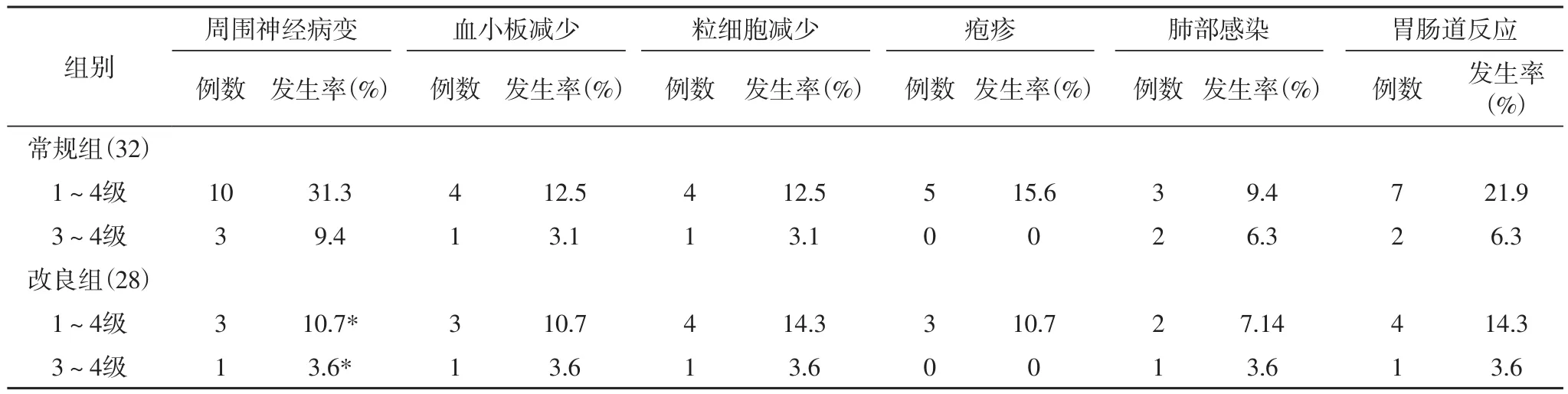
表3 两组患者不良反应比较
3 讨论
多发性骨髓瘤(MM)是血液系统第二常见恶性肿瘤,对患者的生命构成了严重威胁。传统药物治疗时代,MM患者的中位生存期仅为3~4年,CR率低,仅为3%~10%[6]。随着新药如硼替佐米和造血干细胞移植术的应用,MM的治疗有效率获得了极大的提高,CR率达30%~50%[7]。但作为目前仍不能治愈的疾病,延长MM患者生存期、提高患者生存质量至关重要,近期研究显示,延长治疗方案可改善MM患者的预后[8]。而硼替佐米治疗相关毒性反应的发生,使部分MM患者的治疗用药减量甚至终止,影响患者的生存期和生活质量。
硼替佐米的不良反应包括周围神经病变(PN)、骨髓抑制、疱疹、感染、胃肠道反应等,其中最主要的不良反应为外周神经毒性,2级以上的PN往往致残,严重影响患者的生存质量,甚至导致患者不能继续接受治疗。San Miguel 等[9]报道MM诱导治疗应用硼替佐米联合马法兰、强的松(VMP),接近一半(46%)出现严重不良反应,近1/3中止VMP或硼替佐米的治疗。另外一些报道显示,在一些新诊断的MM中,硼替佐米导致的PN发生率达到47%~64%,其中14%~30%的患者药物减量或停药[10-11]。为减少药物不良反应,国内外不少学者尝试改变硼替佐米的给药时间、给药剂量和给药方式,确保患者能坚持用药,延长治疗时间,从而为改善患者的预后提供机会。一项研究[12]显示硼替佐米单药静脉注射,1.6mg/m2,每周1次,治疗复发难治的MM,其有效率为55%,大部分患者耐受性好,骨髓抑制作用轻,严重PN发生率低。Donna[13]等报道,分别应用硼替佐米1.6mg/ m2,每周1次,应用4周,休息1周,每35天为一个疗程;以及硼替佐米1.3 mg/m2每周2次,每21天为一个疗程,治疗复发的原发淀粉样变性,两组起效时间为2.1和3.2个周期,有效率类似(78.8%和75.5%),1年无疾病进展率为72.2%和74.6%,1年总生存率为93.8%和84%,不良反应导致终止治疗比例为38%和53%,显示硼替佐米1.6mg/m2每周1次方案更好的耐受性及更高的安全性。国内魏道琳等[14]报道硼替佐米1.6mg/m2.d,第1,8天静脉注射,与常规方案相比,疗效类似,安全性好。在改变用药方式上,Moreau 等[15]观察两组MM分别接受静脉注射与皮下注射1.3mg/m2的硼替佐米,
显示两组的总缓解率相同,而PN发生率分别为53%与38%,提示皮下注射硼替佐米不影响疗效,且能降低药物毒性,允许患者接受继续治疗。
基于以上研究结果,我们尝试改变硼替佐米的用药方式,单次用药剂量,以及延长硼替佐米两次用药的时间间隔。在疗效上比较,无论在初治和复发/难治患者,改良组与常规方案组相比,患者的CR率、VGPR率和有效率比较,均无统计学差异,改良方案初治患者有效率为85.7%,复发/难治有效率57.1%,总有效率与国外报道[9,10,12]类似,显示出改良方案在MM的治疗中显著的疗效。
而在不良反应方面,改良组骨髓抑制(粒细胞减少、血小板减少)、带状疱疹、肺部感染、胃肠道反应等发生率与常规方案组相比,差异无统计学意义。但改良组的PN发生率10.7%,低于常规方案组31.3%,差异有统计学意义,这与Hainsworth[12]等观察的结果类似,显示在改变硼替佐米用药方式(皮下注射)、用药剂量(1.6mg/ m2/d)和给药频率(每周1次)后,可能会减少周围神经病变等不良反应的发生,其不良反应的减少可能与延长硼替佐米两次给药间隔时间有关(每周1次),今后尚需进行大样本的随机对照临床试验。在本研究中,改良组在治疗过程中未发生死亡病例,1例发生3级以上的PN,经治疗后症状缓解,允许患者能进行更长期的治疗,从而为改善患者的预后可能提供了机会。同时与常规方案相比,改良方案的成本较低,能减轻患者的经济负担。
综上所述,采用硼替佐米1.6mg/m2/d,第1,8天皮下注射,同时联合吡柔比星或环磷酰胺、地塞米松,可显著改善MM患者疗效,同时能减少不良反应发生率,降低患者的治疗费用,为MM患者的治疗提供了一种新的选择。
[1] Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1): 9-29.
[2] Kumar S, Flinn I, Richardson PG, et al. Randomized, multicenter, phase 2study(EVOLUTION)of combinations of bortezomib, dexamethasone, cyclophosphamide, and lenalidomide in previously untreated multiple myeloma[J]. Blood, 2012, 119(19): 4375-4382.
[3] 赵冰冰, 王焰, 糜坚青, 等. 硼替佐米为主的化疗方案对改善初治多发性骨髓瘤患者生存的作用[J]. 上海交通大学学报(医学版), 2011(12): 1793-1796.
[4] Durie BG, Harousseau JL, Miguel JS, et al. International uniform response criteria for multiple myeloma[J]. Leukemia, 2006, 20(9): 1467-1473.
[5] Trotti A, Colevas AD, Setser A, et al. CTCAE v3.0: development of a comprehensive grading system for the adverse effects of cancer treatment[J]. Semin Radiat Oncol, 2003, 13(3): 176-181.
[6] 李佳丽, 刘耀, 曾东风, 等. 硼替佐米联合地塞米松和沙利度胺治疗多发性骨髓瘤的临床研究[J]. 第三军医大学学报, 2012, 34(24): 2515-2517.
[7] 侯健, 刘肸. 新药时代多发性骨髓瘤的治疗目标[J]. 中国肿瘤临床, 2014, 41(13): 823-826.
[8] Mateos MV, Richardson PG, Dimopoulos MA, et al. Effect of cumulative bortezomib dose on survival in multiple myeloma patients receiving bortezomib-melphala-prednisone in the phase III VISTA study[J]. Am J Hematol, 2015, 90(4): 314-319.
[9] San Miguel JF, Schlag R, Khuageva NK, et al. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma[J]. N Engl J Med, 2008, 359(9): 906-917.
[10] Dimopoulos MA, Richardson PG, Schlag R, , et al. VMP(Bortezomib, Melphalan, and Prednisone)is active and well tolerated in newly diagnosed patients with multiple myeloma with moderately impaired renal function, and results in reversal of renal impairment: cohort analysis of the phase III VISTA study[J]. J Clin Oncol, 2009, 27(36): 6086-6093.
[11] Richardson PG, Xie W, Mitsiades C, et al. Single-agent bortezomib in previously untreated multiple myeloma: efficacy, characterization of peripheral neuropathy, and molecular correlations with reponse and neuropathy[J]. J Clin Oncol, 2009, 27(21): 3518-3525.
[12] Hainsworth JD, Spigel DR, Barton J, et al. Weekly treatment with bortezomib for patients with recurrent or refractory multiple myeloma: a phase 2 trial of the Minnie Pearl Cancer Research Network[J]. Cancer, 2008, 113(4): 765-771.
[13] Reece DE, Hegenbart U, Sanchorawala V, et al. Efficacy and safety of once-weekly and twice-weekly bortezomib in patients with relapsed systemic AL anyloidosis: results of a phase 1/2 study[J]. Blood, 2011, 118(4): 865-873.
[14] 魏道林, 赵初娴, 赵昱, 等. 改良的以硼替佐米为基础的联合化疗方案治疗多发性骨髓瘤患者的临床疗效[J]. 中华血液学杂志, 2014, 35(9): 854-856.
[15] Moreau P, Pylypenko H, Grosicki S, et al. Subcutaneous versus intravenous administration of bortezomib in patients with relapsed multiple myeloma: A randomized, phase 3, noninferiority study[J]. Haematologica, 2015, 100(5): e207-210.
Clinical efficacy of modified bortezomib-based combination therapy treating Multiple myeloma
Chen li, Hu Guo-yu, Yuan Zhao-hui
(Department of Hematology, the Central Hospital of Zhuzhou, Zhuzhou 412000, China)
Objective To evaluate the clinical value of the modified bortezomib-based combination therapy treating multiple myeloma(MM). Methods Sixty patients with MM from April 2010 to April 2016 were analyzed retrospectively.28 patients were treated with modified bortezomib-based combination chemotherapy(modified group).32 patients were treated with normal bortezomib-based combination therapy(Control group). Observing the efficacy and adverse events of the two groups. Results The median follow-up time was 23 months(3~48). The effective rate was 78.6% in the modified group, the effective rate of the control group was 78.1%, there was no statistical significance in two groups. The major adverse events during treatment were peripheral neuropathy(PN), gastrointestinal disorder, herpes zoster, infection and hematology toxicity. The incidence of peripheral neuropathy was 10.7% in the modified group is Significantly lower the control group(31.3%). In the control group, 1 patient had died because of severe pulmonary infection, 3 patients developed grade 3/4 PN, 2 of them discontinued therapy. Conclusion The modified bortezomib-based combination therapy is well tolerated and ia an effective regimen in treatment of MM, The adverse effects are lighter than the normal regimen of bortezomib-based combination therapy.
multiple myeloma; bortezomib; adverse events
R473.73
A
1673-016X(2016)05-0129-04
2016-07-29
陈丽,E-mail:39522482@qq.com

