羟基自由基杀灭压载水中有害赤潮物种的生物有效性研究
程超,白敏冬,郑琦琳,陈操,孟祥盈,张芝涛
(1.大连海事大学轮机工程学院,辽宁大连116026;2.厦门大学环境与生态学院,福建厦门361005;3大连海事大学环境工程研究所,辽宁大连116026)
羟基自由基杀灭压载水中有害赤潮物种的生物有效性研究
程超1,白敏冬2,3*,郑琦琳2,陈操1,孟祥盈1,张芝涛3
(1.大连海事大学轮机工程学院,辽宁大连116026;2.厦门大学环境与生态学院,福建厦门361005;3大连海事大学环境工程研究所,辽宁大连116026)
本研究采用大气压下强电离放电协同气液混溶技术,高效制备羟基自由基(·OH)杀灭3个门的典型有害赤潮物种,使用荧光染色、测定光合作用潜能等生物学检测方法确定·OH致死阈值。结果表明,5.05×104cells/m L的赤潮异弯藻(Heterosigma akashiwo)、5.28×104cells/mL的亚历山大藻(Alexandrium tamarense)和5.02×104cells/mL的中肋骨条藻(Skeletonema costatum),其致死阈值分别为1.24 mg/L、2.01 mg/L、1.12 mg/L,此时其叶绿素a分解率分别为77%、85%和74%。利用光学显微镜观察,处理前后藻细胞结构有明显的改变。因此,·OH致死方法可有效地杀灭压载水中的有害赤潮藻。
羟基自由基;赤潮藻;致死阈值
1 引言
赤潮是一种海洋生态异常现象,它的大面积频繁发生,导致海洋生态系统的结构与功能几乎彻底崩溃,我国沿海赤潮爆发的主要成因之一是通过船舶压载水迁移到中国海域的外来赤潮藻。这些外来藻类对生态适应性强、分布广,只要环境适宜就可爆发赤潮,几乎导致海洋生态结构与功能的崩溃[1—3]。为切断海洋生物入侵的主要途径,2004年国际海事组织(IMO)通过了《国际船舶压载水和沉积物管理与控制公约》,制定了严格的压载水排放标准(D-2)。即将强制执行的D-2压载水排放标准规定:尺寸大于50μm的入侵生物少于10个/L;10~50μm的入侵生物少于10个/mL[4]。因此,亟待发明一种高效杀灭船舶压载水中海洋入侵藻的方法。
近年来,国内外学者做了大量杀藻的研究,化学方法主要包括硫酸铜法(CuSO4)、氯法(NaClO)、臭氧法(O3)等。Ebenezer等[5]研究利用CuSO4杀灭1.3 ×107cells/m L多环旋沟藻,投加量为5 mg/L,经过1 d时间的处理,可致死100%的藻。但研究指出CuSO4杀藻时间长,具有毒性,药剂在海水中不能分解、消失,将长期伤害非赤潮海洋生物,影响海洋生态环境。Tsolaki等[6]研究电解海水产生NaClO等活性物质杀灭压载水中的藻类,对于1×104cells/mL的甲藻,致死CT值200 mg·min/L;但电解法对赤潮藻的杀灭效果受海水盐度高低的制约较大,残余氧化剂浓度高、处理时间长,电解会产生氢气,存在爆炸隐患,排放压载水含有三卤甲烷、卤代乙酸、卤代乙腈等化学副产物,海洋生态不安全[7—9]。Oemcke和Van[10]研究表明,臭氧法杀灭压载水中的前沟甲藻,投加臭氧量5~10 mg/L,处理时间6 h,可有效处理压载水中的藻;Warschkun[9]等指出O3处理压载水会形成化学副产物,如溴酸盐等,会对海洋生态造成潜在的威胁。
在研究治理海洋外来赤潮藻的方法时,应遵循高级氧化技术[11—12](AOT或AOP)的原则,其核心是羟基自由基(·OH)。·OH是强氧化剂(氧化还原电位2.80 V),可低剂量致死赤潮藻;·OH反应速率达到109mol/(L·s),是O3的107倍,可在数秒内快速致死赤潮藻;·OH是绿色的氧化剂,剩余·OH分解成H2O、O2,不会对海洋生态造成负面影响。此外,·OH致死生物的剂量与生物体的比表面积成反比,海洋浮游生物与海洋中小型生物如鱼虾的比表面相差甚大,致死赤潮藻类的·OH剂量对鱼虾等海洋生物几乎无影响。
本研究使用1.0 t/h的小型处理系统,以3种典型的赤潮藻作为研究对象,即赤潮异弯藻(Heterosigma akashiwo)、亚历山大藻(Alexandrium tamarense)、中肋骨条藻(Skeletonema costatum),对其进行杀灭研究,以SYTOX Green荧光染色结合叶绿素荧光参数Fv/Fm值来确定·OH致死的阈值浓度,并对细胞形态进行观察和分析。
2 材料和方法
2.1实验材料
实验藻种:赤潮异弯藻(H.akashiwo)、亚历山大藻(A.tamarense)、中肋骨条藻(S.costatum),购置于厦门大学国家重点实验室藻种库。使用三角烧瓶以f/2培养液单种培养,培养温度(20±1)℃,光照2 000 lx,光暗比为14L∶10D。利用显微镜(OLYMPUS)对藻细胞的活性进行监测,并通过直接计数法计算藻细胞密度。同时检测藻液的吸光度,待细胞生长至对数期进行实验。实验所用海水取自大连塔河湾,经沉淀沙滤,0.45μm混合纤维滤膜过滤和高温消毒,冷却后待用。
2.2实验流程
利用大气压强电场强电离放电方法,在等离子体源的窄间隙放电空间中,放电电场强度E大于等于100 k V/cm,电子平均能量大于等于10 eV,电子密度大于等于1014cm-3,电离占空比大于等于2%,大量电子具有将O2电离(12.5 eV)、离解(8.6 eV)的高能量,可生成高浓度的氧等离子体O+2、O(1D)、O(3P)、O3等氧活性粒子[13]。并通过文丘里高速射流作用在水中生成等氧自由基溶液,以·OH为主包括HO-2、O2·-、O3·-、HO3·、H2O2等,其浓度定义为总残余氧化剂TRO(Total Residual Oxidant)。从液液混容器出口到取样点处理时间为1 s,在此管道传输过程中,·OH杀灭压载水中的藻类。图1给出实验流程系统。

图1 实验流程系统图Fig.1 Schematic process of the experiment system
2.3检测方法
2.3.1TRO检测
TRO浓度采用N,N-二乙基对苯二胺(DPD,美国EPA方法8016)法[14],使用CECIL-CE2501紫外分光光度计检测,在处理系统中采用美国HACHCL17型余氯在线分析仪检测。·OH浓度以对羟基苯甲酸(4-HBA)作为捕捉剂,通过Dionex Ultimate 3000高级液相色谱(HPLC)测定其生成产物三四羟基苯甲酸(3,4-DHBA)的浓度来测定[15]。
2.3.2藻细胞活性及形态观察
采用荧光计数法判定藻细胞的活性及状态,选择核酸染色剂SYTOX Green(Life Technologies,美国)作为荧光染料[16],染色浓度1μmol/mL,染色时间15 min,使用正置荧光显微镜(Nikon 90i,日本)对藻细胞进行观察计数,活细胞中叶绿素a在绿色激发光下发出红色荧光;死细胞在蓝色激发光下发出绿色荧光。
2.3.3藻细胞的光合潜能分析
光合潜能Fv/Fm值表示藻细胞光合反应中心(PSII)的最大光量子产量[17],采用浮游植物荧光仪(ZQ-WALZ 004 PHYTO-PAM,德国)进行测定。取一定体积的样品,经充分暗适应,打开测量光可测得最小荧光F0;给出一个饱和脉冲,得到叶绿素荧光F[18]m,根据Fm和F0可以计算出:

2.3.4藻细胞叶绿素a检测
叶绿素a是存在于藻类中的光合色素,使用丙酮萃取荧光分光光度计进行测定。取一定体积的样品,利用GF/F玻璃纤维膜(Whatman)过滤,过滤后将玻璃纤维膜剪碎置于离心管中,并加入10 mL的90%的丙酮置于-20℃的冰箱里萃取12 h,再将样品进行离心分离取上清液,采用荧光分光光度计(Agilent G9800A,美国),在激发波长430 nm、发射波长663 nm下,测定叶绿素a的浓度。
3 结果与分析
3.1荧光染色确定致死藻的阈值
将TRO溶液注入到排放压载水的管路中,分别对藻密度为5.05×104cells/m L的H.akashiwo,5.28×104cells/mL的A.tamarense,5.02×104cells/mL的S.costatum进行杀灭,结果如图2所示。随着TRO注入浓度的逐步增加,藻密度急剧下降,最后荧光染色鉴别未见活细胞,H.akashiwo的致死阈值浓度为1.24 mg/L,A.tamarense的致死阈值浓度为2.01 mg/L,S.costatum的致死阈值浓度为1.12 mg/L。对于不同种类的藻,TRO阈值浓度不同,因为藻细胞的大小、结构差异所致,但致死趋势相同。
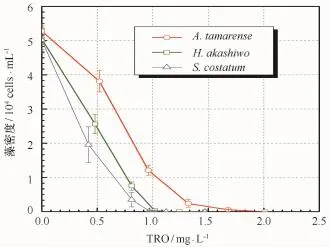
图2 藻密度与TRO浓度关系Fig.2 Relationship between the concentration of TRO and the alga densities
荧光显微镜下观察到·OH处理前后藻细胞的荧光染色图如图3所示,处理前3种藻H.akashiwo、A.tamarense和S.costatum的细胞多以单体细胞形式存在,形态完整,在特定荧光的激发下显示为自体红色荧光;在TRO致死阈值下,藻细胞膜的通透性发生改变,SYTOX Green染料进入到细胞与DNA结合,使其发出绿色荧光,在荧光显微镜下观察到3种藻细胞被全部致死。
Wright等[19]利用O3法处理压载水,TRO投加量在2.5~7.0 mg/L,可达到IMO压载水排放标准;Oemcke和Van[10]采用O3法杀灭1×104cells/mL的甲藻,所需杀灭剂量大于5 mg/L,杀灭时间大于10 min。Jung等[20]利用电解法处理压载水,投加TRO在5~10 mg/L时,处理时间大于40 min;Tsolaki等[6]实验表明电解法杀灭压载水中的外来藻,处理时间为45 min。本实验·OH致死典型的赤潮藻,TRO剂量小于2 mg/L,杀灭时间仅为1 s,远小于上述传统方法。因此,采用·OH法防治海洋外来赤潮藻具有不可比拟的优势,不仅能满足IMO压载水排放标准,而且具有广泛实际应用前景。
3.2光合潜能确定致死藻的阈值
在·OH作用下,H.akashiwo、A.tamarense、S.costatum的光合潜能变化如图4所示,3种藻的初始Fv/Fm值分别为0.56、0.76、0.55,在正常情况下Fv/Fm值相对稳定[21],随着TRO注入浓度的增大,Fv/Fm值急剧减小,当TRO分别为1.30 mg/L、2.10 mg/L、1.20 mg/L时,Fv/Fm值分别降至检测限以下,表明·OH已破坏藻细胞的光合反应系统,导致藻细胞无法进行光合作用,失去了赖以生存的能量生产和转换中心。H.akashiwo、A.tamarense、S.costatum的光合潜能表征TRO阈值与荧光染色法相比,分别提高了0.06 mg/L,0.09 mg/L,0.08 mg/L,表明藻细胞在受到·OH攻击时,不仅细胞膜通透性发生了改变,同时藻细胞的光合作用系统也受到严重损伤,但没有被完全破坏,继续提高TRO值,3种藻的光合作用系统被完全破坏,无法检测到Fv/Fm值。
3.3叶绿素a含量变化
藻细胞叶绿素a含量变化如图5所示,对于藻密度基本相同的H.akashiwo、A.tamarense、S.Costatum,其叶绿素a含量分别为35.72μg/L、69.85μg/L、30.35μg/L,这种差别主要是细胞的大小和结构差异导致的。随着注入TRO浓度的增加,叶绿素a含量急剧降低,在致死阈值时,H.akashiwo的叶绿素a含量降为10.02μg/L,分解率为77%;A.tamarense叶绿素a含量降为8.18μg/L,分解率为85%;S.Costatum的叶绿素a含量降为7.85μg/L,分解率为为74%,表明叶绿素a大部分被氧化分解。实验表明·OH具有极强的氧化脱色能力,可通过细胞膜进入细胞内氧化分解叶绿素,使藻细胞无法进行光合作用,导致细胞死亡。

图3 处理前后藻细胞的荧光染色图Fig.3 Fluorescence change before and after treatment

图4 光合潜能与TRO浓度关系Fig.4 Effect of TRO dosage on photochemical parameters

图5 处理前后叶绿素a含量变化Fig.5 Effect of TRO dosage on chlorophyll a content
3.4藻细胞形态分析
采用光学显微镜观察,·OH处理前后藻细胞形态的变化如图6所示,图A、B、C为处理前,图a、b、c为处理后。H.akashiwo属于黄藻门,细胞呈椭圆形,长约8~25μm,宽约6~15μm,无细胞壁,由质膜包裹,内容物有序分布,色素体光亮稠密,细胞能够快速游动;处理后细胞收缩呈圆形,细胞静止不动,叶绿素脱色严重。A.tamarense属于甲藻门,细胞近圆形,上下壳为半球形,大小相近,细胞长度在20~52μm,宽度在17~44μm,细胞能够快速游动;处理后细胞轮廓模糊,叶绿素脱色,细胞质收缩,细胞有明显变形。S.costatum属于硅藻门,细胞为透镜形或圆柱形,直径为6~22μm,有硅质外壳,壳面圆而鼓起,与邻细胞组成长链,色素体数目1~10个,但通常呈2个;处理后细胞形态相对完整,但·OH能通过硅质外壳上的缝隙进入细胞内,使叶黄素等色素体脱色,内容物缺失严重。
3种藻H.akashiwo,A.tamarense,S.Costatum的致死阈值由其大小和结构决定的,A.tamarense的细胞体积大,外层有细胞壁包裹,杀灭阈值高于H.akashiwo和S.costatum。H.akashiwo的细胞体积虽比S.costatum大,但其无细胞壁,二种藻的杀灭阈值相当。

图6 ·OH处理藻细胞形态的变化Fig.6 Cellular morphology change before and after treatment
4 结论
与现有的氯法和臭氧法相比,无论是投加剂量还是处理时间羟基法杀灭赤潮藻类都具有不可比拟的优势。
(1)荧光染色法确定致死阈值表明:藻密度为5.05×104cells/mL的H.akashiwo,5.28×104cells/mL的A.tamarense,5.02×104cells/mL的S.costatum致死阈值浓度分别为1.24 mg/L,2.01 mg/L,1.12 mg/L。
(2)光合潜能法确定致死阈值表明:对于上述密度的3种藻,其致死阈值分别为1.30 mg/L、2.10 mg/L、1.20 mg/L,略高于荧光法的致死阈值。
(3)TRO浓度分别达到各致死阈值时,各个藻细胞的叶绿素含量大大降低,其分解率分别达到了77%、85%、74%。
(4)3种藻的杀灭阈值高低与细胞的大小和结构有关,处理后3种藻的形态结构都发生明显改变,细胞轮廓模糊,细胞质收缩,色素体呈现明显的脱色现象。
综上所述,羟基法杀灭赤潮藻具有广阔的实际应用前景,能更好的满足国内外绿色防治压载水中外来赤潮藻的需求。
[1]Ruiz G M,Rawlings T K,Dobbs F C,et al.Global spread of microorganisms by ships[J].Nature,2000,408(6808):49-50.
[2]Bax N,Williamson A,Aguero M,et al.Marine invasive alien species:a threat to global biodiversity[J].Marine Policy,2003,27(4):313-323.
[3]Son Y B,Min J E,Ryu J H.Detecting massive green algae(Ulva prolifera)blooms in the yellow sea and East China sea using geostationary ocean color imager(GOCI)data[J].Ocean Science Journal,2012,47(3):359-375.
[4]Tsimplis M.Alien species stay home:the international convention for the control and management of ships'ballast water and sediments 2004[J].The International Journal of Marine and Coastal Law,2004,19(4):411-482.
[5]Ebenezer V,Lim W A,Ki J S.Effects of the algicides CuSO4and NaOCl on various physiological parameters in the harmful dinoflagellate Cochlodinium polykrikoides[J].Journal of Applied Phycology,2014,26(6):2357-2365.
[6]Tsolaki E,Pitta P,Diamadopoulos E.Electrochemical disinfection of simulated ballast water using Artemia salina as indicator[J].Chemical Engineering Journal,2010,156(2):305-312.
[7]Lacasa E,Tsolaki E,Sbokou Z,et al.Electrochemical disinfection of simulated ballast water on conductive diamond electrodes[J].Chemical Engineering Journal,2013,223:516-523.
[8]Meier K.Hydrogen production with sea water electrolysis using Norwegian offshore wind energy potentials[J].International Journal of Energy and Environmental Engineering,2014,5(2/3):1-12.
[9]Werschkun B,Sommer Y,Banerji S.Disinfection by-products in ballast water treatment:an evaluation of regulatory data[J].Water Research,2012,46(16):4884-4901.
[10]Oemcke D J,Van Leeuwen J H.Ozonation of the marine dinoflagellate alga Amphidinium sp.—implications for ballast water disinfection[J].Water Research,2005,39(20):5119-5125.
[11]Andreozzi R,Caprio V,Insola A,et al.Advanced oxidation processes(AOP)for water purification and recovery[J].Catalysis today,1999,53(1):51-59.
[12]Bai Mindong,Bai Xiyao,Zhang Zhitao,et al.Treatment of red tide in ocean using non-thermal plasma based advanced oxidation technology[J].Plasma Chemistry and Plasma Processing,2005,25(5):539-550.
[13]Bai Mindi,Zhang Zhitao,Bai Mindong.Simultaneous desulfurization and denitrification of flue gas by·OH radicals produced from O+2and water vapor in a duct[J].Environmental Science&Technology,2012,46(18):10161-10168.
[14]Perrins J C,Cooper W J,Van Leeuwen J H,et al.Ozonation of seawater from different locations:formation and decay of total residual oxidant—implications for ballast water treatment[J].Marine Pollution Bulletin,2006,52(9):1023-1033.
[15]Zhang Nahui,Zhang Zhitao,Bai Mindong,et al.Evaluation of the ecotoxicity and biological efficacy of ship's ballast water treatment based on hydroxyl radicals technique[J].Marine Pollution Bulletin,2012,64(12):2742-2748.
[16]Gerphagnon M,Latour D,Colombet J,et al.A double staining method using SYTOX green and calcofluor white for studying fungal parasites of phytoplankton[J].Applied and Environmental Microbiology,2013,79(13):3943-3951.
[17]From N,Richardson K,Mousing E A,et al.Removing the light history signal from normalized variable fluorescence(Fv/Fm)measurements on marine phytoplankton[J].Limnology and Oceanography:Methods,2014,12(11):776-783.
[18]Zhao Yong,Hou Na,Wang Qian,et al.Responses of chlorophyll content and fluorescence to water stress in vitex negundo var.heterophylla:take hilly area of taihang mountain in henan for example[C]//Proceedings of the 2012 International Conference on Biomedical Engineering and Biotechnology.Macau,Macao:IEEE Computer Society,2012:1656-1659.
[19]Wright D A,Gensemer R W,Mitchelmore C L,et al.Shipboard trials of an ozone-based ballast water treatment system[J].Marine Pollution Bulletin,2010,60(9):1571-1583.
[20]Jung Youmi,Yoon Y J,Hong E Y,et al.Inactivation characteristics of ozone and electrolysis process for ballast water treatment using B.subtilis spores as a probe[J].Marine Pollution Bulletin,2013,72(1):71-79.
[21]Matsubara S,Chow W S.Populations of photoinactivated photosystemⅡreaction centers characterized by chlorophyll a fluorescence lifetime in vivo[J].Proceedings of the National Academy of Sciences,2004,101(52):18234-18239.
Research on biological effectiveness of hydroxyl radicals killing marine red tide algae in ballast water
Cheng Chao1,Bai Mindong2,3,Zheng Qilin2,Chen Cao1,Meng Xiangying1,Zhang Zhitao3
(1.College of Marine Engineering,Dalian Maritime University,Dalian 116026,China;2.College of Environment and Ecology,Xiamen University,Xiamen 361005,China;3.Environmental Engineering Institute,Dalian Maritime University,Dalian 116026,China)
In this study,the three typical red tide species were chosen as the experiment algae and the inactivationwas achieved by hydroxyl radials generated from a strong ionization discharge combined with hydrodynamic cavitations.The viability and integrity of the algae were determined by the fluorescence staining and Pulse Amplitude Modulation.The results suggest that a quick and complete loss of viability was achieved for three species after exposure to hydroxyl radical,for the Heterosigma akashiwo,Alexandrium tamarensem,Skelrtonema costatum which the density is 5.05×104cells/mL,5.28×104cells/mL,5.02×104cells/mL respectively,the lethal thresholds are 1.24 mg/L,2.01mg/L,and 1.12 mg/L separately.Meanwhile Algal cells were deformed and shrunk after·OH attack and chlorophyll content was degraded at the same time.The chlorophyll content decomposition rate reaches to 77%,85%and 74%at the lethal thresholds.Above all,the use of hydroxyl radicals is an efficient method to kill red tide species in ballast water.
hydroxyl radials;red tide algae;lethal thresholds
程超,白敏冬,郑琦琳,等.羟基自由基杀灭压载水中有害赤潮物种的生物有效性研究[J].海洋学报,2016,38(2):131—137,
10.3969/j.issn.0253-4193.2016.02.013
Cheng Chao,Bai Mindong,Zheng Qilin,et al.Research on biological effectiveness of Hydroxyl radicals killing marine red tide algae in ballast water[J].Haiyang Xuebao,2016,38(2):131—137,
10.3969/j.issn.0253-4193.2016.02.013
U664.9
A
0253-4193(2016)02-0131-07
2015-06-09;
2015-09-23。
国家科技支撑计划(2013BAC06B01,2013BAC06B02);国家重大科研仪器研制项目(NSFC 61427804);国家杰出青年科学基金(NSFC 61025001);海洋科学研究公共利益的专项基金。
程超(1991—),男,湖北省当阳市人,主要研究方向船舶海洋污染防控。E-mail:845624123@qq.com
白敏冬,教授,长江学者奖励计划特聘教授、国家杰出青年基金获得者。E-mail:mindong-bai@163.com

