盐度对大叶藻种子萌发和幼苗发育的影响
刘云龙,张学雷
(1.中国海洋大学环境科学与工程学院,山东青岛266100;2.国家海洋局第一海洋研究所,山东青岛266061;3.国家海洋局海洋生态环境科学与工程重点实验室,山东青岛266061)
盐度对大叶藻种子萌发和幼苗发育的影响
刘云龙1,3,张学雷2,3*
(1.中国海洋大学环境科学与工程学院,山东青岛266100;2.国家海洋局第一海洋研究所,山东青岛266061;3.国家海洋局海洋生态环境科学与工程重点实验室,山东青岛266061)
大叶藻海草场是重要生境但在我国严重退化,亟需研究有效的修复方法。本文以桑沟湾的大叶藻种子为研究对象,探讨了盐度急变(0~30)对种子萌发、萌发后继续发育和存活及幼苗幼叶的光合与呼吸速率的影响,为以种子繁殖修复大叶藻海草场提供参考。结果表明:盐度降低促进种子萌发,盐度15及以下效果显著,盐度0时萌发率最高;盐度0~15中萌发的种子均可发育成幼苗,发育和衰亡的比例和速率受萌发盐度背景和萌发后培养盐度的双重影响——较高萌发盐度有利于种子萌发后的发育和存活,种子萌发后于盐度5~30中均可建成幼苗并存活、但在盐度0或1中发育至不同程度后全部死亡。盐度5~30范围内,幼苗幼叶均有净产氧,光合和呼吸作用及净产氧率具随盐度升高而增强趋势。于盐度0或5中萌发、盐度5~30中进一步培育的变盐育苗策略,最高实现了24%或12%的种子于2个月内建成幼苗并继续发育,可作为种子繁殖法修复大叶藻海草场的技术参考。
大叶藻;海草;种子;萌发;幼苗;盐度
1 引言
大叶藻(Zostera marina L.)是温带近岸的海生沉水性高等植物[1],其形成的海草场与红树林、珊瑚礁等生态系统齐名[2]:生产力和生物多样性高[3—4],对近岸生物地球化学循环有重要影响[5—7]。
大叶藻海草场退化会导致环境恶化、渔业资源减少等[8—9],促使人们重视其意义并尝试进行修复[10—16]。种子繁殖法已成为大叶藻海草场修复的研究热点[15—20],但其有效性却一直受种子自然萌发率低[16,21—22]、萌发周期长[23]及幼苗建成率低[11,16]等瓶颈问题的限制。因此,盐度、温度和溶氧等[24—26]多种影响大叶藻种子萌发的因素得到关注,其中关于盐度对大叶藻种子萌发的影响研究较多却仍存有分歧:许多研究认为盐度降低促进大叶藻种子萌发、提高种子萌发率[24—30]。但也有研究发现盐度15与35中萌发率相近[23],甚至认为盐度对萌发并无重要影响[21]——这或如Phillips等[27]所研究和归纳:盐度对不同区域、不同种群的大叶藻种子萌发具不同效果。此外,盐度对大叶藻种子发育形成幼苗的影响也未见确切报道。
我国北方海域一度繁盛的大叶藻海草场[31],目前已严重退化[6,32],亟需得到保护和修复。本研究拟阐明盐度对种子萌发和后续发育的影响,为利用种子繁殖法大规模修复海草场提供依据。
2 材料与方法
2.1实验材料
2014年7月,当地大叶藻果实集中成熟期[1,33],于山东省荣成市桑沟湾东楮岛近岸(盐度30,水温22℃)大叶藻海草场[6,34](37.0420°N,122.5726°E)人工采集成熟种子(具灰绿、暗棕或黑色坚硬外壳作为成熟标准[1,35],图1a),沉于室内水族箱的循环流动自然海水(盐度30±2,水温15~20℃)中避光保存2个月(根据Orth和Marion[36]修改)。

图1 大叶藻种子萌发、幼苗发育过程形态变化Fig.1 The morphology changes of Z.marina during seed germination and seedling formation and development
实验中不同盐度的海水培养液由盐度30天然海水(取自青岛沙子口附近,经孔径0.8μm滤膜过滤)与盐度0去离子水(自来水经UNIQUE-R20型超纯水机处理)按比例配制而成。
2.2实验方法
2.2.1大叶藻种子萌发培养
随机选取海草种子置于6孔无菌培养板内,每孔置20粒种子、10 mL培养液(去离子水或盐度5、10、15、20、30的海水),每个盐度处理为1组,设6个平行(1板6孔),于人工恒温气候室内15℃避光培养(大叶藻种子萌发适宜水温为10~15℃[37])。每天固定时间段统计萌发种子数、并将其取出,每3 d更换一次培养液。
2.2.2萌发种子的继续培育
首先,随机选取海草种子置于盛有去离子水或盐度5、15海水的锥形瓶中,每瓶置5 000粒种子、2 L培养液,人工恒温气候室内15℃避光培养,每天更换培养液并取出已萌发种子。
第二步,将上述处理中第20 d所获的萌发种子和盐度30海水保存过程中自然萌发的种子分别转入无菌培养板中,每孔5粒种子和10 mL培养液为一个平行,每处理组设3~8个平行(因萌发种子数量不同而有差异)。其中,经盐度0培养萌发的种子直接转入盐度0、1、5、10、15、20和30的培养液中;盐度5中萌发的种子直接转入盐度5、10、15、20和30的培养液中;盐度15中萌发的种子直接转入盐度15、20和30的培养液中;盐度30中萌发的继续在盐度30的新培养液中培养。于20℃(大叶藻幼苗生长适温15~25℃[37-38])人工气候室内的回旋振荡器(120 r/min)上培养40 d,光照/黑暗:12 h/12 h(光照强度:3 000 lx)。每天固定时间段观察、记录已萌发种子的发育生长情况并取出已建成完整幼苗继续培育,每3 d更换新鲜培养液。
2.2.3幼苗的继续培育
将2.2.2中所获的完整幼苗转入新的无菌培养板中继续培育,每孔1苗和10 mL与之前培养盐度相同的海水,光、温条件同2.2.2,与同步进行的2.2.2实验同时结束。每天固定时间段观察、记录幼苗的发育情况,每3 d更换一次新鲜培养液。
2.2.4幼苗的氧代谢测定
取盐度0中萌发种子在盐度5、10、15、20和30海水中发育成的具2片幼叶的幼苗,经黑暗培养6 h后,迅速剪取(位置如图1-Ⅳ中红框示)幼叶、沥去表面海水后称重(Sartorius分析天平,精确至0.000 1 g),剪切为2~3 mm长片段与原海水培养液2 mL一起转入液相氧电极测定仪(Hansatech Chlorolab-2型)反应杯中,加封电极后微转子搅拌(30 r/min)于20℃测定溶解氧值的变化:首先无光处理,1 min后记录5 min溶解氧值下降数据;随后打开LED光源(波长627 nm,光量子通量400μmol/(m2·s);预试验表明此光照强度无光抑制作用)记录15 min溶解氧值变化数据。
2.3数据统计、分析
子叶端(内含种胚)种皮发生胀裂后,子叶和胚轴均完全显露的大叶藻种子为已萌发种子[26](图1c);萌发后的种子分化出第一幼叶和幼根为建成的完整大叶藻幼苗[29](图1f);大叶藻幼苗分化出第二幼叶(图1g)为进一步发育的标志。
萌发率=n/N×100%,N和n分别为培养孔中种子粒数和观察期内萌发种子的累积粒数;
第一幼叶分化率、完整幼苗建成率均按n/N× 100%计算,n为萌发种子经培育40 d分化出第一片幼叶或建成完整幼苗的个数,N为培养孔中的初始萌发种子数;
死亡率=n/N×100%,n为40 d培育期内培养孔中发生死亡、腐烂的种子和幼苗累积总数,N为培养孔中的初始萌发种子数;
第二幼叶分化率=n/N×100%,n为实验期内各处理组中由N个完整幼苗形成的具2幼叶幼苗的个数。
以液相氧电极测定仪自配软件,分别计算溶解氧曲线在无光降低和有光上升段的变化速率[Δ,μmol/(mL·min)],再计算大叶藻叶片的呼吸耗氧[R,μmol/(min·g)]和净产氧速率[P,μmol/(min·g)]:

式中,v为反应杯内液体体积(单位:mL),m为受试叶片鲜重(单位:g);光合作用产氧速率[μmol/(min· g)]=R+P。
以SPSS 17.0软件的单因素方差分析(One-way ANOVA)检验盐度对种子萌发率和育苗盐度对萌发种子的第一幼叶分化率、幼苗建成率、死亡率、幼叶耗氧及净放氧速率的总体效应,如检验出显著总体效应则以LSD或Tamhane's T2检验比较各盐度处理间的效果差异[39]。统计检验中的萌发率、第一幼叶分化率、幼苗建成率和死亡率值均经反正弦转换,以p<0.05作为显著性水平。
3 结果
3.1盐度对种子萌发率的影响
大叶藻种子萌发率呈随盐度降低而增加的趋势(图2),实验盐度0~15的培养液中均有种子萌发而盐度20~30中无种子萌发。低盐度0~15中培养3 d即有种子萌发,培养20 d后萌发率仅有缓慢增加。第21 d盐度0中萌发率平均为57.5%,高于盐度5及以上中的萌发率(p<0.05);盐度5中萌发率平均为17.5%,高于盐度10及以上的萌发率(p<0.05),盐度10和15中萌发率平均分别为5.8%和4.2%。与之相比,盐度30中堆存2个月的种子自然萌发率低于0.2%。

图2 不同盐度海水培养21 d大叶藻种子累积萌发率(平均值±标准误差,字母示萌发率的统计分析差异)Fig.2 Accumulated germination rates(mean±S.E.)of Z.marina seeds incubated at different salinities in 21 days.The letters above bars indicate the significant differences of the germination rates

图3 后续培养盐度对0~15盐度中萌发的大叶藻种子发育和死亡率的影响(平均值±标准误差)Fig.3 Effects of post-germination incubation salinities on development and mortality of Z.marina seeds germinated at salinities 0-15
3.2盐度对种子萌发后继续发育的影响
萌发和育苗盐度对种子萌发后的第一幼叶分化率、幼苗建成率和死亡率均有影响:总体上,随萌发培养盐度升高,第一幼叶分化率、幼苗建成率有增加趋势而死亡率呈降低趋势(图3);育苗盐度对第一幼叶分化率、幼苗建成率和死亡率的影响程度不同,其中育苗盐度0中种子形成第一幼叶后即死亡、育苗盐度1中幼苗建成后即死亡(图3),盐度0~15中萌发的种子在盐度5~30中可建成幼苗并继续发育(图3、4)(但盐度0、5中萌发种子于盐度30中的第一幼叶分化率和幼苗建成率均较低而死亡率高,图3),育苗盐度升高呈促进已建成幼苗继续发育的趋势(图4)。
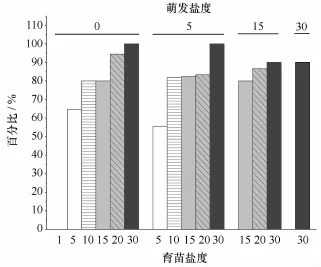
图4 幼苗在不同盐度中的第二幼叶分化率Fig.4 Percentages of Z.marina seedlings with two leaves at different salinity treatments
在适宜育苗的盐度5~30中,平均60%以上萌发种子可形成第一幼叶(但盐度0萌发盐度30育苗仅35%形成第一幼叶)、平均35%~85%可建成幼苗(但盐度0萌发盐度30建苗率低于5%)(图3),建成的幼苗50%以上可以继续发育(图4)。与之相比,盐度30中堆存种子自然萌发后的建苗率为67%、死亡率为33%(图5),建成的幼苗90%可以继续发育(图4)。
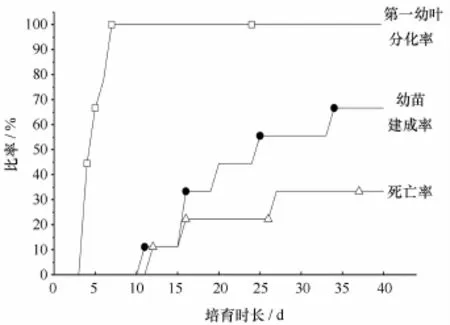
图5 盐度30中堆存种子自然萌发后的继续发育进程Fig.5 The development of Z.marina seeds that germinated naturally during massive storage at salinity 30
盐度对种子萌发后的发育和死亡速率也有影响,趋势是随萌发盐度的降低、育苗盐度的升高,种子萌发后的发育减缓,死亡也随萌发盐度降低和适宜育苗盐度升高而较早出现。盐度30中堆存种子自然萌发后4 d初现第一幼叶、7 d全部形成第一幼叶,第11 d出现完整幼苗,12 d出现死亡(图5)。与之相比,盐度0~15中种子萌发后,第一幼叶最早出现在4 d和3 d,育苗盐度15~30间又有1~2 d的延迟;完整幼苗最早形成于6 d,但相同的适宜育苗盐度(15、20或 30)中完整幼苗初现时间因萌发盐度0~15变化而有1 d~2 d提前,育苗盐度5~30间也有1 d~17 d的延迟;死亡最早于5 d、6 d和7 d初现,适宜育苗盐度15~30间死亡初现也有3 d~5 d的提前(图6)。
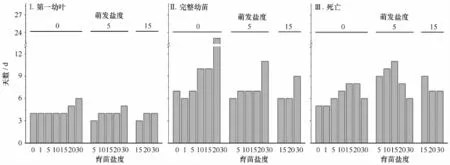
图6 后续培养盐度对0~15盐度中萌发的大叶藻种子第一幼叶、完整幼苗和死亡初现时间的影响Fig.6 Effects of post-germination incubation salinities on the emergence of the first leaf,seedling and mortality of Z.marina seeds germinated at salinities 0-15
3.3盐度对幼苗叶片氧代谢的影响
大叶藻幼苗幼叶光合作用的产氧速率(净产氧与耗氧速率之和)于盐度5中最低[平均0.501μmol/(min·g)]、盐度30中最高[平均0.687μmol/(min· g)],呈现随盐度升高而增加的趋势;幼叶净产氧速率随盐度升高也有增加的趋势,净产氧速率在盐度30中最高[平均0.363μmol/(min·g)]、盐度10中最低[平均0.226μmol/(min·g)];幼叶呼吸耗氧率亦呈随盐度升高而增加的趋势,于盐度5中最低、盐度30中最高[平均分别为0.246μmol/(min·g)、0.324 μmol/(min·g)](图7)。

图7 海草幼苗叶片在不同盐度海水中的氧代谢速率(平均值±标准误差)Fig.7 Rates(mean±S.E.)of respiration and net oxygen production by young leaves of Z.marina seedlings at different salinities
4 讨论
如引言中述及,关于盐度对大叶藻种子萌发影响的研究结果存有分歧;本研究的结果显示桑沟湾的大叶藻种子萌发率受盐度影响显著,且萌发率具随盐度降低而提高趋势、在淡水中具显著最高的萌发率(图2),这与Yamaki和Ogawa[40]对相近纬度的日本中部同种海草研究结果相符,支持关于低盐度对大叶藻种子萌发有促进作用的多数研究结果[24—30]。低盐度促进萌发作用的机制仍尚不明确,可能与种子萌发需自外界吸收水分以支持其胚细胞横向扩张、子叶及胚轴增大与伸长[41—42]有关,而低盐度和淡水中的低渗透环境有利于大叶藻种子吸收水分。此外,大叶藻等海草被认为是远古淡水或陆生植物在海侵中演化成的适应海洋沉水生活的高等植物[43—44],低盐度甚至淡水促进其种子萌发或反映了其进化遗迹,或呈现了许多生物早期发育中会出现的“返祖现象”[45]。
本研究还发现,萌发盐度和育苗盐度对大叶藻种子萌发后的发育均有影响(图3、4和6),即较高萌发盐度有利于种子萌发后的发育和存活、盐度0~15中萌发的种子于盐度5~30中进一步培养均可建成幼苗并存活,与已报道的低盐度中萌发的种子发育和存活能力减弱[46]相符,也支持盐度0~30中萌发种子均可形成幼苗的报道[29,46]。种子萌发后的发育和存活也受育苗盐度的限制,尽管有大叶藻能于含足够无机碳的蒸馏水中存活的报道[47],本研究却发现大叶藻于盐度5及以上才能继续存活、发育(图3、4),支持大叶藻存活于盐度5~42中的报道[47—49];这和育苗盐度升高(5~30)利于幼苗继续发育的结果(图4、6)一起反映了大叶藻作为海生植物的进化适应,即尽管其种子萌发期仍保留淡水适应的返祖现象,其成苗和生长仍对海水有绝对需求。
结果显示盐度5~30中的幼苗幼叶均有净产氧(图7),即有机物在体内有净积累,部分解释了上述范围盐度中大叶藻幼苗可存活、发育的生理基础;同时,幼叶光合作用随盐度升高而增强的趋势也支持已有报道[50],与随育苗盐度升高幼苗的继续发育受促进的趋势一起,支持较高盐度23~31更适合大叶藻幼苗生长的报道[49,51]。但随着育苗盐度升高(15~30),种子萌发后的发育减缓、死亡也较早出现(图6),提示存在除有机物合成积累以外的因素制约。
本文中,大叶藻种子经低盐度0、5或15萌发培养21 d,再转入盐度5~30继续培育40 d,最高分别可实现平均24.4%、12.3%或2.5%的建苗并继续发育,这显著高于同期在盐度30堆存的大叶藻种子2个月内的自然萌发成苗率(小于0.2%),也优于已报道的人工播种在海区的大叶藻种子6个月的成苗率(0~3.7%)[18]。该结果揭示了人为低盐或淡水促萌接续适宜盐度培育进行大叶藻育苗的优越性,展示了利用种子繁殖修复大叶藻海草场的可行性。但本研究也发现,低盐度0~5中萌发的种子直接转入较高盐度育苗的高死亡率(图3)会影响利用该人工育苗技术的有效性,育苗盐度升高(15~30)有延迟幼苗发育和缩短存活期的趋势(图6),因此对相应盐度处理(如:萌发种子对盐度变化的过渡适应)需进一步探索。
5 总结
盐度对大叶藻种子萌发、幼苗的形成发育和存活均具影响,也影响其幼苗的光合和呼吸作用速率。降低盐度促进大叶藻种子萌发,盐度降为15及以下时有显著高的萌发率,淡水中萌发率最高;由此获得的萌发种子在盐度5~30中均可建成完整幼苗、存活并继续发育,较高盐度更适宜幼苗发育和生长;通过适当变盐度培养处理(盐度0或5培养种子萌发、盐度5~30培育萌发种子),最高可实现24%或12%的种子于2个月内形成健全幼苗并继续发育,展示出利用种子繁殖修复大叶藻海草场的可行性和有效性。
[1]中国科学院中国植物志编辑委员会.中国植物志(第8卷)[M].北京:科学出版社,1992:86.Delectis Florae Reipublicae Popularis Sinicae Agendae Academiae Sinicae Edita.Flora Reipublicae Popularis Sinicae(Volume 8)[M].Beijing:Science Press,1992:86.
[2]Short F T,Burdick D M.Quantifying eelgrass habitat loss in relation to housing development and nitrogen loading in Waquoit Bay,Massachusetts[J].Estuaries,1996,19(3):730-739.
[3]Duarte C M,Chiscano C L.Seagrass biomass and production:a reassessment[J].Aquat Bot,1999,65(1/4):159-174.
[4]Marshall Adams S.The ecology of eelgrass,Zosteramarina(L.),fish communities:Ⅱ.Functional analysis[J].JExp Mar Biol Ecol,1976,22(3):293-311.
[5]庄武艺,谢佩尔J.海草对潮滩沉积作用的影响[J].海洋学报,1991,13(2):230-239.Zhuang Wuyi,J.Xie Pell.The influence of seagrass on the tidal flat sedimentation[J].Haiyang Xuebao,1991,13(2):230-239.
[6]Zhang X L,Li Y,Liu P,et al.Historical changes and case study of seagrass in the coast of northern seas in China[J].J Korean Soc Mar Environ Eng,2010,13(4):305-312.
[7]Costanza R,d'Arge R,De Groot R,et al.The value of the world's ecosystem services and natural capital[J].Nature,1997,387(6630):253-260.
[8]于函,马有会,张岩,等.大叶藻的生态学特征及其与环境的关系[J].海洋湖沼通报,2007(增刊):112-120.Yu Han,Ma Youhui,Zhang Yan,et al.Ecological characteristics of eelgrass(Zostera marina L.)and its response to environmental changes[J].Transactions of Oceanology and Limnology,2007(S1):112-120.
[9]Short F T,Wyllie-Echeverria S.Natural and human-induced disturbance of seagrasses[J].Environ Conserv,1996,23(1):17-27.
[10]Phillips R C,McRoy C P.Seagrass Research Methods[M].Paris:Unesco,1990:51-54.
[11]Orth R J,Luckenbach M L,Marion S R,et al.Seagrass recovery in the Delmarva coastal bays,USA[J].Aquat Bot,2006,84(1):26-36.
[12]Davis R C,Short F T.Restoring eelgrass,Zostera marina L.,habitat using a new transplanting technique:The horizontal rhizome method[J].Aquat Bot,1997,59(1/2):1-15.
[13]Fishman J R,Orth RJ,Marion S,et al.A comparative test of mechanized and manual transplanting of eelgrass,Zostera marina,in Chesapeake Bay[J].Restor Ecol,2004,12(2):214-219.
[14]Harrison P G.Variations in success of eelgrass transplants over a five-years'period[J].Environ Conserv,1990,17(2):157-163.
[15]Pickerell C H,Schott S,Wyllie-Echeverria S.Buoy-deployed seeding:Demonstration of a new eelgrass(Zostera marina L.)planting method[J].Ecol Eng,2005,25(2):127-136.
[16]Orth R J,Marion S R,Granger S,et al.Evaluation of a mechanical seed planter for transplanting Zostera marina(eelgrass)seeds[J].Aquat Bot,2009,90(2):204-208.
[17]Harwell M C,Orth R J.Long-distance dispersal potential in a marine macrophyte[J].Ecology,2002,83(12):3319-3330.
[18]Busch K E,Golden R R,Parham T A,et al.Large-scale Zostera marina(eelgrass)restoration in chesapeake bay,Maryland,USA.PartⅠ:a comparison of techniques and associated costs[J].Restor Ecol,2010,18(4):490-500.
[19]Orth R J,Luckenbach M,Moore K A.Seed dispersal in a marine macrophyte:implications for colonization and restoration[J].Ecology,1994,75(7):1927-1939.
[20]Harwell M C,Orth R J.Eelgrass(Zostera marina L.)seed protection for field experiments and implications for large-scale restoration[J].Aquat Bot,1999,64(1):51-61.
[21]Orth R J,Moore K A.Seed germination and seedling growth of Zostera marina L.(eelgrass)in the Chesapeake Bay[J].Aquat Bot,1983,15(2):117-131.
[22]Orth R J,Fishman J R,Harwell M C,et al.Seed-density effects on germination and initial seedling establishment in eelgrass Zostera marina in the Chesapeake Bay region[J].Mar Ecol Prog Ser,2003,250:71-79.
[23]McMillan C.Seed germination for an annual form of Zostera marina from the sea of Cortez,Mexico[J].Aquat Bot,1983,16(1):105-110.
[24]Harrison P G.Mechanisms of seed dormancy in an annual population of Zostera marina(eelgrass)from the Netherlands[J].Can J Bot,1991,69(9):1972-1976.
[25]Probert R J,Brenchley J L.The effect of environmental factors on field and laboratory germination in a population of Zostera marina L.from southern England[J].Seed Sci Res,1999,9(4):331-339.
[26]Churchill A C.Field studies on seed germination and seedling development in Zostera marina L.[J].Aquat Bot,1983,16(1):21-29.
[27]Phillips R C,Grant W S,McRoy C P.Reproductive strategies of eelgrass(Zostera marina L.)[J].Aquat Bot,1983,16(1):1-20.
[28]Pan J H,Jiang X,Li X J,et al.Influence of temperature and salinity on germination of eelgrass(Zostera marina L.)seeds[J].J Ocean Univ China,2011,10(2):147-152.
[29]Tanner C E,Parham T.Growing Zostera marina(eelgrass)from seeds in land-based culture systems for use in restoration projects[J].Restor Ecol,2010,18(4):527-537.
[30]Phillips R C.Ecological life history of Zostera marina L.[D].Washington:University of Washington,1972:153.
[31]杨宗岱,吴宝铃.中国海草场的分布、生产力及其结构与功能的初步探讨[J].生态学报,1981,1(1):84-89.Yang Zongdai,Wu Baoling.A preliminary study on the distribution,productivity,structure and functioning of sea-grass beds in China[J].Acta Ecologica Sinica,1981,1(1):84-89.
[32]叶春江,赵可夫.高等植物大叶藻研究进展及其对海洋沉水生活的适应[J].植物学通报,2002,19(2):184-193.Ye Chunjiang,Zhao Kefu.Advances in the study on the marine higher plant eelgrass(Zostera marina L.)and its adaptation to submerged life in seawater[J].Chinese Bulletin of Botany,2002,19(2):184-193.
[33]高亚平,方建光,张继红,等.桑沟湾大叶藻有性繁殖特性的观察研究[J].渔业科学进展,2010,31(4):53-58.Gao Yaping,Fang Jianguang,Zhang Jihong,et al.Study on sexual reproductive characteristics of eelgrass Zostera marina L.in Sanggou Bay[J].Progress in Fishery Sciences,2010,31(4):53-58.
[34]朱凤玲,刘云龙,徐元,等.利用DNA条形码技术鉴定中国北方沿海两种常见海草[J].海洋科学进展,2012,29(S1):136-143.Zhu Fengling,Liu Yunlong,Xu Yuan,et al.DNA barcoding on identification of two seagrass species from north coastal of China[J].Advances in Marine Science,2012,29(S1):136-143.
[35]De Cock A W A M.Flowering,pollination and fruiting in Zostera marina L.[J].Aquat Bot,1980,9:201-220.
[36]Orth R J,Marion S R.Innovative techniques for large-scale collection,processing,and storage of eelgrass(Zostera marina)seeds[R].Engineer Research and Development Center Vicksburg Ms,2007.
[37]Abe M,Kurashima A,Maegawa M.Temperature requirements for seed germination and seedling growth of Zostera marina from central Japan[J].Fish Sci,2008,74(3):589-593.
[38]Lee K S,Park S R,Kim Y K.Effects of irradiance,temperature,and nutrients on growth dynamics of seagrasses:a review[J].J Exp Mar Biol Ecol,2007,350(1/2):l44-175.
[39]Zar J H.Biostatistical Analysis[M].3rd ed.Prentice-Hall International,Inc.,1996:700.
[40]Yamaki K,Ogawa H.Characterization of germination and seedling production of Zostera marina and Z.Caulescens[J].Coastal Mar Sci,2009,33(1):46-53.
[41]Taylor A R A.Studies of the development of Zostera marina L.:Ⅱ.Germination and seedling development[J].Can J Bot,1957,35(5):681-695.
[42]Bradford K J.A water relations analysis of seed germination rates[J].Plant Physiol,1990,94(2):840-849.
[43]Arber A.Water Plants,A Study of Aquatic angiosperms[M].Cambridge:Cambridge University Press,1920:436.
[44]Den Hartog C.The Sea Grasses of the World[M].Amsterdam:North-Holland Publications Company,1970:275.
[45]陈小灵,王念,朱延林.植物返祖现象研究[J].上海农业学报,2012,28(1):102-105.Chen Xiaoling,Wang Nian,Zhu Yanlin.Progress in study of plant atavisms[J].Acta Agriculturae Shanghai,2012,28(1):102-105.
[46]Hootsmans M J M,Vermaat J E,Van Vierssen W.Seed-bank development,germination and early seedling survival of two seagrass species from the Netherlands:zostera marina L.and Zostera noltii hornem[J].Aquat Bot,1987,28(3/4):275-285.
[47]Phillips R C,Meñez E G.Seagrasses.Smithsonian Contributions to the Marine Sciences,Number 34[M].Washington,DC.:Smithsonian Institute Press,1988:1-104.
[48]Giesen W B J T,Van Katwijk M M,Den Hartog C.Eelgrass condition and turbidity in the Dutch Wadden Sea[J].Aquat Bot,1990,37(1):71-85.
[49]Arasaki M.Studies on the ecology of Zostera marina and Zostera nana[J].Bull Jpn Soc Sci Fish,1950,15(10):567-572.
[50]Hellblom F,Björk M.Photosynthetic responses in Zostera marina to decreasing salinity,inorganic carbon content and osmolality[J].Aquat Bot,1999,65(1/4):97-104.
[51]Biebl R,McRoy C P.Plasmatic resistance and rate of respiration and photosynthesis of Zostera marina at different salinities and temperatures[J].Mar Biol,1971,8(1):48-56.
The effects of salinity on seed germination and seedling development of the seagrass,Zostera marina L.
Liu Yunlong1,3,Zhang Xuelei2,3
(1.College of Environmental Science and Engineering,Ocean University of China,Qingdao 266100,China;2.First Institute of O-ceanography,State Oceanic Administration,Qingdao 266061,China;3.Key Lab of Science and Engineering for Marine Ecology and Environment,State Oceanic Administration,Qingdao 266061,China)
Critical habitats of Zostera marina beds have greatly declined and request studies of effective method(s)for rehabilitation.Seeds of Z.marina were collected from Sanggou Bay,Dongchudao,Rongcheng,Shandong,China,and the effects of acute salinity variation(0-30)on the seed germination and seedling development were studied in the laboratory,to provide information for the rehabilitation of seagrass bed with seed reproduction.The results showed that lowering salinity induced the germination rate of Z.marina seeds,with significance occurred at salinities 15 and lower,and the highest germination rate at salinity 0.Seeds germinated at salinities 0,5 and 15 could develop into seedlings and survive,with the percentage and time period influenced by both germination salinity background and post-germination incubation salinity:(1)higher germination salinities promoted germinated seeds developing into seedlings and surviving better,(2)seedlings were established and continued growth and further development at post-germination incubation salinities 5-30,while 100%mortality occurred after various development at salinity 0 or 1.Seedling leaves presented net production of oxygen at salinities 5-30,with a trend of higher gross and net production of oxygen and higher respiration rates at higher salinities.The results indicated that Z.marina seeds could produce 24%or 12%of health seedlings within two months treatment of acute salinity variation,germinating at salinities 0 or 5 and developing at salinities 5-30,which presented a practical method of seagrass bed rehabilitation with Z.marina seeds.
Zostera marina L.;seagrass;seed;germination;seedling;salinity
刘云龙,张学雷.盐度对大叶藻种子萌发和幼苗发育的影响[J].海洋学报,2016,38(2):104—111,
10.3969/j.issn.0253-4193.2016.02.010
Liu Yunlong,Zhang Xuelei.The effects of salinity on seed germination and seedling development of the seagrass,Zostera marina L.[J].Haiyang Xuebao,2016,38(2):104—111,
10.3969/j.issn.0253-4193.2016.02.010
Q331
A
0253-4193(2016)02-0104-08
2015-08-11;
2015-11-24。
国家自然科学基金委-山东省联合基金项目“海洋生态与环境科学”(U1406403)。
刘云龙(1986—),男,山东省临沂市人,博士生,主要从事海洋生态保护与修复研究。E-mail:liuyunlong@fio.org.cn
张学雷(1973—),男,博士,研究员,主要从事海洋生态保护与修复、生物多样性等研究。E-mail:zhangxl@fio.org.cn

