基于水下摄像的渔山列岛厚壳贻贝资源评估与分析
焦海峰,郑丹,赵明忠,尤仲杰,*,黄呈炜
(1.宁波市海洋与渔业研究院,浙江宁波315012;2.宁波市海洋与水产学会,浙江宁波315211)
基于水下摄像的渔山列岛厚壳贻贝资源评估与分析
焦海峰1,郑丹1,赵明忠2,尤仲杰1,2*,黄呈炜1
(1.宁波市海洋与渔业研究院,浙江宁波315012;2.宁波市海洋与水产学会,浙江宁波315211)
厚壳贻贝是我国东部沿海重要的经济贝类之一,自然环境中栖息范围不甚明确。本文于2014年7月间利用水下摄像的手段,调查和分析了渔山列岛不同断面上厚壳贻贝的自然分布特征。结果表明:渔山列岛潮下带5条断面的生态类型差异显著,不同断面栖息的优势种也不相同;断面间厚壳贻贝的栖息密度均值为37.04~185.80 ind/m2,其中断面A的栖息密度最低,断面E的栖息密度最高,断面C和断面D的栖息密度相差不大,但是不同调查样方内厚壳贻贝的栖息密度从0~388.89 ind/m2不等;厚壳贻贝主要分布在水深3~9 m的水层中,其中以水深5~8 m的水层中最为密集,约占总栖息密度的90%以上;在水深8 m的区带上,厚壳贻贝的栖息密度为160.19 ind/m2,当水深小于1 m和大于11 m时,厚壳贻贝分布极少;经双因素方差分析表明,厚壳贻贝栖息密度在不同断面(F= 57.011,P<0.01)和不同水层(F=66.495,P<0.01)中的差异均极显著,断面和水层的交互作用(F= 10.483,P<0.01)对厚壳贻贝的自然分布也有极显著差异;经检验,厚壳贻贝栖息密度(A)的自然分布与水深(D)呈正态分布,可以用高斯方程拟合,R2的取值范围为0.875 3~0.999 7;利用聚类分析发现,调查样方被明显的分为3组,体现了水深在厚壳贻贝自然分布中的显著作用。
渔山列岛;厚壳贻贝;水下摄像;资源评估
1 引言
厚壳贻贝隶属双壳纲、贻贝科,俗称“淡菜”、“壳菜”,中国古书上称其为“东海夫人”[1]。据资料记载,该种仅见于西太平洋,北从日本的北海道,经九州、朝鲜,至中国北部及东部沿海[2]。厚壳贻贝个体大,肉肥味美,含有丰富的抗菌多肽[3],是重要的捕捞对象,它也是好浪性种类,多附着在浪击带的外海岩石上,垂直分布明显[4—5]。由于其自然分布的特殊性,给厚壳贻贝的调查与分析增添了诸多障碍,迄今未见厚壳贻贝水下自然分布的系统性研究。
目前,针对海洋空间或资源进行监测与研究的手段主要有两类:一类是接触性调查的方法,另一类是非接触性调查法,前者是传统的调查方法,主要通过休闲或商业手段采集目标种从而获得相关数据,具有破坏性[6];后者是基于可视化或可探测的调查技术,借助水下摄像机、高空或卫星遥感、声学等手段来获得数据,没有破坏性[7—8],前者已经形成相关的技术标准或规程[9],而后者的研究在发展阶段。随着水下探测技术的发展,水下机器人和水下摄像等技术已经被广泛的应用到海底的观测中[10],应用的范围在也逐步扩展[6—8]。水下可视化调查(UVC)就是应用在生物多样性监测中的一种非破坏性方式,可以实现对浅海中鱼类的分布、多样性、栖息密度和规格等数据的定量分析[11—13]。特别是水下机器人(ROV)的技术在海洋生物的调查中得到了广泛的应用,Norcross和Muter利用ROV调查了阿拉斯加科迪亚克岛比目鱼的幼体的分布[13],Watson等利用改进的固定潜水视频系统分析了岩礁相鱼类的结构[14],同时视频系统还在鱼类和虾类的行为学研究中得到了广泛的应用[15—19],目前,利用该技术已基本实现了对水下海洋生物的调查与分析[20—24]。
渔山列岛蕴藏着丰富的厚壳贻贝资源[4],但该种类在自然状态下的分布范围和规律尚不明晰,也未见详细的报道。本文借助水下摄像技术,对典型的贝类——厚壳贻贝进行调查,不仅能够掌握该贝类资源在渔山岛的栖息范围和密度,也能揭示厚壳贻贝的自然分布规律,为科学保护和合理利用贝类资源提供科学依据,同时,也可为水下摄像技术在海域调查中拓展新的思路。
2 材料和方法
2.1调查区域概况
渔山列岛位于浙江省沿海中部,隶属于宁波市石浦镇。在象山半岛东南、猫头洋东北,距离石浦铜瓦门47.5 km,即28°51.4′~28°56.4′N,122°13.5′~122°17.5′E之间。列岛由13岛41礁组成,岛礁总面积约2 km2,岸线总长约20.8 km,其中面积大于500 m2岛屿有28个。列岛位于亚热带季风气候区,属亚热带气候系统下的大陆气候向海洋气候转换的过渡性气候。
渔山列岛先后被国家海洋局列为国家级海洋特别保护区和海洋公园,保护区的面积57 km2,重点保护岛礁资源和贝藻等生物资源,生物资源的保护对象是以厚壳贻贝、荔枝螺为代表的经济贝类和以鹅掌菜、羊栖菜为代表的大型藻类。
2.2调查时间和方法
调查在2014年7月小潮期间进行,在社会调查的基础上,参考渔山列岛的相关资料,确立了5条调查断面,不同断面的分布见图1。
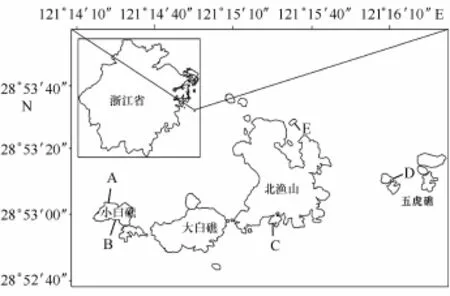
图1 渔山列岛厚壳贻贝水下调查断面Fig.1 The survey sections of Yushan Islands
潜水调查:乘船到达预定调查断面附近,潜水员先下潜至海底,然后潜行至待调查的断面,由底层向表层进行定性(拍照)或定量(摄录)调查,两人同行,尽量避免漂移。
定性调查使用摄像机(索尼EX1R高清专业DV,视频信号HDV、PAL彩色,CCIR标准1080/50i规格,感光器类型3Exmor CMOS,录制格式MPEG-2长GOP编码)。采用摄像机由底层向表层拍摄,每条断面不间断拍摄,充分拍摄断面及周边视野内的生物影像。
定量调查用照相机(佳能5D MarkII,像素2 110万,影像处理器DIGIC4)。根据水深条件设定不同的环形调查水层,每隔2 m布设1个调查水层,拍摄的层次按照水深1 m、3 m、5 m……低层(B)布设,其中在水深8 m时增加一个调查水层,每个水层定量拍摄3个样方,同一样方框选取不同3个角度拍摄多张照片。定量调查时,用30 cm×30 cm的定样框覆盖在厚壳贻贝上,然后拍摄,照片拍摄时相机与样方框的距离以不远于1.5m为宜,拍照时记录拍照时间和水深。调查断面的水深不同,调查的样方层次也有差异,不同断面的调查层次见表1。
调查结束,将获取的影像和照片带回实验室计数、分析。
2.3数据分析
水深校正:每个断面调查时,根据调查时间查阅当时潮汐状况(http://ocean.cnss.com.cn/),然后初步校正环形调查水层。利用潜水表记录每个调查样方的水深,每次拍照记录调查时间。待调查结束后,整理不同采样时间的水深数据,再查阅调查同时间段的潮汐表,来校正调查的实际水深(黄海高程),同一水层调查样方的水深变动幅度小于±0.2 m。
栖息密度:厚壳贻贝栖息密度的计算,以样方内个体的总数量来估算,分别取每个样方内3个不同角度的清晰照片,由3个人分别计数,每人对照片计数3次,取3个人对照片的3次计数的均值作为该样方内的个体总数(N),再以取样面积计算栖息密度。式中,P代表厚壳贻贝栖息密度(单位:ind/m2),m代表总的计数人数,n代表每个人的计数次数,i代表第i个计数人,j代表每个人的第j次计数,Nj代表每次计数的密度(单位:ind/m2)。
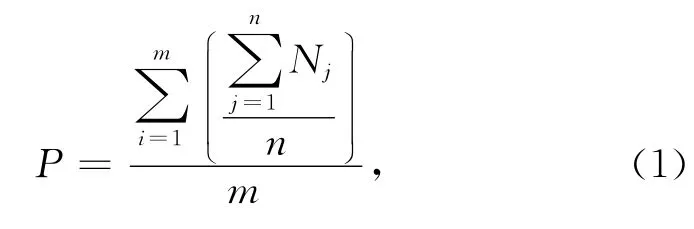
聚类:以厚壳贻贝栖息密度的四次开方为基础,采用欧氏距离(Euclidean Distance)的组间差距进行系统聚类。

表1 渔山列岛调查断面水下概况Tab.1 The underwater overviews of Yushan Islands in different sections
本研究中数据处理和统计分析分别在Ecxel和SPSS19.0中完成,厚壳贻贝分布图由SigmaPlot 10.0绘制。
3 结果与分析
3.1不同调查断面的水下环境特征
调查发现,5条断面的水下环境特征差异较明显,其中水深的差异最为直观,从7~19 m不等(表1)。不同断面的生态类型也有显著差异,其中断面A、断面C和断面E底层的环境特征类似,均为砂质;断面B和断面D底层底质类型较相似,为块石或岩礁相。不同断面中栖息的大型底栖生物种类有差异:在断面A、断面B和断面D的不同水层中藻类的分布较为广泛,以厚网藻和珊瑚藻为主,而断面D中除厚网藻外,还分布有大量的太平洋侧花海葵;断面C上的附着生物较少,在海底有黑枝鳃海牛等;断面E中栖息的种类与其他4个断面有差异,在水深超过10 m的区域分布有大量的偏顶蛤,而且后鳃类种类较多,主要有黄紫多彩海牛、东方多彩海牛和青高海牛等;另外,在5个断面均分布有数量较多的桂山厚丛柳珊瑚、海绵等种类。
3.2厚壳贻贝自然分布的差异
分析发现:不同断面厚壳贻贝的栖息密度有明显差异(图2)。其中,断面间厚壳贻贝的栖息密度均值为37.04~185.80 ind/m2,断面A的栖息密度最低,断面E的栖息密度最高,断面C和断面D的栖息密度相差不大,前者为74.07 ind/m2,后者为75.66 ind/m2,但不同样方内厚壳贻贝的栖息密度从0~388.89 ind/m2不等。由图2可以看出,厚壳贻贝分布规律较为一致,主要分布在水深3~9 m的水层中,其中以5~8 m的水层中最为密集,约占总栖息密度的90%以上。结果显示,在水深8m的环形区带上,厚壳贻贝栖息密度最高,为160.19 ind/m2,其次是水深7 m的环形区带上,栖息密度为140.00 ind/m2,当水深大于9 m后,栖息密度极低,均值仅为21.30 ind/m2,在水深小于1 m和水深大于11 m的环形区带上,几乎没有发现厚壳贻贝。因此推断,厚壳贻贝的自然分布水层为5~8 m,其他水层有零星分布,但数量不多。
厚壳贻贝的自然分布在一定范围内随水深的增加而增加,当栖息密度升高至一定值后,随深度的增加而下降明显。经检验,厚壳贻贝栖息密度(A)的自然分布与水深(D)几乎呈正态分布,可以用高斯方程进行拟合:,不同断面的高斯方程各参数见表2,其中R2取值范围为0.875 3~0.999 7,可以看出拟合度均较高。

图2 不同调查断面厚壳贻贝的自然栖息密度Fig.2 The natural density of Mytilus coruscus in different sections

表2 厚壳贻贝栖息密度与水深拟合方程参数Tab.2 The equation parameters of density and water depth of Mytilus coruscus
通过双因素方差分析表明,厚壳贻贝栖息密度在不同断面(F=57.011,P<0.01)和不同水层(F= 66.495,P<0.01)中的差异均极显著。统计发现,断面和水层的交互作用也对厚壳贻贝的自然分布有极显著影响(F=10.483,P<0.01)(表3)。

表3 厚壳贻贝栖息密度在不同断面和不同水层差异性检验Tab.3 The test of density of Mytilus coruscus in different sections and water depths
3.3厚壳贻贝栖息密度的等级聚类分析
如前述,不同断面和不同水层中厚壳贻贝的自然栖息密度有差异,而且极为显著(P<0.01)。由于密度的差异极显著,因此利用密度的四次开方为基础,并基于欧氏距离的差异对不同断面和不同水层中厚壳贻贝的自然分布进行聚类分析,结果如图3所示。

图3 不同调查样方中厚壳贻贝栖息密度的聚类(A1:字母代表调查断面,数字代表调查水层)Fig.3 The cluster of natural density of Mytilus coruscus in different sections and water depths(A1:alphabet represent survey sections,number represent survey water depth)
由图3可以看出,聚类结果将不同样方划分为不同的类别,可以明显地划分为3组:第一组由C1、C9和E11组成,该组的特征是样方内均未拍摄到厚壳贻贝;第二组主要由断面A(5个分层)、断面B(3个分层)、断面D(3个分层)、断面E(2个分层)和断面C(1个分层)构成,该组的特征是水层均为3 m以浅或者9 m以深的调查样方;其余调查样方划分为第三组,该组除D3和E3样方外,其他样方均是水深为5~8 m水层的调查样方。从聚类结果可以进一步看出,水深对厚壳贻贝自然分布有显著的影响。
4 讨论
4.1调查手段对结果偶然性的分析
水下机器(ROV)技术是近年来逐渐兴起的一项新的水下探测技术,它是基于成像系统捕捉水下的生物,利用数据库软件,对捕获的对象进行分析或测量[6,10,13]。该项技术具有一定的局限性,如捕捉的偶然性和重复性,这在不同的研究者中也得到了证实[15—16]。如Watson等分析了3种不同调查方式在鱼类资源量评估中的应用,其中立体的观测结果较为准确,其他两种方式的调查结果偏差较大[8]。研究表明,不同水下观测方式对鱼类的观测结果也存在差异,如Longo和Floeter利用水下机器人和潜水员的潜水调查分析了两个不同海区的鱼类种群分布,结果发现,不同调查方式之间的结果有很大的差异,其中水下机器人调查获取的数据较潜水员调查的数据更全面,这是因为鱼类为游泳性生物,潜水员的在一定程度上也干扰了鱼群,另外潜水员调查的时长受限制,而水下机器人的调查时间较长,也使调查更具可信度[19]。本文的研究对象是厚壳贻贝,它是固着性的种类,水下机器人或潜水员潜水调查不会对其造成驱赶效应[21—22]。但本文调查的结果也存在局限,主要体现在:首先,调查是非接触性的,拍摄照片是平面的,所能呈现的是厚壳贻贝分布区表层的特征;其次,数据分析也存在偶然性,在样品计数时,存在的人为误差,为保证准确性,本文在对每个样方计数时均采用了3个人3次不同的计数结果,以尽量保证调查数据的可靠准确。目前,可以借鉴的利用水下摄像技术定量估算水下固着性种类栖息密度的报道不多[23—24],这也为海洋生物调查技术向海洋的延伸提出了挑战,近几年发展起来的水下探测技术为人们探究定量丰富多彩的水下世界提供了新的方向,但在后续研究中需要加强可视化数据分析领域的研究[25],通过构建数据库来提高调查的准确性。
4.2厚壳贻贝自然分布规律的分析
本文研究表明,渔山列岛不同断面的厚壳贻贝栖息密度不一致,最高栖息密度出现在E8调查样方,值为388.89 ind/m2,最低栖息密度为0。而且厚壳贻贝的自然分布差异性非常明显:断面E的栖息密度最高,断面A的栖息密度最低,栖息密度的差异依次为断面D大于断面C大于断面B,经方差分析发现,厚壳贻贝在不同断面间存在极显著差异(F=57.011,P<0.01)。根据调查结果(图2),笔者推测,厚壳贻贝的在渔山列岛的极限分布范围为11 m,广泛分布范围为5~8 m,这与资料记载基本一致。资料上记载,厚壳贻贝可见于20 m左右或稍深一些的水域,在8~10 m间分布最密,但本文中当水深大于11 m时海域中未发现厚壳贻贝的存在,这与资料也有差异[1-4]。由于受到相关调查资料缺乏的限制,厚壳贻贝的空间性或区域性差异未进行对比分析。
众所周知,水深是影响水生生物的分布和群落结构的重要因素之一[26]。目前,针对水深对水生植物生长、分布和光化学特性影响的研究较多[27],均表明,水深可以通过影响光合作用直接影响植物的生长,而且可以通过改变底泥的理化性状对植物生长造成间接影响[28—29]。除对植物的影响研究较广泛外,水深也影响着海区中大型藻类的自然分布,章守宇等研究表明,枸杞岛铜藻在不同调查站点内有明显差异,而且在同一水深范围内铜藻的分布也不均匀,呈现斑块状分布格局,这种斑块状分布在其他藻类中也存在[30]。水深对海洋生物分布影响的研究资料不多,多集中在游泳性的鱼类,鱼类的丰度、生物性或非生物性的栖息环境均与水深有较强的相关性[25,31]。水深对贝类影响的研究也有过报道,如Pit和Southgate曾发现在养殖过程中珍珠贝的生长和成活均受养殖水深的明显影响[32],黄海立等研究发现,珠母贝的成活率随着水层的加深而显著提高[33],养殖成活率随水深的增加而增加明显的现象在大珠母贝中也有发现,在12 m水深组的成活率显著高于其他组别[34],说明水深是影响贝类生存、繁殖的重要因素之一。本文中,厚壳贻贝的栖息密度与水深以正态分布拟合为优(R2=0.894 6),由此可见,水深明显的影响着自然界中动植物的分布,这也为研究水深对贝类自然分布的影响提供了一些证据。
种类不同受水深影响的程度也不尽相同,而且造成不同生物分布差异的原因也是多种多样的。挺水植物受水深影响的原因是水深影响了植物的光合作用[27],而铜藻的分布差异,除了水深影响光合作用外,水流、波浪等因素也给铜藻的分布带来影响[30]。本文调查发现,厚壳贻贝在自然环境中主要分布在风浪较大,水流较急的迎浪面上。笔者认为,在水深5~10 m的迎浪面上,饵料生物丰富,风浪相对较小,环境相对稳定,而且生物种类比较丰富,多样性程度高,是厚壳贻贝的适宜生存环境,故分布较多。海洋生物呈带状的分布特征在珊瑚中也较为明显,Williams等[35]研究表明,金曼和巴尔米拉海域的珊瑚呈现明显的带状分布,随着深度的增加,带状分布更加明显。造成珊瑚带状分布的原因主要是:浅水条件下,环境因素恶劣(如潮流冲刷、太阳辐射等),珊瑚摄食受到限制或者遭受抗光性的损伤[36];深水条件下,太阳辐射减少,藻类光合作用减弱,水流变小,综合因素造成珊瑚表面及周边营养盐的缺乏,进而限制珊瑚的呼吸和生长[37]。水深在厚壳贻贝自然分布中发挥作用的机理尚不清楚,但当水深大于9 m后,贻贝的数量明显减少,调查发现,在渔山列岛水域当水深大于10 m后,各种固着性生物普遍减少,推测可能由于环境条件和生物自身的耐受性不同从而造成生物的分布差异。鱼类可以靠鳔的收缩来调节栖息的水层,但厚壳贻贝是营固着性生活,一旦栖息下来,将不再迁移,因此它们对环境的选择性更强,厚壳贻贝这种潜在的生理学适应机制值得深入研究。另外,厚壳贻贝在自然环境中存在“斑块状”分布的特征,这在铜藻和珊瑚等营固着性种类中均有发现。其中附着基质的物理特性影响着铜藻斑块状分布的主要因素[30],因为在同一水深处的小尺度范围内,某些影响因子(波浪、水运动、光照、温盐等)的差异较小,不会成为影响其斑块状分布的主要因子,而基质的变化较明显,粗糙结构创造了一些生存空间使铜藻免受生物和非生物因子的影响。波浪是影响中表层珊瑚自然分布的重要因素,在金曼海域,钙质珊瑚受波浪的干扰极为明显,随着水层的加深生物量显著增加[35],因为波浪的冲刷对生物具有“移除”作用,一些位置较低和对波浪耐受性强的生物往往成为强波浪条件下的优势物种[38]。显然,空间异质性和波浪的共同作用可以在一定程度上解释厚壳贻贝“斑块状”分布的现象,但厚壳贻贝浮游幼体的悬浮时间比较长,通常都超过40 d,悬浮幼体随着海流而四处漂散[1],所以空间异质性对其附着影响机理尚需研究,但波浪对厚壳贻贝移除作用从而造成贻贝斑块状分布的推论是值得借鉴的。但是厚壳贻贝和藻类、珊瑚是不同的类群,虽然它们在自然附着的过程中存在某些共性,但厚壳贻贝从浮游阶段到附着的机理也有待进一步研究。
4.3厚壳贻贝自然资源保护的建议
厚壳贻贝是渔山列岛重点保护的贝类资源之一,也是当地重点采捕的种类之一,由于其世代更替速度较慢[39],大规模、高强度的采捕势必造成贻贝资源的减少。当地渔业管理部门已经对其实行了限额捕捞制度,这为保护厚壳贻贝资源建立了制度保障。如前述,厚壳贻贝主要分布于环形区带上,尤其以5~8 m的范围分布最为密集,但在这区带上仅有1/3的岩礁有大量厚壳贻贝的存在,多数海区贻贝的数量较为稀疏,甚至出现“空斑”区。除去自然因素,人类采捕也是造成其斑块状分布的重要因素。
为保护厚壳贻贝资源,需要设立资源养护的重点保护区域,保护区内严禁厚壳贻贝的采捕,针对渔山列岛的现状,建议将平虎礁(断面D)和拦门大礁(断面E)列为重点保护区。同时,继续做好厚壳贻贝资源养护的管控措施,实行有计划的配额招标采捕,限区域限时限量采捕,此模式可对保护区内资源的有效保护和可持续发展发挥重要的作用。除严格贯彻三限捕捞外,建议实行轮休制度,即每5年实行一次禁捕(或者少捕),以实现厚壳贻贝自然资源的休养生息。对前期采捕强度较大的区域,采取有步骤的厚壳贻贝资源增殖放流,进一步提升资源的密度,实现厚壳贻贝的科学、有序利用。
[1]常抗美,吴剑锋.厚壳贻贝人工繁殖技术的研究[J].南方水产,2007,3(3):26-30.Chang Kangmei,Wu Jianfeng.Study on artificial propagation of mussel Mytilus coruscus[J].South China Fisheries Science,2007,3(3):26-30.
[2]梁君,虞宝存,毕远新,等.中街山列岛海域厚壳贻贝生物学特征及生长规律[J].生态学杂志,2015,34(2):471-476.Liang Jun,Yu Baocun,Bi Yuanxin,et al.The biological characteristics and growth patterns of Mytilus coruscus in the waters of Zhongjieshan Islands[J].Chinese Journal of Ecology,2015,34(2):471-476.
[3]王日昕,刘梅,廖智,等.厚壳贻贝抗菌肽Mytilin的初步鉴定[J].水产学报,2010,34(1):153-159.Wang Rixin,Liu Mei,Liao Zhi,et al.Purification and identification of Mytilins from Mytilus coruscus[J].Journal of Fisheries of China,2010,34(1):153-159.
[4]尤仲杰.鱼山列岛潮间带软体动物生态的研究[J].海洋科学,1986,10(3):36-41.You Zhongjie.Ecological studies on the intertidal zone of the Yushan Islands,Zhejiang[J].Marine Sciences,1986,10(3):36-41.
[5]洪君超,尤仲杰,王依望,等.渔山列岛潮间带软体动物区系的初步分析[J].浙江水产学院学报,1984,3(1):21-28.Hong Junchao,You Zhongjie,Wang Yiwang,et al.A preliminary analysis on the mollusca fauna of Yushan,Islands tideland,East China Sea[J].Journal of Zhejiang College of Fisheries,1984,3(1):21-28.
[6]Murphy H M,Jenkins G P.Observational methods used in marine spatial monitoring of fishes and associated habitats:a review[J].Marine and Freshwater Research,2010,61(2):236-252.
[7]Pennington M,Strømme T.Surveys as a research tool for managing dynamic stocks[J].Fisheries Research,1998,37(1/3):97-106.
[8]Watson D L,Harvey E S,Anderson M J,et al.A comparison of temperate reef fish assemblages recorded by three underwater stereo-video techniques[J].Marine Biology,2005,148(2):415-425.
[9]国家海洋局第三海洋研究所,国家海洋局第二海洋研究所.GB/T 12763.6-2007,海洋调查规范第6部分:海洋生物调查[S].北京:中国标准出版社,2008.The Third Institute of Oceanography,The Second Institute of Oceanography,State Oceanic Administration.GB/T 12763.6-2007,Specifications for Oceanographic Survey-part 6:Marine Biological Survey[S].Beijing:Chinastandard Publishing House,2008.
[10]Rotherham D,Underwood A J,Chapman M G,et al.A strategy for developing scientific sampling tools for fishery-independent surveys of estuarine fish in New South Wales,Australia[J].Ices Journal of Marine Science,2007,64(8):1512-1516.
[11]Edgar G J,Barrett N S,Morton A J.Biases associated with the use of underwater visual census techniques to quantify the density and size-structure of fish populations[J].Journal of Experimental Marine Biology and Ecology,2004,308(2):269-290.
[12]Sale P F,Douglas W A.Precision and accuracy of visual census technique for fish assemblages on coral patch reefs[J].Environmental Biology of Fishes,1981,6(3/4):333-339.
[13]Norcross B L,Mueter F J.The use of an ROV in the study of juvenile flatfish[J].Fisheries Research,1999,39(3):241-251.
[14]Watson D L,Harvey E S,Fitzpatrick B M,et al.Assessing reef fish assemblage structure:how do different stereo-video techniques compare?Marine Biology,2010,157(6):1237-1250.
[15]Carbines G,Cole R G.Using a remote drift underwater video(DUV)to examine dredge impacts on demersal fishes and benthic habitat complexity in Foveaux Strait,Southern New Zealand[J].Fisheries Research,2009,96(2/3):230-237.
[16]Cappo M,Speare P,De'ath G.Comparison of baited remote underwater video stations(BRUVS)and prawn(shrimp)trawls for assessments of fish biodiversity in inter-reefal areas of the Great Barrier Reef Marine Park[J].Journal of Experimental Marine Biology and Ecology,2004,302(2):123-152.
[17]Langlois T J,Fitzpatrick B R,Fairclough D V,et al.Similarities between line fishing and baited stereo-video estimations of length-frequency:novel application of Kernel Density Estimates[J].PLoS One,2012,7(11):e45973.
[18]Kulbicki M,Sarramégna S.Comparison of density estimates derived from strip transect and distance sampling for underwater visual censuses:a case study of Chaetodontidae and Pomacanthidae[J].Aquatic Living Resources,1999,12(5):315-325.
[19]Longo G O,Floeter S R.Comparison of remote video and diver's direct observations to quantify reef fishes feeding on benthos in coral and rocky reefs[J].Journal of Fish Biology,2012,81(5):1773-1780.
[20]Okamoto M.Ability of a small observation ROV to observe fish fauna around artificial fish reefs in comparison with diving observation[J].Nippon Suisan Gakkaishi,1989,55(9):1539-1546.
[21]Pita P,Fernández-Márquez D,Freire J.Short-term performance of three underwater sampling techniques for assessing differences in the absolute abundances and in the inventories of the coastal fish communities of the Northeast Atlantic Ocean[J].Marine and Freshwater Research,2014,65(2):105-113.
[22]Kaufmann R S,Wakefield W W,Genin A.Distribution of epibenthic megafauna and lebensspuren on two central North Pacific seamounts[J].Deep-Sea Research Part A.Oceanographic Research Papers,1989,36(12):1863-1896.
[23]Burkepile D E,Hay M E.Feeding complementarity versus redundancy among herbivorous fishes on a Caribbean reef[J].Coral Reefs,2011,30(2):351-362.
[24]Auster PJ,Malatesta RJ,LaRosa SC,et al.Microhabitat utilization by the megafaunal assem blage at a low relief outer continental shelf site-Middle Atlantic Bight,USA[J].Journal of Northwest Atlantic Fishery Science,1991,11:59-69.
[25]Stoner A W,Spencer M L,Ryer C H.Flatfish-habitat associations in Alaska nursery grounds:Use of continuous video records for multi-scale spatial analysis[J].Journal of Sea Research,2007,57(2/3):137-150.
[26]沈国英,施并章.海洋生态学[M].北京:科学出版社,2008.Shen Guoying,Shi Bingzhang.Marine Ecology[M].Beijing:Science Press,2008.
[27]袁桂香,吴爱平,葛大兵,等.不同水深梯度对4种挺水植物生长繁殖的影响[J].环境科学学报,2011,31(12):2690-2697.Yuan Guixiang,Wu Aiping,Ge Dabing,et al.Effects of water depth on the growth of four emergent macrophytes[J].Acta Scientiae Circumstantiae,2011,31(12):2690-2697.
[28]Coleman M A.Small-scale spatial variability in intertidal and subtidal turfing algal assemblages and the temporal generality of these patterns[J].Journal of Experimental Marine Biology and Ecology,2002,267(1):53-74.
[29]Díez I,Santolaria A,Gorostiaga J M.The relationship of environmental factors to the structure and distribution of subtidal seaweed vegetation of the western Basque coast(N Spain)[J].Estuarine,Coastal and Shelf Science,2003,56(5/6):1041-1054.
[30]章守宇,毕远新,吴祖立.枸杞岛铜藻空间分布格局初探[J].水产学报,2013,37(6):884-893.Zhang Shouyu,Bi Yuanxin,Wu Zuli.Spatial distribution pattern of Sargassum horneri around Gouqi Island,Shengsi,China[J].Journal of Fisheries of China,2013,37(6):884-893.
[31]Ruitton S,Francour P,Boudouresque C F.Relationships between algae,benthic herbivorous invertebrates and fishes in rocky sublittoral communities of a temperate sea(Mediterranean)[J].Estuarine Coastal and Shelf Science,2000,50(2):217-230.
[32]Pit J H,Southgate P C.Fouling and predation;how do they affect growth and survival of the blacklip pearl oyster,Pinctada margaritifera,during nursery culture?[J].Aquaculture International,2003,11(6):545-555.
[33]黄海立,符韶,邓陈茂,等.珠母贝人工苗中间培育的研究[J].水产科学,2007,26(5):267-270.Huang Haili,Fu Shao,Deng Chenmao,et al.The intermediate culture of Pinctada margaritifera juveniles produced in a hatchery[J].Fisheries Science,2007,26(5):267-270.
[34]谢绍河,梁飞龙,符韶,等.养殖水深和笼具对大珠母贝成活率与生长的影响研究[J].中国农学通报,2013,29(2):31-35.Xie Shaohe,Liang Feilong,Fu Shao,et al.The effects of water depth and culture nets on survival and growth of pearl oyster Pinctada maxima[J].Chinese Agricultural Science Bulletin,2013,29(2):31-35.
[35]Williams G J,Smith J E,Conklin E J,et al.Benthic communities at two remote Pacific coral reefs:effects of reef habitat,depth,and wave energy gradients on spatial patterns[J].PeerJ,2013,1:e81.
[36]Brown B E.Coral bleaching:causes and consequences[J].Coral Reefs,1997,16(S1):S129-S138.
[37]Patterson M R,Sebens K P,Randolph O R.In situ measurements of flow effects on primary production and dark respiration in reef corals[J].Limnology and Oceanography,1991,36(5):936-948.
[38]Page-Albins K N,Vroom P S,Hoeke R,et al.Patterns in benthic coral reef communities at pearl and Hermes atoll along a wave-exposure gradient[J].Pacific Science,2012,66(4):481-496.
[39]焦海峰,施慧雄,尤仲杰,等.浙江渔山列岛岩礁潮间带大型底栖动物次级生产力[J].应用生态学报,2011,22(8):2173-2178.Jiao Haifeng,Shi Huixiong,You Zhongjie,et al.Secondary productivity of macrobenthos in rocky intertidal zone of Yushan Islands,Zhejiang Province[J].Chinese Journal of Applied Ecology,2011,22(8):2173-2178.
Survey and resource evaluation of Mytilus coruscus for underwater visual censuses of Yushan Islands
Jiao Haifeng1,2,Zheng Dan1,Zhao Mingzhong2,You Zhongjie1,2,Huang Chengwei1
(1.Ningbo Academy of Oceanology and Fishery,Ningbo 315012,China;2.Ningbo Society of Oceanology and Fishery,Ningbo 315211,China)
Mytilus coruscus,the natural distribution of which was indistinct,is one of the important economic shell-fish of East China Sea.The natural distributions of different sections in Yushan Islands were analyzed by underwater survey in July,2014.The results showed:the differences of ecological types in five survey sections are significant,and the dominant species of five sections are different as well.The density of Mytilus coruscus varied from 37.04 ind/m2to 185.80 ind/m2in different sections,the density of section A was higher than other sections,the following was section C and section D,the density of section B was the lowest.Furthermore,the density of each survey plot varied from 0 to 388.89 ind/m2.The main natural distribution water depth of Mytilus coruscus was from underwater 9 m to underwater 3 m,but mainly distribution water depth was from underwater 8 m to underwater 5 m,and the total of 90 percent of Mytiluscoruscus were recorded in this zone.The highest density of underwater 8 m depth was 160.19 ind/m2,and few mussel were found when the water depth is less than 1 m or exceed 11 m.The density of Mytilus coruscus changed greatly in different sections(F=57.011,P<0.01)and water depths(F=66.495,P<0.01),which influenced significantly by section and water depth through double factor variance analysis,interaction of survey sections and water depths effected significantly on density of Mytilus coruscus(F=10.483,P<0.01).The relationship between density(A)and water depth(D)can be represented by the following Gauss Equation,the valve of equation R2varied from 0.875 3 to 0.999 7.Using hierarchical clustering,the 31 different surveys underwater zones were classified into three groups:the characteristic of first group were blank zone,the characteristic of second group were the water depth from 5 to 8 m,the characteristic of third group was the water depth less than 3 m or exceed than 9 m.The results showed that the water depth is the main factor which influenced the distribution of Mytilus coruscus.
Yushan Islands;Mytilus coruscus;underwater video;resource evaluation
焦海峰,郑丹,赵明忠,等.基于水下摄像的渔山列岛厚壳贻贝资源评估与分析[J].海洋学报,2016,38(2):84—92,
10.3969/j.issn.0253-4193.2016.02.008
Jiao Haifeng,Zheng Dan,Zhao Mingzhong,et al.Survey and resource evaluation of Mytilus coruscus for underwater visual censuses of Yushan Islands[J].Haiyang Xuebao,2016,38(2):84—92,
10.3969/j.issn.0253-4193.2016.02.008
S932.6
A
0253-4193(2016)02-0084-09
2015-09-02;
2015-11-23。
公益性行业(农业)科研专项(201303047);宁波市科技局攻关项目(2014C10018)。
焦海峰(1979—),男,山东省日照市人,博士,主要从事海洋生态学研究。E-mail:hfjiao@sina.com
尤仲杰(1958—),男,浙江省宁波市人,研究员,主要从事贝类生物学和海洋生态学研究。E-mail:zuiyou@163.com

