肝纤维化组织中抗衰老蛋白及抗增殖蛋白的表达及其作用机制
马 波 陈忠诚
(白城医学高等专科学校,吉林 白城 137000)
肝纤维化组织中抗衰老蛋白及抗增殖蛋白的表达及其作用机制
马 波 陈忠诚1
(白城医学高等专科学校,吉林 白城 137000)
目的 探讨肝纤维化大鼠肝组织中抗衰老标志蛋白(RGN)及抗增殖蛋白(PHB)的表达及其作用机制。方法 48只Wistar雄性大鼠随机分为正常对照组(12只)、造模组(36只)。使用猪血清诱导大鼠肝纤维化,造模成功后随机分为肝纤维化组(16只)、CGII干预组(16只)。CGII干预组给予60 mg/ml CGII肌肉注射,肝纤维化组和正常对照组给予等量的等渗盐水肌肉注射,1次/d,连续6 w。取大鼠肝组织行HE和Masson染色;RT-PCR检测肝组织中RGN和PHB mRNA表达,免疫组化检测蛋白表达。结果 HE和Masson染色显示,肝纤维化组大鼠纤维化程度明显高于正常对照组;CGII干预组大鼠肝组织胶原变细、减少,纤维化程度较肝纤维化组明显改善。纤维化组大鼠肝组织中RGN和PHB蛋白表达量明显少于正常对照组(P<0.01);CGII干预组RGN和PHB蛋白表达量明显高于纤维化组(P<0.01)。肝纤维化组RGN和PHB mRNA表达水平明显低于正常对照组(P<0.05);CGII干预组RGN和PHB mRNA表达水平明显高于肝纤维化组(P<0.01)。结论 RGN和PHB在大鼠肝纤维化组织中表达降低,与肝纤维化存在相关性。
肝硬化;抗衰老蛋白;抗增殖蛋白
活化的肝星状细胞(HSC)产生胞外基质异常沉积是肝纤维化的病理基础。肝损伤后抗衰老标志蛋白(RGN)及其基因表达下调〔1〕;抗增殖蛋白(PHB)可能通过抗细胞增殖抑制肾小管间质纤维化〔2〕;推测二者可能与肝纤维化存在关系,但目前仍未见相关报道。本研究使用猪血清诱导肝纤维化大鼠模型,并选用抗肝纤维化药物谷胱甘肽复方注射液(CGII)进行干预,观察肝组织中RGN和PHB的表达变化。
1 材料与方法
1.1 动物与试剂 健康清洁级Wistar雄性大鼠48只,质量230~270 g,购于长春市亿斯实验动物技术有限责任公司,动物合格证号:SCXK(吉):2011-0004。猪血清购于南京森贝伽生物科技有限公司;CGII、等渗盐水购于重庆药友制药有限责任公司;衰老标记蛋白(SMP)30、sPM311一抗,Envision两步法免疫组化试剂盒购于上海西宝生物科技有限公司。
1.2 分组与建模 48只大鼠随机分为正常对照组(12只)、造模组(36只)。造模组腹腔注射猪血清0.5 ml/只,2次/w,连续8 w;随机处死4只行病理学检查,病理改变符合大鼠肝纤维化病理诊断标准3~4级改变。正常对照组腹腔注射等渗生理盐水0.5 ml/只,2次/w,连续8 w。造模成功后将造模组剩余的32只随机分为肝纤维化组和CGII干预组,每组16只。CGII干预组大鼠肌肉注射60 mg/ml的CGII,2.7 mg/kg,1次/d;肝纤维化组和正常对照组大鼠肌肉注射等剂量的等渗盐水。每周称重1次,调整给药剂量,连续6 w。
1.3 检测指标
1.3.1 肝组织病理学检查 取三组大鼠相同部位肝组织,4%多聚甲醛溶液固定1 d,常规组织脱水,石蜡包埋后3 μm连续
切片,行苏木素-伊红(HE)和Masson染色。光学显微镜下观察肝组织病理学改变并依据Ishak方法分级。
1.3.2 肝组织RGN和PHB mRNA表达量 Trizol试剂盒提取肝组织总RNA,纯化后采用紫外分光光度法测定RNA量和纯度。取1 000 ng总RNA,逆转录合成cDNA第一链,将此作为模板行实时定量PCR,获得每个样本的起始拷贝数。以β肌动蛋白为对照,每组样本分2份,在指数期内设定参数值,得到每个PCR反应的Ct值。以标本的目的片段与带内参片段的Ct比值为该标本表达的相对值,将对照组表达量为100%,计算另外两组mRNA的相对表达量。
1.3.3 免疫组化检测 采用Elivision两步法,石蜡切片常规脱蜡水化,高压热修复抗原,滴加一抗(1∶500),4℃孵育过夜,滴加二抗,二氨基联苯胺(DAB)显色后HE复染。光学显微镜下每张切片选取4个高倍镜视野,计数100个细胞,肝组织细胞质染成黄色或棕黄色为阳性,计算阳性细胞百分比。
1.4 统计学方法 应用SPSS17.0软件行t检验。
2 结 果
2.1 三组大鼠肝组织HE和Masson染色 正常对照组大鼠肝组织细胞以中央静脉为中心放射状排列,索条状排列的肝细胞形成肝细胞索,其间有肝血窦。肝纤维化组大鼠肝小叶结构破坏,肝细胞索排列紊乱,汇管区结缔组织增生形成纤维间隔,包绕并分割正常肝组织,纤维化程度明显高于正常对照组。CGII干预组大鼠肝组织胶原变细、减少,向肝小叶延伸,纤维化程度较肝纤维化组明显改善。见图1。
2.2 三组大鼠肝组织RGN和PHB蛋白表达 正常对照组大鼠肝组织RGN主要表达于肝实质和间质细胞内,细胞核存在部分表达;PHB主要表达于细胞质、汇管区、细胞间质,少数表达于细胞核。纤维化组大鼠肝组织中RGN和PHB蛋白表达量明显少于正常对照组(P<0.01);CGII干预组RGN和PHB蛋白表达量明显高于纤维化组(P<0.01)。见图2,表1。
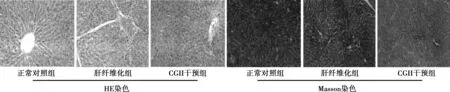
图1 三组大鼠肝组织HE和Masson染色(×200)

图2 三组大鼠肝组织RGN和PHB蛋白的免疫组化染色(×400)

分组nRGNPHB正常对照组1262.19±6.8556.97±5.34肝纤维化组1611.96±3.701)15.61±3.861)CGII干预组1648.69±6.362)44.83±2.552)
与正常对照组相比:1)P<0.05;与肝纤维化组相比:2)P<0.05;下表同
2.3 三组大鼠肝组织RGN和PHB mRNA表达 肝纤维化组RGN和PHB mRNA表达水平明显低于正常对照组(P<0.05);CGII干预组RGN和PHB mRNA表达水平明显高于肝纤维化组(P<0.01)。见表2。

表2 三组大鼠肝组织RGN和PHB mRNA相对表达量
3 讨 论
RGN为一种高保守的亲水性蛋白,主要分布于肝、肾细胞中,维持胞内钙离子平衡,在钙离子信号传导中发挥关键作用。研究发现,肝损伤、高血压会导致RGN表达下调〔3〕。在肝纤维化发病机制中,细胞因子和胞内钙离子浓度在肝组织星状细胞激活中起到重要作用,转化生长因子(TGF)β1、血小板衍生长因子(PDGF)是其中的两个关键细胞因子〔4〕。TGFβ1可激活HSC中的电压依赖性钙通道,增加胞外钙离子内流,连续性提升胞内钙离子,激活HSC,其中TGFβ1和Smad4信号分子表达,可上调ERK、PDGF表达,进一步激活HSC,其大量增殖胶原蛋白,形成肝纤维化。而RGN可与钙离子结合,抑制PKC激活,下调PDGF和TGFβ1的表达。
PHB为一种由细胞核DNA编码的高保守蛋白质,主要分布于细胞核、细胞膜、线粒体中。PHB参与衰老、凋亡、转录调节、细胞周期等多种细胞活动。研究发现肾小管间质纤维化的肾组织基因谱中PHB基因出现明显下调,推测其可能是介导肾纤维化的一个重要基因〔5〕。体外研究显示,PDB可有效抑制TGFβ1介导的成纤维细胞增殖活化和胞外基质的生成,该过程可能通过非Smads信号通路完成〔6〕。考虑到肝损伤是肝纤维化的起始因素,而肝损伤时RGN蛋白和mRNA表达减少;PHB还可通过抗细胞增殖来抑制肾小管间质纤维化,但二者与肝纤维化的关系仍鲜有报道。
CGII是根据俄罗斯抗肝纤维化药物仿制而成的药物,主要有效成分为肌酐和氧化型谷胱甘肽。CGII可有效缓解猪血清诱发的肝纤维化,提升肝组织中的还原型谷胱甘肽含量,降低过氧化物酶和基质金属蛋白酶(MMP)-13的表达,降低TGFβ1、PDGF、B淋巴细胞瘤-2相关蛋白的表达〔7〕。本研究结果也显示CGII可有效改善猪血清诱发的大鼠肝纤维化程度。
本次研究重点在于比较正常肝组织、纤维化肝组织、CGII干预的纤维化肝组织中RGN和PHB蛋白的表达变化,结果显示,RGN和PHB与肝纤维化存在相关性,而其与HSC、TGFβ1等多种细胞因子在肝纤维化过程中的关系仍需进一步研究。
1 Rauscher I,Eiber M,Ganter C,etal.Evaluation of T1ρ as a potential MR biomarker for liver cirrhosis:Comparison of healthy control subjects and patients with liver cirrhosis〔J〕.Eur J Radiol,2014;83(6):900-4.
2 Yeung LW,Guruge KS,Taniyasu S,etal.Profiles of perfluoroalkyl substances in the liver and serum of patients with liver cancer and cirrhosis in Australia〔J〕.Ecotoxicol Environ Saf,2013;96(1):139-46.
3 Kim AY,Kim YK,Lee MW,etal.Detection of hepatocellular carcinoma in gadoxetic acid-enhanced MRI and diffusion-weighted MRI with respect to the severity of liver cirrhosis〔J〕.Acta Radiol,2012;53(8):830-8.
4 Gu JJ,He XH,Li WT,etal.Safety and efficacy of splenic artery coil embolization for hypersplenism in liver cirrhosis〔J〕.Acta Radiol,2012;53(8):862-7.
5 Cao H,Huang H,Xu W,etal.Fecal metabolome profiling of liver cirrhosis and hepatocellular carcinoma patients by ultra performance liquid chromatography-mass spectrometry〔J〕.Analy Chim Acta,2011;691(1/2):68-75.
6 Terai S,Takami T,Yamamoto N,etal.Status and prospects of liver cirrhosis treatment by using bone marrow-derived cells and mesenchymal cells〔J〕.Tissue Eng Part Rev,2014;20(3):206-10.
7 Oliveira-Junior MC,Monteiro AS,Leal-Junior ECP,etal.Low-level laser therapy ameliorates CCl4-induced liver cirrhosis in rats〔J〕.Photochem Photobiol,2013;89(1):173-8.
〔2015-11-15修回〕
(编辑 袁左鸣)
吉林省教育厅课题(2015ZCY214)
马 波(1972-),女,副教授,主要从事内科学研究。
R57
A
1005-9202(2016)20-4978-03;
10.3969/j.issn.1005-9202.2016.20.016
1 白城市医院

