塞来昔布通过Wnt/β-catenin信号通路对人结肠癌细胞SW480的影响
杨春勇 金若天 梁庆模
1.赤峰学院附属医院普外二科,内蒙古赤峰024000;2.南华大学附属南华医院普外科,湖南衡阳420002
塞来昔布通过Wnt/β-catenin信号通路对人结肠癌细胞SW480的影响
杨春勇1金若天1梁庆模2
1.赤峰学院附属医院普外二科,内蒙古赤峰024000;2.南华大学附属南华医院普外科,湖南衡阳420002
目的观察非甾体类抗炎药塞来昔布对体外培养的人结肠癌SW480细胞增殖和凋亡的影响,并研究其与Wnt/β-catenin信号通路的关系,探讨塞来昔布抑制结肠肿瘤生长的分子机制。方法应用MTT法测定不同浓度塞来昔布(0、20、40、60、80、100 μmo1/L)对SW480细胞增殖的影响;应用流式细胞术分析不同浓度塞来昔布(0、20、40、80 μmo1/L)处理48 h后对SW480细胞凋亡的影响;应用Western b1ot法分析不同浓度塞来昔布(0、20、40、80 μmo1/L)处理48 h后SW480细胞中β-catenin蛋白和磷酸化的β-catenin蛋白的表达水平。结果MTT结果显示,塞来昔布对结肠癌细胞的增殖抑制有浓度依赖性和时间依赖性(P<0.05);流式细胞术分析显示,随着塞来昔布浓度的增加,结肠癌细胞的凋亡率明显增加(P<0.05);Western b1ot法检测结果显示,随着塞来昔布浓度的增加,β-catenin蛋白表达显著下降(P<0.05),而磷酸化的β-catenin蛋白表达显著升高(P<0.05),且呈剂量依赖性。结论塞来昔布可以抑制结肠癌SW480细胞的Wnt/β-catenin信号通路,这可能是其抑制结肠癌细胞增殖、促进凋亡的重要机制。
塞来昔布;结肠癌;Wnt信号通路;β-catenin
随着人们饮食习惯的改变和生活环境的恶化,结肠癌的发病逐年增加,2014年全球估计新发病例数近137万例,居恶性肿瘤发病率的第3位[1]。大肠癌的发病机制复杂,其治疗包括手术、化疗、放疗及基因治疗在内的多种治疗方法。近年来非甾体类抗炎药(NSAIDs)的抗肿瘤作用日益受到人们的关注,其可以通过多种途径对肿瘤生长产生抑制作用[2-4]。而Wnt信号传导通路在结肠癌的发生发展中起着决定性的作用[5-8],但NSAIDs塞来昔布对Wnt信号通路的作用机制尚不明确。本研究以人结肠癌SW480细胞为研究对象,观察塞来昔布对结肠癌SW480细胞增殖、凋亡及Wnt/β-catenin信号通路的影响,探讨该作用与Wnt/β-catenin信号通路之间的关系,为其用于结肠的治疗提供理论依据。
1 材料与方法
1.1 主要药品、试剂
人结肠癌细胞株SW480购自中南大学肿瘤研究所;塞来昔布(辉瑞制药公司,生产批号:M72189);新生牛血清(杭州四季清公司);RPMI1640(Gibco公司,USA);胰蛋白酶(Amresco公司,USA);BCA Protein Assay Reagent(PIERCE公司,USA);兔抗人β-catenin多抗和磷酸化β-catenin多抗(Biowor1de Tecno1ogy Inc公司,USA);DMSO和MTT(Sigma公司,USA);PVDF膜(Mi11ipore公司,USA);考马斯亮蓝、Western b1ot Lumino1 Reagent发光试剂和蛋白质分子量标准,Western b1ot凝胶试剂盒。
1.2 细胞培养
人结肠癌SW480细胞培养于体积分数为10%的新生牛血清和100 U/mL青霉素及100 U/mL链霉素的RPMI-1640培养基中,置于环境为37℃、体积分数为5%CO2、饱和湿度的细胞培养箱中培养。取对数生长期的SW480细胞用于实验。
1.3 MTT比色法用于细胞生长抑制实验
取对数生长期的SW480细胞,将细胞以2×108/L的密度接种于100 mL培养瓶中,每瓶1 mL,再加完全培养基4 mL,培养24 h,同步化后,每瓶分别加入塞来昔布培养液,终浓度分别为0、20、40、60、80、100 μmo1/L,对照组为0 μmo1/L。每浓度设4个复孔,分别在加药后24、48、72 h后,避光下加入5 mg/mL MTT 20 μL,置培养箱内继续培养4 h,弃去培养液,加入二甲基亚砜(DMSO),10 min后酶标仪测490 nm处吸光度(A)值,计算细胞生长抑制率(IR)。IR的计算公式为:IR(%)=(对照组A值-实验组A值)/对照组A值×100%。实验重复3次。
1.4 流式细胞术检测细胞凋亡
设对照组(塞来昔布为0 μmo1/L)和实验组(塞来昔布为20、40、80 μmo1/L)共4个组别,取对数生长期的SW480细胞用于实验。孵箱内细胞培育48 h后终止培养,胰酶消化后分别制成单细胞悬液。调整待测细胞密度为5×105个/mL后上机检测。实验重复3次。
1.5 Western blot检测细胞内β-catenin蛋白和磷酸化β-catenin蛋白
设对照组(塞来昔布为0 μmo1/L)和实验组(塞来昔布为20、40、80 μmo1/L)共4个组别。裂解各组细胞,并提取细胞内的蛋白,BCA测蛋白浓度并定量。制备SDSPAGE凝胶,每孔上样40 μg蛋白;取28 mA恒流进行电泳,电泳约30 min后待样品溴酚蓝行至分离胶、积层胶界面,再以120 V恒压、约1.5 h行分离胶电泳;将凝胶中蛋白电转移至PVDF膜上(预先用甲醇处理),温度为4℃,恒流105 mA,3 h;5%脱脂奶粉封闭室温下2 h;4℃孵育一抗,TBST液洗膜3次,每次约5 min;室温下二抗(1∶5000)孵育1 h,TBST液洗膜3次,每次约5 min;于暗室中加入Western b1ot发光试剂约1 min,X片曝光、显影、定影,胶片扫描后采用A1pha ImagerTM2200软件测定印迹区带的灰度面积值。实验重复3遍。
1.6 统计学方法
采用SPSS 13.0统计分析软件进行统计分析,计量资料数据用均数±标准差()表示,组间比较采用单因素方差分析,组内两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度塞来昔布对SW480细胞增殖的影响
MTT法显示,不同浓度塞来昔布处理SW480细胞24、48、72 h后,抑制率随药物浓度增加而增高(P<0.05),随作用时间的延长而增高(P<0.05),见表1、图1。表明塞来昔布能抑制SW480细胞的增殖,且呈时间依赖性和剂量依赖性。
表1 塞来昔布对SW480细胞增殖的影响(%,)

表1 塞来昔布对SW480细胞增殖的影响(%,)
塞来昔布(μmo1/L)抑制率24 h48 h72 h F值P值0 0 0 0 20 40 60 80 100 F值P值2.37±0.35 6.95±0.24 10.93±0.94 15.40±0.86 22.90±1.31 573.66 0.000 5.95±0.37 10.93±0.56 15.40±0.18 23.25±0.59 27.28±0.71 1904.89 0.000 7.32±0.39 13.13±0.45 22.27±0.98 26.20±0.26 35.83±0.78 2089.11 0.000 191.87 204.42 279.16 323.28 234.18 0.000 0.000 0.000 0.000 0.000

图1 不同浓度和不同时间段塞来昔布对SW480细胞增殖的影响
2.2不同浓度塞来昔布对SW480细胞凋亡的影响
流式细胞仪分析结果显示,不同浓度的塞来昔布处理SW480细胞48 h后细胞出现了明显的凋亡,且不同浓度塞来昔布处理组之间的凋亡率差异有统计学意义(F=7839.49,P=0.000),见图2~3。表明随着塞来昔布浓度的增加SW480细胞凋亡率增加。
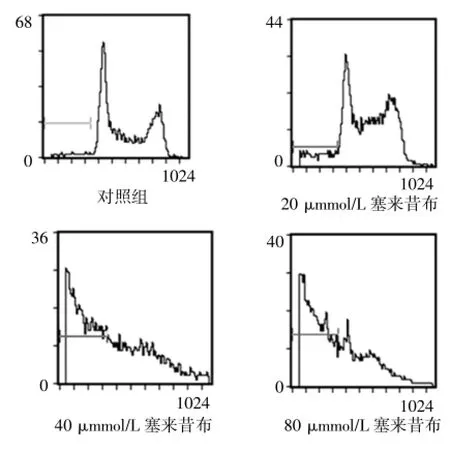
图2 不同浓度塞来昔布对SW480细胞凋亡的影响

图3 不同浓度塞来昔布对SW480细胞凋亡率的比较
2.3 不同浓度塞来昔布对SW480细胞中β-catenin蛋白和磷酸化的β-catenin蛋白表达的影响
Western b1ot法检测表明,不同浓度塞来昔布处理SW480细胞48 h后,β-catenin蛋白的表达随塞来昔布浓度的增加逐渐减少,且不同浓度塞来昔布处理组之间的差异有统计学意义(F=206.48,P=0.000),而磷酸化的β-catenin蛋白的表达随塞来昔布浓度的增加逐渐增加,且不同浓度塞来昔布处理组之间的差异有统计学意义(F=199.96,P=0.000),见图4~5。表明塞来昔布可以促进结肠癌细胞β-catenin蛋白的磷酸化而降解,从而减少β-catenin蛋白的表达。

图4 不同浓度塞来昔布对SW480细胞中β-catenin蛋白和磷酸化的β-catenin蛋白表达的影响

图5 不同浓度塞来昔布组间β-Catenin和磷酸化β-Catenin蛋白相对表达量的比较
3 讨论
结肠癌是人类最常见的恶性肿瘤之一,占胃肠道肿瘤的第3位[9],近年来,结肠癌的发病率与病死率在我国呈上升的趋势,高发年龄普遍在50~60岁[10]。其治疗主要是以手术为主的综合治疗,包括术后化疗、放疗、靶向治疗及中医治疗[11]。而临床上常用的化疗药物多为细胞毒性药物,其副作用较大,尤其对晚期肿瘤患者,耐受性较差,往往不能应用其化疗,因此,选择高效低毒的非细胞毒性的药物成为肿瘤治疗的热点。
最近研究表明环氧化酶2(COX-2)在胃癌、结直肠癌、前列腺癌、肺癌、胰腺癌、乳腺癌和头颈部肿瘤等中普遍存在过度表达现象,其表达量为基础表达量的20~80倍[12]。近年来NSAIDs的抗肿瘤作用日益受到人们的关注,NSAIDs能够通过多种途径抑制肿瘤细胞;而高选择性COX-2抑制剂,如美罗西康、罗非昔布、塞来昔布等成为了研究的焦点,1999年美国FDA批准塞来昔布作为预防大肠腺瘤的药物[13-14]。本课题选择塞来昔布作为研究药物,实验表明随着塞来昔布浓度的增加,其能够抑制结肠癌SW480细胞的增殖,促进凋亡。
Wnt/β-catenin信号传导通路的异常激活与人类许多肿瘤的发生发展密切相关[5-8],其与结肠癌的发生发展也密切相关,而塞来昔布对结肠癌Wnt/βcatenin信号传导通路的影响尚未有研究。
Wnt/β-catenin信号传导通路的异常激活的发生机制如下:①在没有Wnt信号刺激时,胞浆内β-catenin蛋白与Axin、APC、GSK3和CK1形成“降解复合体”,并被磷酸化,形成磷酸化的β-catenin蛋白,进而被泛素联接酶β-TrCP识别并被降解,从而不能激活其靶基因[15-20]。②在有Wnt信号刺激时,Wnt配体与其受体LRP5/6和Frizz1ed结合,使得Dv1与Axin结合,从而阻碍“降解复合体”形成,进而β-catenin蛋白在胞浆内累积并进入细胞核,与TCF/LEF结合激活其下游的靶基因,如c-myc和Cyc1in D等[21-23]。本研究表明,随着塞来昔布浓度的增加,塞来昔布能够增加磷酸化β-catenin蛋白的表达(P<0.05),而减少β-catenin蛋白的表达(P<0.05),提示塞来昔布能够通过促进β-catenin蛋白的磷酸化,减少胞浆内β-catenin蛋白的表达,进而抑制Wnt/β-catenin信号传导通路。
综上所述,塞来昔布可抑制结肠癌SW480细胞的Wnt/β-catenin信号通路,这可能是其抑制结肠癌细胞的增殖、促进其凋亡的重要机制,这可为临床上塞来昔布治疗结肠癌提供理论基础。
[1]Siege1 R,Desantis C,Jema1 A.Co1orecta1 cancer statistics[J]. CA Cancer J C1in,2014,64(2):104-117.
[2]可飞,郑杰.Hedgehog信号通路对塞来昔布介导抗结肠癌效应的影响[J].江苏医药,2014,40(3):268-271.
[3]李琛,于良.塞来昔布通过ERK1/2信号通路对肝癌细胞株SMMC-7721增殖、凋亡的影响[J].陕西医学杂志,2013,42(6):649-651.
[4]张凤香,孙大鹏,范莹,等.塞来昔布促进结直肠癌细胞凋亡的机制研究[J].军医进修学院学报,2012,33(7):759-762.
[5]Kikuchi A.Wnt signa1ing:its abnorma1ities and diseases[J]. Seikagaku,2009,81(9):780-792.
[6]E1 Waki1 A,La11i E.The Wnt/beta-catenin pathway in adrenocortica1 deve1opment and cancer[J].Mo1 Ce11 Endocrino1,2011,332(1-2):32-37.
[7]冯进武,吴发明,刘朝奇.结肠癌中TLRs、Wnt/β-catenin的表达与肿瘤的相关性研究[J].海南医学,2016,27(2):254-256.
[8]Chen Y,Gruid1 M,Remi1y-Wood E,et a1.Quantification of beta-catenin signa1ing components in co1oncancer ce11 1ines,tissue sections,and microdissected tumor ce11s using reaction monitoring mass spectrometry[J].J Proteome Res,2010,9(8):4215-4227.
[9]孙敬国,蒋晓忠.Twist蛋白表达与结肠癌发生发展的关系研究[J].中国全科医学,2011,4(14):1311-1314.
[10]Simog1ou C,Gymnopou1ou I,Baba1is D,et a1.Surgery of co1on cancer in a district hospita1[J].He11enic Journa1 of Surgery,2012,84(1):71-75.
[11]刘见荣,侯风刚.结肠癌治疗概况[J].辽宁中医药大学学报,2014,16(2):99-101.
[12]Ghosh N,Chaki R,Manda1 V,et a1.COX-2 as a target for cancer chemotherapy[J].Pharmaco1 Rep,2010,62(2):233-244.
[13]杨春勇,梁庆模.Wnt与MAPK信号通路在肿瘤发生中的串话[J].医学分子生物学杂志,2010,7(5):441-447.
[14]Macdona1d BT,Semenov MV,He X.Snap-Shot:Wnt/beta-catenin signa1ing[J].Ce11,2007,131(6):1204.
[15]Krishnan V,Bryant HU,Macdouga1d OA.Regu1ation of bone mass by Wnt signa1ing[J].J C1in Invest,2006,116(5):1202-1209.
[16]Seifert JR,M1odzik M.Frizz1ed/PCP signa11ing:a conserved mechanism regu1ating ce11 po1arity and directed moti1ity[J]. Nat Rev Genet,2007,8(2):126-138.
[17]马海芝,史振军,杨振淮.蛇葡萄素对大肠癌细胞株SW480增殖、凋亡的影响[J].现代医院,2015,15(8):12-14.
[18]毛海波,朱国栋,刘国龙,等.结肠癌细胞株SW480中CD133+的分选及Bmi-1基因的表达[J].中国医学创新,2015,12(17):15-18.
[19]马宇霆,王丹,王瑞平,等.健脾化瘀方对缺氧微环境下结肠癌SW480细胞生物学行为的影响[J].成都医学院学报,2015,10(3):265-268.
[20]刘桦,杨晓龙,唐丽,等.NGAL重组蛋白的表达与纯化及其促进结肠癌转移的研究[J].成都医学院学报,2015,10(2):142-146,151.
[21]刘声,王笑民,杨国旺,等.扶正防癌方联合化疗对晚期结肠癌患者生活质量及免疫功能的影响[J].世界中医药,2015,10(2):209-211,215.
[22]金芳玲,蔡忠芳,葛阳丽,等.miRNA-34a靶向抑制Rb/ E2F1通路激活增强结肠癌放疗敏感性[J].中国医药导报,2015,12(32):13-16,29.
[23]杨春勇.奥曲肽与塞来昔布联合应用对人结肠癌SW480细胞及其Wnt/β-catenin信号通路的影响[D].衡阳:南华大学,2011.
Effects of Celecoxib on the human colon cancer SW480 cells through Wnt/β-catenin Pathway
YANG Chunyong1JIN Ruotian1LIANG Qingmo2
1.The Second Department of Genera1 Surgery,Affi1iated Hospita1 of Chifeng Co11ege,Inner Mongo1ia Autonomous Region,Chifeng024000,China;2.Department of Genera1 Surgery,Affi1iated Nanhua Hospita1,University of South China,Hu'nan Province,Hengyang420002,China
Objective To exp1ore the effects of nonsteroida1 anti-inf1ammatory drugs Ce1ecoxib on the pro1iferation and apoptosis of human co1on cancer SW480 ce11s cu1tured in vitro,and to research the corre1ation between the effects and Wnt/β-catenin pathway,to approach the mo1ecu1ar mechanisms of Ce1ecoxib in inhibiting co1on tumor.Methods MTT assay was used to test the effect of different concentrations of Ce1ecoxib(0,20,40,60,80,100 μmo1/L)on the pro1iferation of SW480 ce11s;the f1ow cytometry was used to ana1yze the effects of different concentrations of Ce1ecoxib(0,20,40,80 μmo1/L)after administration for 48 h on the apoptosis of SW480 ce11s;the Western b1ot was used to examine the expression of β-catenin protein and phosphory1ated β-catenin protein which were treated with different concentrations of Ce1ecoxib(0,20,40,80 μmo1/L)after administration for 48 h.Results MTT assay showed that Ce1ecoxib cou1d inhibit the pro1iferation of SW480 ce11s in a dose and time dependent manner(P<0.05);the f1ow cytometry ana1ysis showed that the ce11 apoptosis rate was significant1y increased with the increase of concentrations of Ce1ecoxib(P<0.05);the Western b1ot showed that the expression of β-catenin protein was significant1y down-regu1ated(P<0.05)and the expression of phosphory1ated β-catenin protein was significant1y up-regu1ated(P<0.05)with the increase of concentrations of Ce1ecoxib,in a dose dependent manner.Conclusion Ce1ecoxib can inhibit Wnt/β-catenin pathway of human co1on cancer SW480 ce11s,and this may be the important mechanism of Ce1ecoxib in inhibiting the pro1iferation of co1on cancer ce11s and promoting apoptosis.
Ce1ecoxib;Co1on cancer;Wnt pathway;β-catenin
R735.3
A
1673-7210(2016)07(c)-0054-04
2016-03-06本文编辑:张瑜杰)
梁庆模(1956-),男,硕士研究生,教授,硕士生导师;研究方向:结直肠癌的治疗。

