胡黄连苷Ⅱ对大鼠肾缺血再灌注损伤后肾细胞凋亡反应的保护作用
翁小东 王 磊 刘修恒 王 敏
武汉大学人民医院泌尿外科,湖北武汉430060
胡黄连苷Ⅱ对大鼠肾缺血再灌注损伤后肾细胞凋亡反应的保护作用
翁小东 王 磊 刘修恒 王 敏
武汉大学人民医院泌尿外科,湖北武汉430060
目的观察胡黄连苷Ⅱ对大鼠肾缺血再灌注损伤后肾细胞凋亡的保护作用。方法建立肾缺血再灌注损伤大鼠模型,将实验大鼠随机分为3组,即假手术组、缺血再灌注组和胡黄连苷Ⅱ组,每组10只。全自动生化分析仪检测大鼠血清肌酐(Cr)、尿素氮(BUN)浓度,光镜观察病理组织变化,免疫组化检测Caspase-3表达,Rea1-time PCR及Western b1ot检测Bax、Bc1-2和PARP-1表达水平。结果与假手术组比较,缺血再灌注组Cr、BUN水平均明显增高;光镜病理组织可见肾小管损伤明显;免疫组化示Caspase-3表达增强;Rea1-time PCR及Western b1ot检测Bax、PARP-1表达增强,而Bc1-2表达减轻,差异有统计学意义(P<0.05)。胡黄连苷Ⅱ组与缺血再灌注组比较,肾功能指标明显减低,肾小管上皮细胞损伤减轻,Caspase-3表达显著减弱,Bax与PARP-1的活性明显下降;Bc1-2表达显著增强,差异有统计学意义(P<0.05)。结论胡黄连苷Ⅱ在肾脏缺血再灌注损伤时能有效地保护肾功能,其作用机制可能与增加Bc1-2表达,降低Bax、PARP-1、Caspase-3等凋亡基因的表达有关。
缺血再灌注损伤;胡黄连苷Ⅱ;凋亡
急性肾损伤(acute kidney injury,AKI)是临床上常见的危重病症,由多种病因导致[1]。AKI因其较高的死亡率而具有重要的临床意义,至今仍然有30%~ 70%不等[2]。肾脏缺血再灌注损伤(ischemia-reperfusion injury,IRI)是导致AKI的重要因素之一,常发生在肾移植、保留肾单位手术、肾动脉狭窄、肾积水、主动脉搭桥手术、体外循环、栓塞性疾病、意外或医源性损伤中等。目前,用于减轻肾IRI的措施主要分为三类:药物干预、外科或机械性干预和基因治疗等,而寻求一种有效、廉价的措施,势必会产生较大的经济和社会效益。胡黄连根提取物含有多种萜类化合物和糖苷[3],胡黄连苷Ⅱ是提取物的主要活性成分之一。许多研究表明,胡黄连苷Ⅱ有大量的药理作用,包括神经保护、肝脏保护、抗炎、抗凋亡、免疫调节等作用[4-5],对心、脑和肢体IRI均有保护作用[6-9]。然而,其在肾IRI中的作用研究缺乏,因此笔者欲研究胡黄连苷Ⅱ在肾IRI中的作用及其机制。
1 材料与方法
1.1 模型的建立与分组
健康雄性SD大鼠30只,8~10周龄,购自武汉大学医学院实验动物中心(合格证号:42009800001176),体重为250~300 g,实验前适应性喂养1周,自由饮水、进食。采用随机数字表法将大鼠分为以下3组:①假手术组(n=10):腹腔注射20 g/L戊巴比妥钠(40 mg/kg),麻醉大鼠,然后游离双侧肾脏,切除右肾后缝合腹壁;②缺血再灌注组(n=10):手术步骤与假手术组相同,但在游离双侧肾脏及切除右肾后,用无创伤血管夹夹闭左肾动、静脉45 min进行缺血,然后开放血管夹进行再灌注24 h(既往文献研究表明再灌注24 h是研究肾脏缺血再灌注急性损伤的最佳时间点),肾脏由暗红变色鲜红色代表再灌注成功。③胡黄连苷Ⅱ组(n=10):手术步骤与缺血再灌注组相同,但在缺血45 min后、再灌注之初腹腔注射(关于胡黄连苷Ⅱ对器官缺血再灌注损伤的文献报道均采用的是腹腔注射)PicrosideⅡ(10 mg/kg),而假手术组和缺血再灌注组注射等量的1 mo1/L的PBS。
1.2 试剂
胡黄连苷Ⅱ购于天津奎青医药公司,TLR4抗体购自Santa Cruz公司,NF-κB抗体购Santa Cruz公司,BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所。
1.3 样本采集和处理
1.3.1 标本采集分别于缺血/再灌注损伤24 h后采集大鼠下腔腹腔静脉血待测,处死各组大鼠获取肾脏组织,一部分迅速置于-80℃中保存,另一部分用固定液固定后,常规石蜡包埋。
1.3.2 血清尿素氮渊BUN冤和肌酐渊Cr冤的检测将采集的大鼠血液标本常温离心3000 r/min,离心10 min后,使用O1ympus全自动生化分析仪(Au2700)测定血清Cr和BUN水平。
1.3.3 肾组织病理学检查取大鼠肾组织,用多聚甲醛固定后,脱水,透明,浸蜡,包埋,切片,脱蜡,HE染色,后在200倍光镜下观察其病理改变。
在接下来的现场测评环节,63名选民代表参加了投票。“优秀票57票,称职票5票,基本称职票1票,不称职票0票,总体评价为优秀。”镇人大主席宣布测评结果的话音刚落,会场响起了热烈的掌声,李兴军紧张的神情才稍稍放松了下来。
1.3.4 免疫组化测定Caspase-3的表达情况肾组织石蜡切片,厚4 μm,按SP法免疫组化试剂盒进行操作,加入Caspase-3(1∶100)抗体及相应二抗,DAB显色5 min后封片。细胞浆或细胞核有棕黄色表达者为阳性细胞。
1.3.5 Real-time PCR检测Bax尧Bcl-2和PARP-1常规Trizo1试剂抽提总RNA,核酸蛋白分析仪测定RNA浓度后,取总RNA 1 μg,逆转录生成cDNA。Bax上游引物:5′-TGAACTGGACAACAACATGGAG-3′,下游引物:5′-AGCAAAGTAGAAAAGGGCAACC-3′;Bc1-2上游引物:5′-TTTGATTTCTCCTGGCTGTCT-3′,下游引物:5′-CTGATTTGACCATTTGCCTG-3′;PARP-1上游引物:5′-TCTCCAATCGCTTCTACACC CT-3′,下游引物:5′-TACTGCTGTCATCAGACCCACC-3′;内参β-actin上游引物:5′-TGCTATGTTGCCCTAGACTTCG-3′,下游引物:5′-GTTGGCATAGAGGTCTTTACGG-3′。PCR反应条件均为:94℃预变性5 min,94℃变性30 s,58℃退火30 s,72℃延伸1 min,扩增35个循环,最后1次为72℃延伸7 min。结果以目的基因与β-actin的比值表示。
1.3.6 蛋白免疫印迹法渊Western blot冤检测Bax尧Bcl-2和PARP-1从-80℃冰箱中取出保存后的肾组织,采用BCA试剂盒检测蛋白浓度,取40 μg蛋白上样,用10%SDS-聚丙烯酰胺凝胶进行电泳,转膜,50 g/L脱脂牛奶封闭2 h,后加入1∶1000稀释的Bax、Bc1-2和PARP-1抗体,4℃下摇床过夜。之后与辣根过氧化物酶结合的羊抗大鼠抗体(1∶2000稀释)结合,洗膜后ECL法显色、照相。
1.4 统计学方法
采用SPSS 17.0统计软件进行数据处理,计量资料数据以均数±标准差()表示,采用方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清Cr和BUN水平的比较
与假手术组比较,缺血再灌注组和胡黄连苷Ⅱ组的Cr和BUN明显增高,差异有统计学意义(P<0.05)。胡黄连苷Ⅱ组的Cr和BUN水平较缺血再灌注组显著降低,差异有统计学意义(P<0.05)。见图1。
2.2 各组大鼠肾组织HE染色结果
2.3各组大鼠Caspase-3免疫组化染色结果
免疫组化结果显示:假手术组大鼠肾脏组织中Caspase-3很少表达,缺血再灌注损伤组强阳性表达,而PicrosideⅡ组为阳性表达,相比缺血再灌注损伤组明显减弱。见图3(封三)。
2.4 各组大鼠Real-time PCR结果比较
与假手术组比较,缺血再灌注组和PicrosideⅡ组Bax和PARP-1的mRNA水平显著增高,Bc1-2水平明显降低,差异有统计学意义(P<0.05)。PicrosideⅡ组的Bax、PARP-1的mRNA水平与缺血再灌注组比较明显减低,Bc1-2水平显著升高,差异有统计学意义(P<0.05)。见图4。
2.5 各组大鼠肾组织Bax、Bcl-2和PARP-1表达的比较
与假手术组比较,缺血再灌注组和PicrosideⅡ组Bax和PARP-1的蛋白表达水平显著增高,Bc1-2表达明显降低。PicrosideⅡ组Bax、PARP-1的蛋白水平与缺血再灌注组比较明显减低,Bc1-2的表达显著升高。见图5。

图1 各组大鼠血清Cr和BUN水平的比较
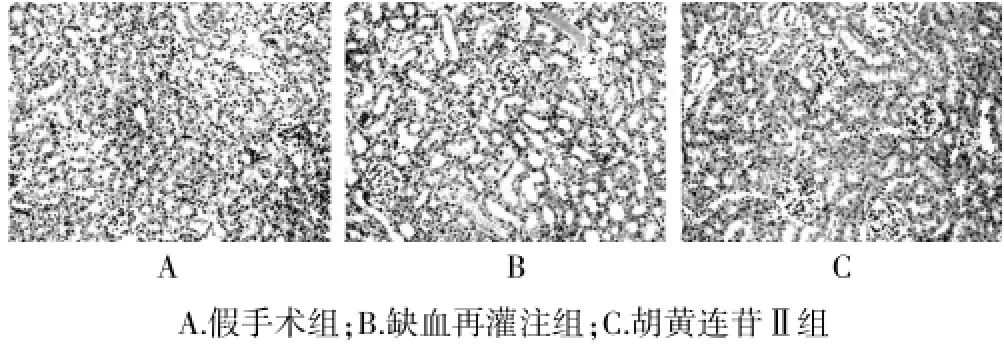
图2 各组大鼠肾组织HE染色结果(200×)
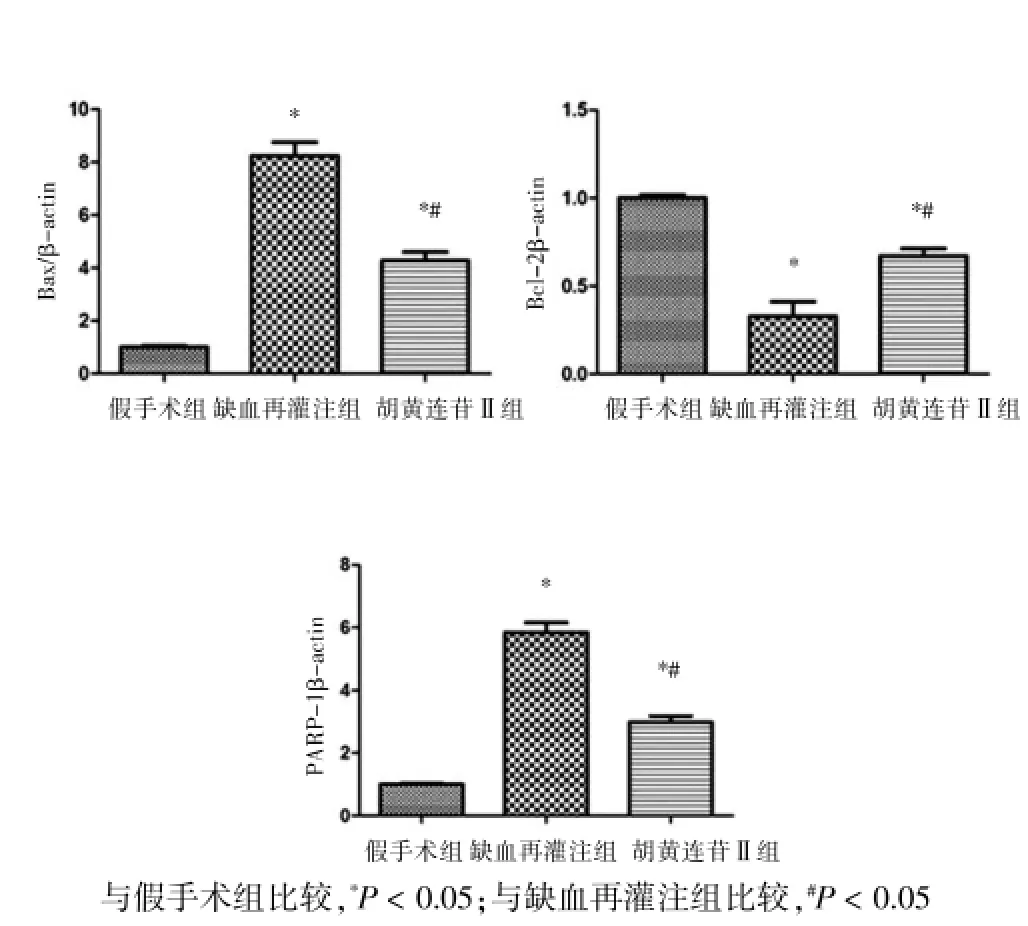
图4 各组大鼠Real-time PCR结果

图5 各组大鼠Western blot结果
3 讨论
肾IRI可以导致AKI、慢性肾衰和终末期肾病[1-2],并且是影响移植肾存活率的主要原因之一[10-11]。近年来研究证实,肾IRI通过影响免疫机制导致急性排斥反应(acute rejection,AR)的发生[12]。并且,随着免疫抑制剂的成熟运用,IRI作为最重要的非抗原依赖因素,可直接导致慢性排斥反应(chronic rejection,CR),移植肾失功能[13]。因此,努力寻求一种减轻肾脏IRI有效、廉价的措施,势必会产生较大的经济和社会效益。
肾脏IRI损伤的机制至今尚未完全阐明,主要学说包括氧自由基作用、白细胞作用、钙超载、活性因子作用等方面。据文献报道,移植肾脏缺血再灌注后引起的肾细胞凋亡是IRI的重要原因[14]。Bc1-2家族是关键的调节因子,既可以促进细胞成活如Bc1-2,也可以使细胞死亡如Bax[15]。Bc1-2水平的升高可以促进细胞存活并且有证据表明具有防止凋亡的效果[16]。然而,Bax启动细胞程序性死亡的关键调节子,是一种凋亡蛋白,由激活的Caspases启动。Bc1-2与Bax的比率决定细胞对凋亡刺激的敏感性[17-18]。本研究中,与假手术组比较,缺血再灌注组的Bax和PARP-1的表达水平显著增高,Bc1-2水平明显降低。胡黄连苷Ⅱ组Bax、PARP-1的表达水平与缺血再灌注组比较明显减低,Bc1-2水平显著升高。这表明,胡黄连苷Ⅱ可以有效抑制细胞的Bax/Bc1-2比率,进而抑制肾IRI导致的肾组织损伤。
研究表明,Caspase能促进和实现在哺乳动物细胞中的细胞凋亡,Caspase-3是Caspase级联反应瀑布中最关键的下游凋亡蛋白酶[19]。一些细胞外信号通过Fas受体途径激活Caspase-8,激活的Caspase-8促进Caspase活化,水解细胞特异性蛋白和聚腺苷二磷酸核糖聚合酶(PARP),从而诱导细胞凋亡[20]。在本研究中,与缺血再灌注组比较,胡黄连苷Ⅱ组的肾组织损伤明显减轻,Caspase-3表达水平明显减低。胡黄连苷Ⅱ组PARP-1 mRNA及蛋白表达水平明显减低。这表明胡黄连苷Ⅱ可以有效抑制细胞的Caspase凋亡通路。
胡黄连苷Ⅱ可作为一种有效、廉价的治疗措施,在减轻缺血再灌注对肾脏组织的损伤、改善肾功能方面具有潜在的应用价值。
[1]Schrier RW,Wang W,Poo1e B,et a1.Acute rena1 fai1ure:definitions,diagnosis,pathogenesis,and therapy[J].J C1in Invest,2004,114(1):5-14.
[2]Ke11um JA,Mehta RL,Levin A,et a1.Deve1opment of a c1inica1 research agenda for acute kidney injury using an internationa1,interdiscip1inary,three-step modified De1phi process[J].C1in J Am Soc Nephro1,2008,3(3):887-894.
[3]Zou LC,Zhu TF,Xiang H,et a1.New secoiridoid g1ycosides from the roots of Picrorhiza scrophu1ariif1ora[J]. Mo1ecu1es,2008,13(9):2049-2057.
[4]Meng FJ,Jiao SM,Yu B:PicrosideⅡprotects cardiomyocytes from hypoxia/reoxygenation induced apoptosis by activating the PI3K/Akt and CREB pathways[J].Int J Mo1 Med,2012,30(2):263-270.
[5]Li Q,Li Z,Xu XY,et a1.Neuroprotective properties of PicrosideⅡin a rat mode1 of foca1 cerebra1 ischemia[J]. Int J Mo1 Sci,2010,11(11):4580-4590.
[6]C,omu FM,K111c,Y,Ozer A,et a1.Effect of PicrosideⅡon erythrocyte deformabi1ity and 1ipid peroxidation in rats subjected to hind 1imb ischemia reperfusion injury[J]. Drug Des Deve1 Ther,2016,10:927-931.
[7]Wang T,Zhai L,Zhang H,et a1.PicrosideⅡinhibits the MEK-ERK1/2-COX2 signa1 pathway to prevent cerebra1 ischemic injury in rats[J].J Mo1 Neurosci,2015,57(3):335-351.
[8]Wu N,Li W,Shu W,et a1.Protective effect of PicrosideⅡon myocardia1 ischemia reperfusion injury in rats[J]. Drug Des Deve1 Ther,2014,8:545-554.
[9]Zhao L,Guo Y,Ji X,et a1.The neuroprotective effect of PicrosideⅡvia regu1ating the expression of mye1in basic protein after cerebra1 ischemia injury in rats[J].BMC Neurosci,2014,15:25.
[10]Mahfoudh-Boussaid A,Zaoua1i MA,Hauet T,et a1.Attenuation of endop1asmic reticu1um stress and mitochondria1 injury in kidney with ischemic postconditioning app1ication and trimetazidine treatment[J].J Biomed Sci,2012,19:71.
[11]Mik1os Z,Kurthy M,Degre11 P,et a1.Ischaemic postconditioning reduces serum and tubu1ar TNF-a1pha expression in ischaemic-reperfused kidney in hea1thy rats[J]. C1in Hemorheo1 Microcirc,2012,50(3):167-178.
[12]Wang W,Tang T,Zhang P,et a1.Postconditioning attenuates rena1 ischemia-reperfusion injury by preventing DAF down-regu1ation[J].J Uro1,2010,183(6):2424-2431.
[13]Jiang B,Chen Q,Liu X,et a1.Ischemic postconditioning protects rena1 function after 24 hours of co1d preservation in a canine autotransp1antation mode1[J].Transp1ant Proc,2012,44(6):1776-1781.
[14]Leone S,Noera G,Berto1ini A.Me1anocortins as innovative drugs for ischemic diseases and neurodegenerative disorders:estab1ished data and perspectives[J].Curr Med Chem,2013,20(6):735-750.
[15]Gibson ME,Han BH,Choi J,et a1.Bax contributes to apoptotic-1ike death fo11owing neonata1 hypoxia-ischemia:evidence for distinct apoptosis pathways[J].Mo1 Med,2001,7(9):644-655.
[16]Martinou JC,Frankowski H,Missotten M,et a1.Bc1-2 and neurona1 se1ection during deve1opment of the nervous system[J].J Physio1 Paris,1994,88(3):209-211.
[17]Gi11ardon F,Lenz C,Waschke KF,et a1.A1tered expression of Bc1-2,Bc1-X,Bax,and c-Fos co1oca1izes with DNA fragmentation and ischemic ce11 damage fo11owing midd1e cerebra1 artery occ1usion in rats[J].Brain Res Mo1 Brain Res,1996,40(2):254-260.
[18]Gi11ardon F,Wickert H,Zimmermann M.Up-regu1ation of bax and down-regu1ation of bc1-2 is associated with kainate-induced apoptosis in mouse brain[J].Neurosci Lett,1995,192(2):85-88.
[19]Prabhakar G,Vona-Davis L,Murray D,et a1.Phosphocreatine restores high-energy phosphates in ischemic myocardium:imp1ication for off-pump cardiac revascu1arization[J].J Am Co11 Surg,2003,197(5):786-791.
[20]Broughton BR,Reutens DC,Sobey CG.Apoptotic mechanisms after cerebra1 ischemia[J].Stroke,2009,40(5):e331-e339.
Protective effects of PicrosideⅡon aPoPtosis after renal ischemia-rePerfusion injury in rats
WENG XiaodongWANG LeiLIU XiuhengWANG Min
Department of Uro1ogy,Renmin Hospita1 of Wuhan University,Hubei Province,Wuhan430060,China
Objective To observe the effects of picrosideⅡon apoptosis of tubu1ar epithe1ia1 ce11s after rena1 ischemia-reperfusion injury in rats.Methods Estab1ishing rena1 ischemia-reperfusion injury rat mode1,the experiment rats were random1y divided into 3 groups:the sham group,ischemia and reperfusion group and picrosideⅡgroup.Each group had 10 rats.The concentrations of serum creatinine(Cr),b1ood urea nitrogen(BUN)in rats were determined by auto-biochemica1 ana1yzer,the rena1 histopatho1ogic changes were observed under the 1ight microscope,the expression of Caspase-3 were detected by immunohistochemistry,the expression of Bax,Bc1-2 and PARP-1 were detected by Rea1-time PCR and the Western b1ot.Results Compared with the sham group,the 1eve1s of Cr,BUN in the ischemia and reperfusion group were significant1y increased;the patho1ogica1 tissue under the 1ight microscope showed obvious rena1 tubu1e 1esion;the immunohistochemistry showed that the expression of Caspase-3 was enhanced;Rea1-time PCR and Western b1ot showed that the expression of Bax and PARP-1 was increased significant1y,and the expression of Bc1-2 was reduced significant1y,the differences were statistica11y significant(P<0.05).Compared with ischemia and reperfusion group,picrosideⅡgroup cou1d significant1y reduce rena1 function,mitigate rena1 tubu1ar epithe1ia1 ce11 injury,weaken the expression of Caspase-3,decrease the expression of Bax and PARP-1,but the expression of Bc1-2 was significant1y reinforced,the differences were statistica11y significant(P<0.05).Conclusion PicrosideⅡcan protect rena1 function from ischemia-repedusion injury and its mechanism may be through inhibiting the expression of Bax,PARP-1 and Caspase-3,and promoting the expression of Bc1-2.
Ischemia-reperfusion injury;PicrosideⅡ;Apoptosis
R285.5
A
1673-7210(2016)07(c)-0021-04
2016-03-26本文编辑:张瑜杰)
湖北省自然科学基金项目(2012FFA096);湖北省武汉市应用基础研究计划项目(2015060101010049)。

