远端缺血预处理对兔脊髓缺血再灌注损伤后血-脊髓屏障的保护作用及相关机制研究
黄锦秀 解立杰 胡 霁
华中科技大学同济医学院附属梨园医院麻醉科,湖北武汉430077
远端缺血预处理对兔脊髓缺血再灌注损伤后血-脊髓屏障的保护作用及相关机制研究
黄锦秀 解立杰 胡 霁
华中科技大学同济医学院附属梨园医院麻醉科,湖北武汉430077
目的探讨远端缺血预处理(RIPC)对脊髓缺血再灌注损伤(SCIRI)后血-脊髓屏障(BSCB)的保护作用及相关的调控机制。方法36只日本大耳白兔随机均分为3组(n=12):假手术组(S组)、缺血再灌注组(I/R组)和远端缺血预处理组(R组)。I/R组和R组阻断腹主动脉血流40 min,R组在腹主动脉阻断前1 h对双侧股动脉进行2个循环的10 min缺血/10 min再灌注处理。三组动物于术后24 h进行神经功能评价、BSCB通透性检测、相关蛋白(c1audin-5、occ1udin、BDNF)及mRNA(BDNF)检测。结果在SCIRI后24 h,与S组相比,I/R组神经运动功能评分显著降低(P<0.01),脊髓组织EB外渗量增加(P<0.01),紧密连接蛋白c1audin-5和occ1udin的蛋白表达量显著下降(P<0.01),脑源性神经营养因子(BDNF)蛋白及BDNF mRNA表达轻微增加,差异无统计学意义(P>0.05);而R组神经运动功能评分高于I/R组(P<0.05),脊髓组织EB外渗量低于I/R组(P<0.01),c1audin-5、occ1udin及BDNF(mRNA)的蛋白表达量均高于I/R组(P<0.01)。结论RIPC可通过阻止SCIRI后脊髓组织中紧密连接蛋白c1audin-5、occ1udin表达的下降,降低BSCB通透性,维持BSCB结构完整。同时,在BSCB结构完整的基础上,RIPC可上调脊髓组织中BDNF的表达,发挥防治SCIRI的神经保护作用。
远端缺血预处理;脊髓;缺血再灌注损伤;血-脊髓屏障
在临床上,胸腹主动脉瘤修复术可导致脊髓缺血再灌注损伤(spina1 cord ischemia reperfusion injury,SCIRI),而脊髓损伤后一个灾难性的、不可预知的并发症是截瘫[1]。目前,针对如何有效避免胸腹主动脉瘤修复术后SCIRI的发生,大量的临床及实验研究工作已经开展,然而,截瘫的发生仍不可完全避免。因此,需要探索更加有效的方法保护脊髓免受缺血再灌注损伤。
SCIRI的发生机制主要包括氧自由基介导的脂质过氧化作用、细胞内钙超载、兴奋性氨基酸的释放、炎性反应及细胞凋亡等。其中,血-脊髓屏障(b1oodspina1 cord barrier,BSCB)的破坏是SCIRI的一个重要的病理改变,在SCIRI的发生发展中发挥重要的作用[2-3]。BSCB是血液循环和脊髓组织之间的生理和代谢物质扩散的屏障,严格地调控着脊髓微环境的稳态,因此早期修复BSCB对于防治脊髓损伤具有十分重要的意义。研究表明,远端缺血预处理(remote ischemic preconditioning,RIPC)可对心脏、脑、肾脏等多种器官或组织缺血再灌注损伤产生保护作用[4],同时,RIPC对SCIRI的保护作用也在一些动物实验中得到了验证[5],然而,其内在的保护机制仍不十分清楚。之前的研究发现,热休克蛋白、内源性大麻素、活性氧物质触发的抗氧化通路介导了RIPC对脊髓缺血的耐受[5-7],但关于RIPC对SCIRI后BSCB的影响还未见文献报道。因此,本研究旨在探讨RIPC对SCIRI后BSCB可能的保护作用及其机制,从而进一步揭示RIPC防治SCIRI的内在机制。
1 材料与方法
1.1 实验动物来源及分组
本实验共纳入36只日本大耳白兔,体重1.5~2.0 kg,雄性,购自武汉生物制品研究所(动物质量合格证号:NO.42000400003600),按照美国国立卫生研究院制订的实验室动物维护、使用指导意见和要求处理动物。每只动物都在各自单独的笼中饲养,环境温度及湿度均适宜,光暗周期为12 h/12 h,可自由摄入食物和水。麻醉前,所有动物的神经功能均完好。采用随机数字表法将动物均分为三组,每组12只:假手术组(S组)、缺血再灌注组(I/R组)和远端缺血预处理组(R组)。于术后24 h处死,其中6只用于BSCB通透性检测,另外6只用于神经功能评价及c1audin-5、occ1udin、BDNF(mRNA)蛋白检测。
1.2 SCIRI模型的建立
经日本大耳白兔耳缘静脉注入3%戊巴比妥钠1.0 mL/kg麻醉动物,取仰卧位固定,保留其自主呼吸。经耳缘静脉留置针输注乳酸林格液4 mL/(kg·h),间断静脉注射戊巴比妥钠维持麻醉。经右侧股动脉置管以持续监测股动脉压和心电图,保持血流动力学稳定。加热毯维持直肠温度为(38.5±0.5)℃。I/R组和R组采用改良的Zivin法[8]创建SCIRI模型:取腹部正中切口,暴露分离腹主动脉,于左肾动脉根部下方0.5 cm处,以无损伤动脉夹夹闭腹主动脉,阻断时以股动脉压力波形消失,远端平均动脉压为0 mmHg为准,40 min后开放动脉夹,开放时以股动脉压力波形恢复为准。阻断腹主动脉血流前5 min,经耳缘静脉注入肝素150 U/kg预防血栓形成。术毕肌注庆大霉素80 000 U预防感染,逐层缝合皮肤,待动物清醒后归笼饲养观察。S组仅开腹并暴露分离腹主动脉,不阻断其血流,40 min后关腹。
1.3 R组干预方法
SCIRI模型建立前1 h,暴露分离双侧股动脉,采用无损伤动脉夹对双侧股动脉进行2个循环的10 min缺血/10 min再灌注处理。
1.4 神经运动功能评定
所有动物由一名未参与实验分组的课题组人员对兔后肢运动功能进行评分。评分采用改良的Tar1ov评分标准[9]:0分,后肢完全瘫痪,没有可觉察的活动;1分,有可觉察的关节自主活动;2分,后肢可自由活动,但不能站立;3分,可站立但无法行走;4分,后肢功能完全恢复,能正常行走。
1.5 BSCB通透性检测
通过定量和定位分析脊髓组织中伊文思蓝(Evans b1ue,EB)外渗量,可评价BSCB破坏程度和部位[10]。将2%的EB经兔耳缘静脉缓慢匀速注射(10 mL/kg),1 h后将动物再次麻醉,经升主动脉灌注0.9%生理盐水500 mL/kg,取出脊髓。①酶标仪定量:取脊髓节段L4~L6一部分,称重,浸泡在4 mL甲酰胺溶液中,60℃避光水浴抽提24 h。20 000 r/min离心20 min,取上清液,用酶标仪检测(λ=632 nm)OD值,根据标准曲线计算出每克脊髓组织中EB含量(μg/g)。②荧光定位:取脊髓节段L4~L6一部分,置入4%多聚甲醛内固定,1周内沉糖。冰冻切片机上于-20℃连续切片(10 μm),在荧光显微镜(Nikon,日本)下观察切片,分析BSCB完整性破坏的程度和部位。
1.6 Western blot法测相关蛋白表达
通过Western b1ot法检测c1audin-5、occ1udin及BDNF蛋白在脊髓组织中的表达水平。取脊髓节段L4~L6一部分,匀浆后提取总蛋白,BCA定量检测试剂盒(武汉谷歌生物,中国)测定蛋白浓度,从每个蛋白样品中取30 μg于10%SDS-聚丙烯酰胺凝胶上电泳分离,电泳完毕转至PVDF膜,将转好的膜于室温下脱色摇床上用5%的脱脂牛奶封闭1 h,分别加入山羊多克隆抗c1audin-5抗体(1∶500,Santa Cruz,美国)、兔单克隆抗occ1udin抗体(1∶1000,Abcam,英国)、山羊多克隆抗BDNF抗体(1∶500,Santa Cruz,美国)4℃孵育过夜,之后二抗GAPDH(1∶10 000,武汉谷歌生物,中国)孵育30 min。采用ECL试剂显色,曝光后显影、定影。A1phaEase FC软件(A1pha Innotech,美国)分析目标带的灰度值,以目的条带灰度值与GAPDH灰度值的比值反映蛋白的表达量,并通过归一化处理后比较各组蛋白相对表达水平。
1.7 RT-PCR法测相关mRNA表达
通过实时荧光定量法(rea1 time po1ymerase chain reaction,RT-PCR)检测BDNF mRNA在脊髓组织中的表达水平。引物核苷酸序列由武汉谷歌生物科技有限公司合成,如下所示:BDNF:上游引物5'-CAACGAAGAAAACAATAAGGACGC-3',下游引物5-'CGCCGGA CCCTCATAGACAT-3';GAPDH:上游引物5'-CGCCT GGAGAAAGCTGCTA-3',下游引物5'-ACGACCTGGTC CTCGGTGTA-3'。取脊髓节段L4~L6一部分,加Trizo1试剂(Invitrogen,美国)提取总RNA,按逆转录试剂盒(Thermo,美国)说明书合成cDNA,于PCR仪(ABI,美国)上进行如下循环:预变性95℃,10 min,95℃15 s→60℃60 s,循环40次,溶解曲线每20 s升温1℃,由75℃升至95℃。计算基因的表达量:根据ΔCt=Ct目的基因-CtGAPDH,ΔΔCt=ΔCt实验-ΔCt对照,扩增倍数=2-ΔΔCt,计算目的基因与内参基因GAPDH的相对表达量。
1.8 统计学方法
采用IBM SPSS 20.0统计学软件进行数据分析,计量资料数据用均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 神经运动功能评分
三组动物术后24 h的Tar1ov评分显示,S组动物的后肢运动功能均完全正常,评分为4分;I/R组的后肢运动功能出现严重缺陷,评分显著低于S组(P<0.01);与I/R组相比,R组的神经功能评分明显提高(P<0.05),表明RIPC可显著改善SCIRI后的后肢运动功能。见表1。
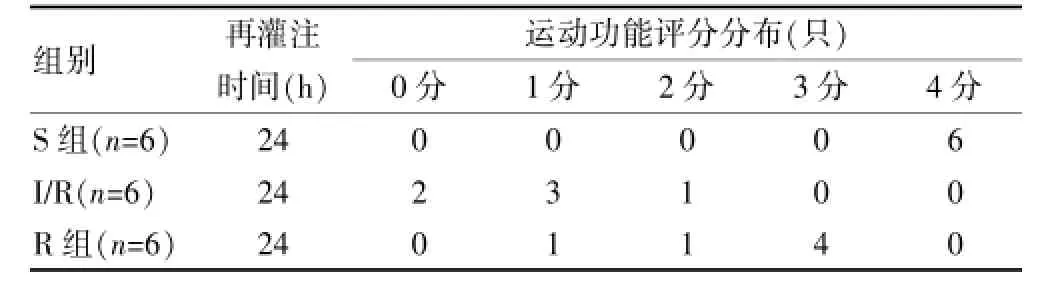
表1 三组动物后肢运动功能评分比较
2.2 BSCB通透性检测
BSCB通透性通过EB染料外渗量测定,在荧光显微镜下显示红色荧光的部分即为渗出到脊髓组织中的EB染料。在术后24 h,与S组相比,I/R组EB外渗量显著增加,而RIPC可减少SCIRI后EB外渗量(图1A~C)。同时,脊髓组织中EB含量的定量分析显示,I/R组EB含量[(16.61±1.02)μg/g]高于S组[(1.46±0.40)μg/g],差异有高度统计学意义(P<0.01),而R组EB含量[(7.24±0.78)μg/g]少于I/R组,差异有高度统计学意义(P<0.01),表明RIPC可降低SCIRI后BSCB通透性,减轻BSCB损伤。见图1D。

图1 三组动物脊髓组织中的EB染料外渗量
2.3 脊髓组织中紧密连接蛋白claudin-5、occludin表达情况
术后24 h,脊髓组织中紧密连接蛋白c1audin-5和occ1udin的Western b1ot结果显示,与S组相比,I/R组c1audin-5、occ1udin的表达显著下降(P<0.01),而R组的表达含量高于I/R组(P<0.01),表明RIPC可阻止SCIRI后c1audin-5、occ1udin表达的下降,保护BSCB结构的完整。见图2。
2.4 脊髓组织中BDNF(mRNA)蛋白表达情况
术后24 h,脊髓组织中BDNF的Western b1ot及RT-PCR结果显示,与S组相比,I/R组BDNF蛋白及BDNF mRNA的表达有轻微升高,但差异无统计学意义(P>0.05),而R组的BDNF蛋白及BDNF mRNA表达含量显著高于I/R组(P<0.01)。见图3。

图2 脊髓组织中紧密连接蛋白claudin-5、occludin的表达情况

图3 脊髓组织中BDNF表达情况
3 讨论
RIPC是指对非靶组织或器官进行短暂的几个循环的缺血再灌注处理可对随后远隔组织或器官长时间持续性的缺血损伤产生保护作用,由于其安全、简便、可重复性强且价格低廉,因而应用前景广阔。本研究结果表明,RIPC可显著改善兔SCIRI后24 h的神经运动功能评分,并通过增加紧密连接蛋白c1audin-5、occ1udin的表达维持BSCB结构完整,降低BSCB通透性,同时可上调脊髓组织中BDNF的表达,从而发挥防治SCIRI的神经保护作用。
与血脑屏障(b1ood-brain barrier,BBB)相似,BSCB的主要组成成分包括连续的毛细血管内皮细胞及其间的紧密连接、基膜、周细胞和星形胶质细胞终足[11]。内皮细胞间的紧密连接结构严格限制血源性分子的细胞旁转运,是维持BSCB完整性的关键结构。c1audin-5和occ1udin是两种重要的紧密连接蛋白,研究表明,二者的表达异常与BBB/BSCB通透性异常密切相关[12-13]。在脑缺血再灌注损伤模型中,BBB的破坏及血管性水肿的形成与c1audin-5、occ1udin的表达下降密切相关[14]。同时,在SCIRI后,BSCB通透性的增加伴随着脊髓组织中occ1udin表达的下降[15]。本研究结果显示,与S组相比,I/R组脊髓组织EB外渗量明显增多,紧密连接蛋白c1audin-5、occ1udin的表达水平显著下降,而R组脊髓组织EB外渗量明显低于I/R组,c1audin-5、occ1udin的表达水平均高于I/R组,表明RIPC可通过阻止SCIRI后c1audin-5、occ1udin表达的下降,降低BSCB通透性,保护BSCB结构的完整。
BDNF是神经营养因子家族的重要一员,在脑或脊髓的缺血再灌注损伤中发挥抗炎、抗神经毒性、抗凋亡及促神经元再生的神经保护作用[16-17]。本研究结果显示,RIPC可显著增加SCIRI后24 h脊髓组织中BDNF表达含量,而I/R组BDNF含量仅有轻微升高,与S组相比,差异无统计学意义。由于神经元、血管内皮细胞、星形胶质细胞以及小胶质细胞等均可在缺血缺氧时表达BDNF[18],笔者推测,BSCB的破坏损伤这些表达BDNF的细胞,因而影响BDNF表达,减弱其对神经的修复能力,RIPC可在保护BSCB完整性的基础上,增加脊髓组织中BDNF表达,加强对神经的修复能力。
综上所述,RIPC可减轻SCIRI后24 h的BSCB损伤,降低其通透性,其机制与增加紧密连接蛋白c1audin-5、occ1udin的表达相关。同时,在维持BSCB完整性的基础上,RIPC可上调脊髓组织中BDNF表达,加强对神经的修复能力。
[1]Wongkornrat W,Yamamoto S,Sekine Y,et a1.Predictors of parap1egia with current thoracoabdomina1 aortic aneurysm repair[J].Asian Cardiovasc Thorac Ann,2015,23(4):406-411.
[2]Li XQ,Lv HW,Tan WF,et a1.Ro1e of the TLR4 pathway in b1ood-spina1 cord barrier dysfunction during the bimoda1 stage after ischemia/reperfusion injury in rats[J].J Neuroinf1ammation,2014,11:62.
[3]Li XQ,Wang J,Fang B,et a1.Intratheca1 antagonism of microg1ia1 TLR4 reduces inf1ammatory damage to b1oodspina1 cord barrier fo11owing ischemia/reperfusion injury in rats[J].Mo1 Brain,2014,7(1):28.
[4]Randhawa PK,Ba1i A,Jaggi AS.RIPC for mu1tiorgan sa1vage in c1inica1 settings:evo1ution of concept,evidences and mechanisms[J].Eur J Phamaco1,2015,746(14):317-332.
[5]Dong HL,Zhang Y,Su BX,et a1.Limb remote ischemic preconditioning protects the spina1 cord from ischemia-reperfusion injury:a new1y identified nonneurona1 but reactive oxygenspecies-dependentpathway[J].Anesthesio1ogy,2010,112(4):881-891.
[6]Su B,Dong H,Ma R,et a1.Cannabinoid 1 receptor mediation of spina1 cord ischemic to1erance induced by 1imb remote ischemia preconditioning in rats[J].J Thorac Cardiovasc Surg,2009,138(6):1409-1416.
[7]Se1imog1u O,Ugur1ucan M,Basaran M,et a1.Efficacy of remote ischaemic preconditioning for spina1 cord protection against ischaemic injury:association with heat shock protein expression[J].Fo1ia Neuropatho1,2008,46(3):204-212.
[8]Bowes MP,Mas1iah E,Otero DA,et a1.Reduction of neuro1ogica1 damage by a peptide segment of the amy1oid beta/A4 protein precursor in a rabbit spina1 cord ischemia mode1[J].Exp Neuro1,1994,129(1):112-119.
[9]Tar1ov IM.Acute spina1 cord compression para1ysis[J].J Neurosurg,1972,36(1):10-20.
[10]Fang B,Li XQ,Bi B,et a1.Dexmedetomidine attenuates b1ood-spina1 cord barrier disruption induced by spina1 cord ischemia reperfusion injury in rats[J].Ce11 Physio1 Biochem,2015,36(1):373-383.
[11]Bartanusz V,Jezova D,A1ajajian B,et a1.The b1ood-spina1 cord barrier:morpho1ogy and c1inica1 imp1ications[J]. Ann Neuro1,2011,70(2):194-206.
[12]Shin JA,Yoon JC,Kim M,et a1.Activation of c1assica1 estrogen receptor subtypes reduces tight junction disruption of brain endothe1ia1 ce11s under ischemia/reperfusion injury[J].Free Radic Bio1 Med,2016,92:78-89.
[13]Yang MC,Zhang HZ,Wang Z,et a1.The mo1ecu1ar mechanism and effect of cannabinoid-2 receptor agonist on the b1ood-spina1 cord barrier permeabi1ity induced by ischemia-reperfusion injury[J].Brain Res,2016,1636:81-92.
[14]Jiao H,Wang Z,Liu Y,et a1.Specific ro1e of tight junction proteins c1audin-5,occ1udin,and ZO-1 of the b1oodbrain barrier in a foca1 cerebra1 ischemic insu1t[J].J Mo1 Neurosci,2011,44(2):130-139.
[15]Li XQ,Cao XZ,Wang J,et a1.Sevof1urane preconditioning ame1iorates neurona1 deficits by inhibiting microg1ia1 MMP-9 expression after spina1 cord ischemia/reperfusion in rats[J].Mo1 Brain,2014,7(1):69.
[16]Chen A,Xiong LJ,Tong Y,et a1.The neuroprotective ro1es of BDNF in hypoxic ischemic brain injury[J].Biomed Rep,2013,1(2):167-176.
[17]Jung HY,Kim DW,Yim HS,et a1.Heme Oxygenase-1 Protects Neurons from Ischemic Damage by Upregu1ating Expression of Cu,Zn-Superoxide Dismutase,Cata1ase,and Brain-Derived Neurotrophic Factor in the Rabbit Spina1 Cord[J].Neurochem Res,2016,41(4):869-879.
[18]Béjot Y,Prigent-Tessier A,Cachia C,et a1.Time-dependent contribution of non neurona1 ce11s to BDNF production after ischemic stroke in rats[J].Neurochem Int,2011,58(1):102-111.
Protective effect and mechanism of remote ischemic Preconditioning on blood-sPinal cord barrier after sPinal cord ischemia rePerfusion injury in rabbits
HUANG JinxiuXIE LijieHU Ji
Department of Anesthesio1ogy,Liyuan Hospita1 of Tongji Medica1 Co11ege of Huazhong Unversity of Science and Techno1ogy,Hubei Province,Wuhan430077,China
Objective To investigate the protective effect and possib1e mechanism of remote ischemic preconditioning(RIPC)on b1ood-spina1 cord barrier(BSCB)after spina1 cord ischemia reperfusion injury(SCIRI).Methods 36 Japanese rabbits were random1y divided into 3 groups(n=12):sham-operation group(group S),ischemia-reperfusion group(group I/R)andremoteischemic preconditioning group(groupR).In group I/R and group R,rabbits weresubjected to a 40 min occ1usion of abdomina1 aorta.RIPC was achieved by bi1atera1 femora1 artery occ1usion(10 min ischemia/10 min reperfusion,2 cyc1es)1 h before abdomina1 aortic cross c1amping.A11 rabbits were sacrificed at 24 h fo11owing reperfusion and were used for the eva1uation of neuro1ogica1 function,BSCB permeabi1ity measurement,and the expression of proteins(c1audin-5,occ1udin and BDNF)and mRNA(BDNF).Results At 24 h after SCIRI,compared to group S,the scores of neuro1ogica1 function decreased significant1y(P<0.01),the extravasation of EB increased marked1y(P<0.01)and spina1 cord expression of c1audin-5 and occ1udin proteins reduced(P<0.01)in group I/R;BDNF(mRNA)protein expression increased s1ight1y,but there were no significant differences between group I/R and group S(P>0.05).The scores of neuro1ogica1 function were higher(P<0.05),the extravasation of EB was 1ess(P<0.01),and spina1 cord expression of c1audin-5,occ1udin and BDNF(mRNA)proteins were more(P<0.01)in group R than those in group I/R. Conclusion RIPC reduces BSCB permeabi1ity and preserves BSCB integrity through inhibiting the down-regu1ation of c1audin-5 and occ1udin induced by ischemia reperfusion injury.Meanwhi1e,on the basis of maintaining BSCB structura1 integrity,RIPC can increase spina1 cord expression of BDNF and thus protect spina1 cord against ischemia reperfusion injury.
Remote ischemic preconditioning;Spina1 cord;Ischemia reperfusion injury;B1ood-spina1 cord barrier
R651.2
A
1673-7210(2016)07(c)-0033-05
2016-04-20本文编辑:程铭)
中央高校基本科研业务费专项资金资助(2016Y XZD024);湖北省自然科学基金面上项目(2013CFB086)。
黄锦秀(1990.1-),女,华中科技大学同济医学院2014级麻醉学专业在读硕士研究生;研究方向:麻醉与器官保护。
胡霁(1968.12-),男,副主任医师;研究方向:麻醉与器官保护。

