原发性食管恶性黑色素瘤临床病理分析
郑增光,孙文勇
(浙江省肿瘤医院,浙江 杭州310022)
原发性食管恶性黑色素瘤临床病理分析
郑增光,孙文勇*
(浙江省肿瘤医院,浙江 杭州310022)
目的探讨原发性食管恶性黑色素瘤(PMME)的临床病理特点、鉴别诊断及预后。方法回顾性分析5例PMME的临床病理资料并复习相关文献。结果5例中男3例,女2例,年龄49~63岁,平均56.8岁。肿瘤位于食管中下段1例,下段4例,临床上表现为进食梗阻或剑突下隐痛不适;大体可见肿块呈息肉样隆起或溃疡浸润生长;组织学上,肿瘤主要由核异型明显的圆形、多边形和梭形细胞组成,可伴有或不伴有细胞质内黑色素沉着。免疫组化HMB45(+)、Melan-A(+)、SOX-10(+)、Ki-67增殖指数40%~50%。1例放弃治疗;4例选择手术根治治疗,其中1例外加术后免疫治疗,失访1例,余3例均死亡,生存时间6.5~21个月。结论原发性食管恶性黑色素瘤是一种罕见的食管恶性肿瘤,恶性程度高,确诊时多有淋巴结或远处转移。确诊有赖于常规病理及免疫组化证实。鉴于该肿瘤恶性程度高,术后分子靶向治疗和生物免疫疗法有助于提高患者生存时间。
食管;恶性黑色素瘤;病理诊断;鉴别诊断
恶性黑色素瘤是较少见、恶性程度极高的非上皮源性肿瘤,主要发生在体表皮肤,也可发生在鼻咽、口腔、外阴、眼球等部位,发生于食管者较罕见,约占食管恶性肿瘤 0.2%~0.3%[1],原发性食管恶性黑色素瘤(primary malignant melanoma of esophagus,PMME)早期就可发生淋巴结和肝脏等远处转移;病理组织学形态多样,容易误诊。本文报道5例PMME并复习相关文献,探讨该肿瘤的临床病理特点,以提高对此类肿瘤的认识。
1 资料与方法
1.1一般资料收集2006年1月~2015年12月本院病理科5例确诊为食管恶性黑色素瘤的临床病理资料。本组男3例,女2例,年龄49~63岁,平均(56.8±6.8)岁。肿瘤位于食道中下段1例,下段4例。所有患者均有无明显诱因下发生进食梗阻或剑突下隐痛不适,且有进行性加重趋势。5例均行胸腹部及头颅CT检查,其中1例发现肺多发结节(考虑转移癌),其余4例未发现食管外其他病灶。本组临床资料详见表1。

表1 本组临床资料
1.2方法标本经10%中性福尔马林固定,常规脱水、包埋、切片及HE染色,光镜观察。免疫组化采用SP法,检查抗体包括HMB-45、Melan-A、SOX-10、S-100、CK、EMA、LCA、Vim、Des、SMA、Calponin、CD117、CD34、DOG1、Ki-67。抗体和试剂盒均购自北京中杉金桥公司。操作步骤按说明书进行;AEC显色观察,其中阳性细胞为HMB-45、Melan-A胞质显示红色,SOX-10、Ki-67胞核显示红色,S-100胞质和胞核均显示红色。
2 结果
2.1巨检3例隆起息肉样肿物,瘤体最大长径分别为2.5cm、3cm和4.5cm,2例呈灰黑色,1例灰红色,切面实性、质软,浸润至黏膜下至浅肌层;例3呈髓质型浸润生长,浸润至外膜伴食管周巨大癌结节形成;另1例放弃治疗,未做巨检。
2.2镜检肿瘤细胞弥漫片状或巢团状排列,间质血管丰富,部分区可见片状坏死;肿瘤细胞大小不等,呈梭形、圆形或多角形,细胞边界欠清,胞浆丰富嗜伊红,染色质颗粒粗大,核仁明显,病理性核分裂易见。肿瘤细胞胞质内常富含黑色素颗粒(图1),但亦可无黑色素颗粒沉着(图2)。
2.3免疫组化肿瘤细胞HMB45(+)(图3)、SOX-10(+)(图4)、Melan-A(+)(图5)、S-100(+)(图6)、Ki-67增殖指数40%~50%(图7),不表达CK、EMA、LCA、Des、SMA、Calponin、CD117、CD34、DOG1等标记物。
3 讨论
恶性黑色素瘤起源于神经嵴黑色素细胞,食管黏膜基底层及上皮与间质交界部位存在黑色素细胞是发生PMME的基础。截止目前,国内外共报道300余例。近年来,随着国内恶性肿瘤发病率的升高,原发于食管的恶性黑色素瘤也陆续有个案报道[2-4]。
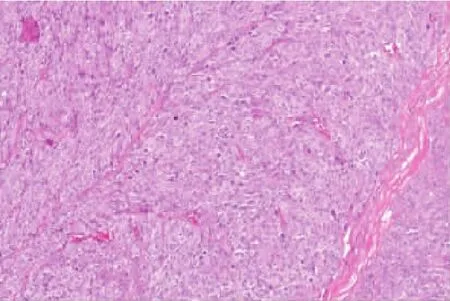
图2 肿瘤细胞弥漫片状生长,形态呈上皮样(HE×200)
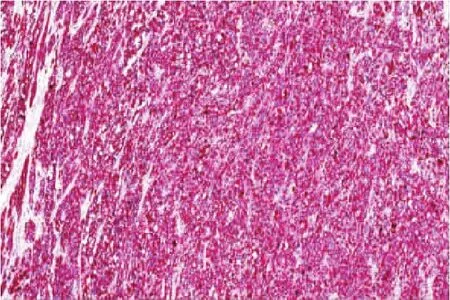
图3 HMB45细胞质弥漫强阳性(SP法,AEC×100)

图4 梭形细胞SOX-10胞核阳性(SP法,AEC×100)
3.1临床特征PMME主要见于中老年人,中位年龄60.5岁,男性多于女性,比例约2:1,好发于食管中下1/3段[5]。进食梗阻、吞咽困难、胸骨后或剑突下不适及体质量减轻是其主要症状;PMME进展迅速,40%~80%患者确诊时已出现转移,常见的转移部位有食管和贲门周淋巴结、纵隔、肝脏等[5-6]。本组5例平均年龄57.8岁,男性3例,女性2例,5例肿块均位于食管中下段,临床表现与既往报道类似,均出现进食梗阻不适,其中例5因剑突下隐痛不适就诊;4例手术切除患者中2例有淋巴结或邻近脏器累犯,与报道基本相符。影像学上,PMME钡餐造影可见龛影或充盈缺损等改变;CT可发现食管管壁不规则增厚,密度相对均匀,管腔不同程度狭窄,伴或不伴食管、贲门周围淋巴结肿大及邻近脏器累犯;胃镜可见食管黏膜呈不规则隆起或凹陷,管壁僵硬,通常有黑色素沉着,少数无色素性恶性黑色素瘤也可无明显色泽改变,与食管其他肿瘤不易区分。
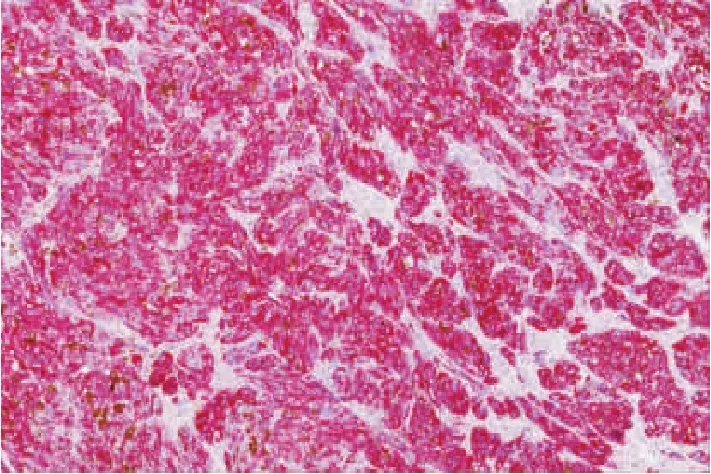
图5 Melan-A细胞质弥漫强阳性(SP法,AEC×100)
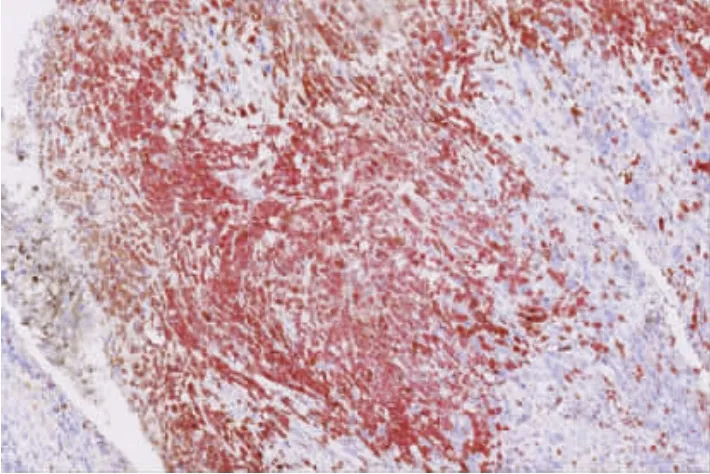
图6 S-100细胞质和细胞核均阳性(SP法,AEC×100)

图7 Ki-67增殖指数约45%
3.2病理特征PMME常呈息肉样,亦可呈髓质型浸润生长;多数肉眼可见黑色素沉着,呈灰黑色外观,部分病例可无黑色素沉积;镜下肿瘤细胞弥漫片状或巢团状排列,间质血管丰富,部分区可见片状坏死;肿瘤细胞大小不等,呈圆形、多角形或不规则形,细胞边界欠清,胞浆丰富嗜伊红,胞质内可有或无黑色素颗粒沉着,染色质颗粒粗大,核仁明显,病理性核分裂易见。多数病例肿瘤细胞均同时表达HMB45、Melan-A、SOX-10、S-100,而不表达CK和LCA等标记,Ki-67增殖指数40%~50%;免疫组化的原理是利用抗原与抗体结合后形成免疫复合物,通过化学反应使标记于免疫复合物上的显示剂显示一定的颜色,并可借助光学显微镜观察其颜色变化。DAB显色系统是实验室最常用的免疫组化显色试剂,将定位在细胞不同部位的抗原显示棕黄色而便于观察,但在某些组织中与内外源性棕黄色颗粒不易区分。AEC显色系统能将定位在细胞不同部位的抗原显示为红色,可有效避免内、外源性棕黄色色素颗粒的干扰。在色素较多的恶性黑色素瘤、细胞性蓝痣等色素性病变的诊断中,AEC显色系统具有较好的应用价值。
3.3鉴别诊断PMME组织学形态多样,尤其对于无色素沉着的PMME,极易误诊。PMME需与以下肿瘤相鉴别:(1)低分化癌:分化差的鳞状细胞癌或腺癌,大体上呈息肉隆起型或浸润型,镜下肿瘤细胞异型明显,可呈圆形、卵圆性或多角形,与PMME不易区分,免疫组化有助鉴别,低分化癌CK(+)、HMB45(-)、SOX-10(-),而PMME则恰恰相反。(2)食管平滑肌肉瘤或胃肠间质瘤:呈现梭形细胞的恶性黑色素瘤应与平滑肌肉瘤或胃肠间质瘤相鉴别。免疫组化有助鉴别:平滑肌肉瘤SMA(+)、Calponin(+),胃肠间质瘤CD34(+)、CD117(+)及DOG1(+),但两者HMB-45(-)、SOX-10(-)。(3)食管肉瘤样癌:肿瘤细胞呈上皮样和梭形细胞样分化,两者通常有移行过渡,免疫组化表达上皮和间叶标记CK(+)、Vim(+),而HMB-45(-)、SOX-10(-)。(4)食管神经内分泌肿瘤:形态需与淋巴细胞样恶性黑色素瘤鉴别,免疫组化:神经内分泌肿瘤CK(+)、CD56(+)、Syn(+)、CgA(+),而 HMB-45(-)、SOX-10(-)。(5)食管恶性淋巴瘤:部分恶性黑色素瘤呈小淋巴细胞样且弥漫分布,需与淋巴瘤相鉴别;淋巴瘤LCA(+)、HMB-45(-)、SOX-10(-),而PMME则LCA(-)、HMB-45(+)、SOX-10(+)。
3.4治疗与预后目前PMME首选手术治疗,但PMME恶性程度高,早期就可发生局部淋巴结或肝肺等远隔脏器转移,综合治疗模式逐渐应用于临床。既往研究显示术后放化疗虽可控制局部复发,但并不能延长患者的生存时间[7]。近年来生物免疫治疗和针对MAPK信号通路的分子靶向治疗在恶性黑色素瘤中取得了一定进展,包括树突状细胞回输免疫疗法在内的生物免疫治疗对恶性黑色素瘤有明显的效果[8],达拉菲尼和伊马替尼等针对MAPK信号通路的分子靶向药可提高晚期患者的生存时间[9-10],但在PMME中的应用尚缺乏统计分析。本组例2术后进行树突状细胞回输免疫疗法治疗,在一段时间内取得了一定疗效,1年后复发转移至肺脏、肝脏,总生存时间21个月;例3和例5术后未进行其他处理,分别于发病后6个半月和11个半月后死亡。
总之,PMME恶性程度高、预后差,容易发生远处转移,术后分子靶向治疗和生物免疫疗法有助于提高患者生存时间。
[1] Tachimori Y,Ozawa S,Numasaki H,et al.Comprehensive Registry of Esophageal Cancer in Japan(2009).Esophagus,2016,13:110
[2]郑金锋,莫海英,马淑芳,等.食管原发性恶性黑色素瘤5例临床病理学观察.临床与实验病理学杂志,2014,30(10):1090
[3]刘肖琼,马钊,陈传贵,等.原发性食管恶性黑色素瘤的临床及预后分析.中华胃肠外科杂志,2016,19(1):86
[4] Liu H,Yan Y,Jiang CM.Primary Malignant Melanoma of the Esophagus With Unusual Endoscopic Findings:A Case Report and Literature Review.Medicine(Baltimore),2016,95(17):e3479
[5] Iwanuma Y,Tomita N,Amano T,et al.Current status of primary malignant melanomaoftheesophagus:clinical features,pathology,management and prognosis.J Gastroenterol,2012,47(1):21.
[6]Lu TJ,Huang TW,Lee SC.Primary malignant melanoma of the esophagus.Hematol Oncol Stem Cell Ther,2008,1(4):246
[7]Garbe C,Eigentler TK,Keilholz U,et al.Systematic review of medical treatment in melanoma:current status and future prospects.Oncologist,2011,16(1):5
[8] Hasskamp JH,Elias EG,Zapas JL.In vivo effects of sequential granulocyte-macrophage colony stimulating factor(GM-CSF)and interleukin-2(IL-2)on circulating dendritic cells(DC)in patients with surgically resected high risk cutaneous melanoma.J Clin Immunol,2006,26(4):331
[9]Flaherty KT,Puzanov I,Kim KB,et al.Inhibition of mutated,activated BRAF in metastatic melanoma.N Engl J Med,2010,363(9):809
[10]Flaherty KT,Hamilton BK,Rosen MA,et al.Phase I/II TrialofImatinibandBevacizumabinPatientsWith AdvancedMelanomaandOtherAdvancedCancers. Oncologist,2015,20(8):952
*为通讯作者,E-mail:sunweny2222@163.com

