水飞蓟宾增强TRAIL对MDA-MB-231细胞的凋亡诱导活性研究
金丽
(浙江省立同德医院,浙江杭州310012)
水飞蓟宾增强TRAIL对MDA-MB-231细胞的凋亡诱导活性研究
金丽
(浙江省立同德医院,浙江杭州310012)
目的探讨中药活性成分水飞蓟宾对增强TRAIL对三阴乳腺癌细胞的凋亡诱导的能力并研究其机制。方法将三阴乳腺癌细胞系MDA-MB-231分为对照组、水飞蓟宾组、TRAIL组及水飞蓟宾联合TRAIL组,MTT法检测MDA-MB-231细胞的细胞活力,Annexin V/PI染色检测MDA-MB-231细胞的凋亡,免疫共沉淀联合Western blot法检测MDA-MB-231细胞FADD-caspase-8死亡受体复合物的形成,Western blot法检测MDA-MB-231细胞caspase-8的活化和FADD的表达水平。结果MTT实验结果表明TRAIL体外单独治疗仅能轻微抑制MDA-MB-231的细胞活力,联合水飞蓟宾后TRAIL对MDA-MB-231细胞活力的抑制率显著提升。流式细胞实验结果表明TRAIL体外单独治疗对MDA-MB-231的凋亡诱导活性较低,联合水飞蓟宾后TRAIL对MDA-MB-231的凋亡诱导活性显著提高。免疫共沉淀联合western blot实验结果表明水飞蓟宾在体外能显著上调MDA-MB-231细胞中FADD蛋白的表达水平而TRAIL不能影响其表达,同时水飞蓟宾还能显著促进TRAIL依赖的FADD-caspase-8复合物的形成和caspase-8的活化。转染FADD siRNA后,水飞蓟宾对TRAIL的协同作用丧失。结论水飞蓟宾通过上调去泛素化酶FADD的表达水平促进TRAIL依赖的RIP1蛋白的去泛素化进而诱导三阴乳腺癌细胞caspase-8的活化和凋亡的发生。
水飞蓟宾;TRAIL;三阴乳腺癌;FADD;caspase-8;凋亡
三阴乳腺癌是乳腺癌的一种亚型,其癌细胞表面不表达雌激素受体、孕激素受体和Her2受体,因此缺乏靶向治疗的生物靶点,只能采取化疗或生物治疗的方法[1]。然而在临床治疗中往往会发现肿瘤细胞对药物治疗的敏感性很低,因此寻找辅助治疗药物提高化疗或生物治疗的敏感性有十分重要的意义[2]。本研究的目的在于研究中药活性成分水飞蓟宾是否能发挥对肿瘤坏死因子相关的凋亡诱导配 体(TNF-related apoptosis-inducing ligand,TRAIL)的协同作用,报道如下。
1 材料与方法
1.1材料噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT),水飞蓟宾,TRAIL购于美国R&D Systems,Annexin V/PI凋亡检测试剂盒购于美国Sigma-Aldrich。细胞提取液、Fas相关死亡域蛋白(Fas-associating protein with a novel death domain,FADD)抗体、前caspase-8(p ro-caspase-8)抗体、活化型 caspase-8(cleaved caspase-8)抗体和 β-actin抗体购于美国 Cell Signaling。蛋白G免疫共沉淀琼脂糖珠购于美国Santa Cruz。FADD siRNA购于广州锐博生物科技有限公司。Lipofectamine 2000购于美国Invitrogen。ECL(增强型化学发光底物)试剂盒购于美国Pierce。
1.2方法
1.2.1细胞培养本研究从2014年2月~2015年12月完成于本院实验室。人三阴乳腺癌细胞系MDA-MB-231购于美国ATCC(美国模式菌种收集中心)。将细胞培养在含10%胎牛血清的DMEM培养基中,培养环境为37℃恒温培养箱中培养并通入5%CO2。细胞每2~3天传代1次,传代时,用胰酶消化液使细胞进入悬浮状态并用DMEM培养基洗涤2次,将细胞悬液按1:3稀释后传代。
1.2.2细胞实验将MDA-MB-231细胞按5×103/孔接种在96孔板上,分为对照组、水飞蓟宾组、TRAIL组和水飞蓟宾+TRAIL组,分组培养方法详见表1,药物处理时间为48小时。(1)细胞活力检测:药物处理完毕后在培养体系中加入20μL 5g/L MTT再培养4小时,弃去上清,往孔中加入150μL二甲亚砜,在570nm波长下用酶标仪检测OD值,细胞活力抑制率用以下公式计算:抑制率=(OD对照组-OD治疗组)/OD对照组×100%。(2)细胞凋亡实验:药物处理完毕后将细胞用生理盐水洗涤2次,按照凋亡试剂盒说明书步骤将PI(碘化丙啶)和Annexin-V加入细胞中孵育20分钟,采用流式细胞术检测肿瘤细胞的凋亡,凋亡率用Annexin-V阳性细胞数占总细胞数的百分比表示。(3)免疫共沉淀:药物处理完毕后对MDA-MB-231细胞进行计数,取2×106的各组细胞用免疫沉淀缓冲液进行裂解,缓冲液的成分如下:50 mmol/L Tris-HCl(pH 7.4),1%NP-40细胞裂解液,150 mmol/L NaCl,1 mmol/L EDTA,1%混合蛋白酶抑制剂(Sigma-Aldrich)。MDA-MB-231细胞在裂解液下处理15分钟后,将其在12000g下离心10分钟,收取上清液并在其中加入FADD抗体孵育过夜,之后加入蛋白G琼脂糖珠孵育2小时。孵育完成后将其在1200g速度下离心5分钟,将琼脂糖珠离心至管底,之后将上清液小心吸去,琼脂糖珠用免疫沉淀缓冲液洗涤2次后加入western blot上样缓冲液,沸水浴煮5分钟后备用,用于检测与RIP1结合的泛素蛋白。(4)Western blot实验:药物处理完毕后将细胞用生理盐水洗涤2遍并提取总蛋白质。将蛋白提取液或免疫共沉淀处理样品用12.5%SDS-PAGE进行电泳分离。分离完毕后通过电转方法将蛋白质从分离胶上转到PVDF膜上,用FADD抗体、procaspase-8抗体、cleaved caspase-8抗体或β-actin抗体孵育过夜,之后再用带辣根过氧化物酶的二抗孵育2小时,蛋白条带用ECL试剂盒显色发光。

表1 MDA-MB-231细胞实验分组方法
2 结果
2.1水飞蓟宾显著提高TRAIL对MDA-MB-231的凋亡诱导效应细胞活力检测结果显示水飞蓟宾或TRAIL单用对MDA-MB-231细胞的杀伤活性较弱,但两者联合后,其对乳腺癌肿瘤细胞的杀伤活性显著增强。流式细胞实验结果显示,水飞蓟宾能显著提高TRAIL对MDA-MB-231细胞的凋亡诱导活性,表明水飞蓟宾和TRAIL存在协同抗乳腺癌效应,能显著诱导肿瘤细胞的凋亡通路。详见表2。
表2 各组对MDA-MB-231的抗肿瘤活性(±s)
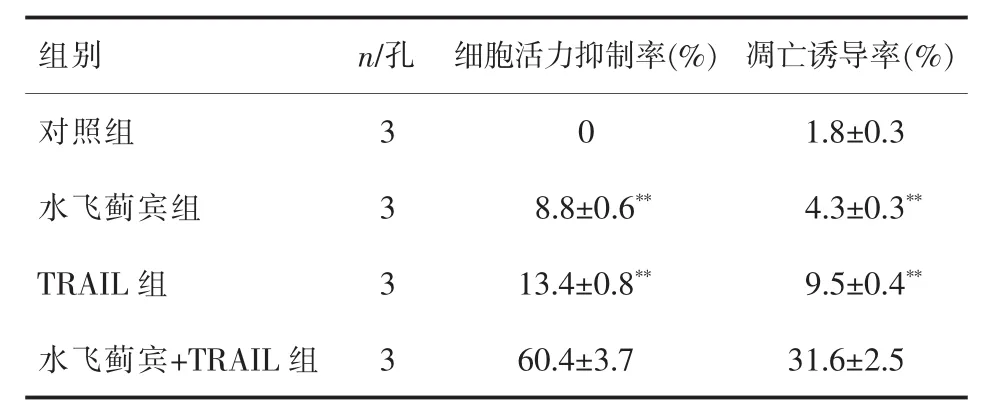
表2 各组对MDA-MB-231的抗肿瘤活性(±s)
与水飞蓟宾+TRAIL组比较**P<0.05
组别 n/孔 细胞活力抑制率(%)凋亡诱导率(%)对照组 3 0 1.8±0.3水飞蓟宾组 3 8.8±0.6** 4.3±0.3**TRAIL组 3 13.4±0.8** 9.5±0.4**水飞蓟宾+TRAIL组 3 60.4±3.7 31.6±2.5
2.2水飞蓟宾促进TRAIL依赖的死亡受体复合物的形成和 caspase-8的活化Western blot实验结果水飞蓟宾能显著上调MDA-MB-231细胞中FADD的表达水平,而TRAIL对FADD的表达无影响(图1)。进一步的免疫共沉淀的实验结果表明水飞蓟宾能显著促进TRAIL依赖的FADD-caspase-8死亡受体复合物的形成(图2),进而诱导MDA-MB-231细胞内的caspase-8的活化(图3)。
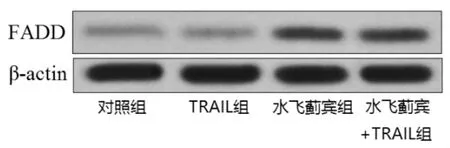
图1 水飞蓟宾上调MDA-MB-231细胞中FADD的表达水平

图2 水飞蓟宾促进TRAIL依赖的FADD-caspase-8死亡受体复合物的形成

图3 水飞蓟宾促进TRAIL依赖的caspase-8的活化
2.3水飞蓟宾通过上调FADD的表达水平增强MDA-MB-231细胞对TRAIL的敏感性为了明确水飞蓟宾显著提高TRAIL对MDA-MB-231细胞的杀伤活性的机制是通过上调FADD的表达,作者先将MDA-MB-231细胞用FADD siRNA进行转染后再用TRAIL联合水飞蓟宾进行治疗,结果发现FADD siRNA能显著抑制水飞蓟宾联合TRAIL对MDA-MB-231细胞caspase-8的活化作用 (图4),同时抑制两者联合对MDA-MB-231的杀伤活性和凋亡诱导效应(表3)。
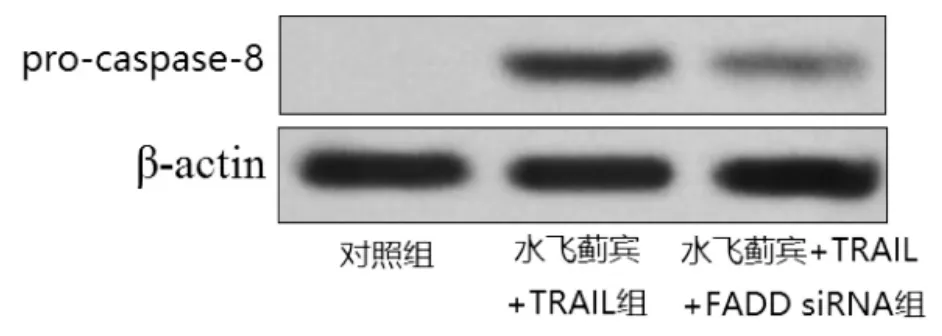
图4 FADD siRNA抑制水飞蓟宾联合TRAIL对MDAMB-231细胞caspase-8的活化
表3 FADD siRNA抑制水飞蓟宾联合TRAIL对MDAMB-231的杀伤活性和凋亡诱导效应(±s)

表3 FADD siRNA抑制水飞蓟宾联合TRAIL对MDAMB-231的杀伤活性和凋亡诱导效应(±s)
与水飞蓟宾+TRAIL+FADD siRNA组比较*P<0.05
组别 细胞活力抑制率(%)凋亡诱导率(%)对照组 0 1.7±0.3水飞蓟宾+TRAIL组 61.5±3.8* 31.9±2.4*水飞蓟宾+TRAIL+FADD siRNA组 20.6±1.2 11.8±1.0
3 讨论
肿瘤坏死因子相关的凋亡诱导配体 (TNF-related apoptosis-inducing ligand,TRAIL)是TNF家族的成员。研究发现,TRAIL能选择性诱导肿瘤细胞发生凋亡,却不影响正常组织细胞的功能,因此TRAIL被认为是一种有很好前景的低毒抗肿瘤药物[3]。尽管如此,研究也发现很多肿瘤细胞对TRAIL的抗肿瘤作用不敏感,并能抵抗TRAIL依赖的凋亡效应[4-5]。因此如何提高肿瘤细胞对TRAIL的敏感性是目前研究工作的重点。在TRAIL诱导肿瘤细胞凋亡的通路中,TRAIL首先与死亡受体4(DR4)或死亡受体5(DR5)结合,结合后的受体复合物能募集细胞中的FADD蛋白,而募集的FADD蛋白则又从细胞质中募集caspase-8前体,形成FADD-caspase-8死亡受体复合物,从而激活caspase-8并诱导肿瘤细胞发生凋亡,因此细胞中FADD蛋白的表达水平决定了肿瘤细胞对TRAIL的敏感性[6-7]。
水飞蓟宾是从水飞蓟属植物奶蓟种子中提取的一种黄酮类化合物,临床上主要用来保护肝细胞,对黄疸,肝炎,胆囊疾病有良好的疗效[8]。近年来,水飞蓟宾还被发现具有一定的抗肿瘤活性,对于多种肿瘤均具有抑制作用[9-10],然而将其作为辅助药物提高肿瘤细胞的治疗敏感性的研究却少见报道。在本研究中,通过体外实验发现水飞蓟宾可以显著提高三阴乳腺癌细胞系MDA-MB-231对TRAIL的敏感性,诱导肿瘤细胞发生显著的凋亡。
为了探究水飞蓟宾发挥对TRAIL协同作用的分子机制,通过Western blot实验证明了水飞蓟宾能显著上调MDA-MB-231细胞中FADD的表达水平,而TRAIL对FADD的表达无影响,提示FADD可能是水飞蓟宾发挥协同作用的靶蛋白。由于TRAIL通过激活caspase-8蛋白诱导肿瘤细胞发生凋亡,因此进一步通过免疫共沉淀方法证明了水飞蓟宾能促进TRAIL依赖的FADD-caspase-8死亡受体复合物的形成和caspase-8的活化。同时,当在MDA-MB-231细胞中转染FADD siRNA抑制FADD的表达后,发现水飞蓟宾对 TRAIL的协同抗肿瘤作用丧失。这些结果证明了水飞蓟宾增强TRAIL对三阴乳腺癌细胞凋亡诱导活性的机制是通过FADD/ caspase-8途径。
综上所述,水飞蓟宾能显著提高三阴乳腺癌细胞对TRAIL的敏感性,并发现水飞蓟宾通过上调FADD的表达水平促进TRAIL依赖的死亡受体复合物的形成进而诱导三阴乳腺癌细胞caspase-8的活化和凋亡的发生,为水飞蓟宾辅助治疗提高TRAIL的抗肿瘤活性提供了理论依据。
[1]Weichhaus M,Segaran P,Re naud A,et al.Osteoprotegerin expression in triple-negative breast cancer cells promotes metastasis.Cancer Med,2014,3(5):1112
[2]Mathe A,Scott RJ,Avery-Kiejda KA.miRNAs and Other Epigenetic Changes as Biomarkers in Triple Negative Breast Cancer.Int J Mol Sci,2015,16(12):28347
[3]Ma JC,Zhang QC.Role of TRAIL in the treatment of prostate cancer:An update.Zhonghua Nan Ke Xue,2015,21(10):941
[4]De Miguel D,Gallego-Lleyda A,Ayuso J,et al.TRAIL-coated lipid-nanoparticles overcome resistance to soluble recombinant TRAIL in non-small cell lung cancer cells.Nanotechnology,2016,27(18):185101
[5]Finlay D,Vamos M,Vuori K,et al.Small-molecule IAP antagonists sensitize cancer cells to TRAIL-induced apoptosis: roles of XIAP and cIAPs.Mol Cancer Ther,2014,13(1):5
[6]LaussmannMA,PassanteE,RehmM,etal.Proteasome inhibition can impair caspase-8 activation upon submaximal stimulation of apoptotic tumor necrosis factor-related apoptosis inducing ligand(TRAIL)signaling.J Biol Chem,2012,287(18):14402
[7] Hari Y,Harashima N,Harada M,et al.Bcl-xL inhibition by molecular-targeting drugs sensitizes human pancreatic cancer cells to TRAIL.Oncotarget,2015,6(39):41902
[9] Akhtar R,Ali M,Mahmood S,et al.Anti-proliferative action of silibinin on human colon adenomatous.cancer HT-29 cells. Nutr Hosp,2014,29(2):388
[10]Oh SJ,Jung SP,Kim JH,et al.Silibinin inhibits TPA-induced cell migration and MMP-9 expression in thyroid and breast cancer cells.Oncol Rep,2013,29(4):1343

