微囊藻毒素在大白菜、菜薹、茼蒿中的累积
李 倩,袁倩倩,陈 琛,罗雪婷
(湖北第二师范学院 化学与生命科学学院, 武汉 430205)
微囊藻毒素在大白菜、菜薹、茼蒿中的累积
李 倩,袁倩倩,陈 琛,罗雪婷
(湖北第二师范学院 化学与生命科学学院, 武汉 430205)
本文主要介绍水中微囊藻毒素(MC)在含量相同且处于促进植物生长的浓度时,在大白菜、菜薹及茼蒿的根、茎、叶中的累积含量的实验。实验中选用的微囊藻毒素为MC-RR型,浓度为0.001mg·L-1,由此实验初步可知,在同种浓度的MC-RR作用下,植物的叶片相对于根和茎更容易表现出中毒现象,而在大白菜,菜薹及茼蒿这3种植物中,菜薹的中毒现象表现得最为明显,而茼蒿受到MC的影响较小,从生长状况来看,并没有明显的中毒迹象。
微囊藻毒素;茼蒿;菜薹;大白菜;累积规律
1 引言
水体富营养化的加剧从而引发有害的藻类水华(HAB,harmful algal bloom)的频繁发生已经成为国内外引起广泛关注的环境问题[1]。微囊藻毒素化学性质稳定,它耐酸耐热,易溶于水(甲醇或丙酮),不挥发不易分解抗pH,化学性质稳定使得它在自然条件下难以降解,因此在高温强酸条件下得以保存,而正常的自来水处理工序不能完全将其去除[2]。世界卫生组织推荐水中微囊藻毒素含量为1μg/L[3],我国饮用水标准中将微囊藻毒素作为非常规检查指标[4],含量要求与世界卫生组织相同。
坐落于武汉的东湖在中国是水域面积最广的城中湖之一,每年夏季东湖都会发生一定程度的水华,而菜薹、茼蒿、大白菜等农作物是武汉的几种种植作物,根据已有的文献可知,水华所产生的微囊藻毒素会在部分植物体内的积累,经黄艺等人的研究得到每人日允许的MC摄入量为2.5μg/L,体内累积毒素的量在达到25μg/L以上会使身体发生病变[5],因此在武汉用东湖水灌溉植物会在哪些植物体内累积,以及在这些植物的哪些部位累积,这些毒素通过在食物链中的转移进而对人体产生危害成为人们关注的焦点。
大白菜、菜薹、茼蒿都是是武汉主要种植并经常食用的几种农作物,微囊藻毒素浇灌这三种植物后,种子的发芽状况,成熟后的该三种植物哪一部分积累的MC最多,且是否适于食用都是本实验研究的指标及目的。
MC-RR对蔬菜种子发芽率的影响较小,但在浓度低于0.01 mg·L-1时仍然可以表现出轻微的促进作用,且蔬菜种子发芽率一般可以稳定在为90%以上,当MC-RR的浓度为0.01 mg·L-1时对芽伸长有刺激作用,当其浓度大于0.05 mg·L-1时则表现为抑制作用[6]。MC在浓度为10~50μg/L时对青菜的根茎的影响没明显现象,在500~5000μg/L之间对根的生长都出现不同程度的抑制,抑制作用随着浓度的增加而递增,并且都出现了植株矮化,叶片发黄的中毒症状,叶绿素的含量先上升后下降;微囊藻毒素在油菜体内的积累随着浓度的增加而增加[7],但这些含量的毒素浇灌的蔬菜已经会在生长过程中表现出明显的中毒迹象,因此中毒的蔬菜会被筛选淘汰,最终无法进入市场销售。虽然MC-RR浓度越大,对植物的制毒性越强,最终的实验数据会更加明显,但据资料显示,东湖的水体一般在7月到10月是水华发生的高峰期,且其藻毒素毒的浓度却并不算特别高,本实验旨在探究藻毒素在植物体内的累积规律。
选用高效液相色谱法作为测定方法[8,9]。
2 实验部分
2.1 实验原料、药品、设备与仪器
2.1.1 实验原料
大白菜种子(优选晋菜三号F1,出自聚丰种业),菜薹种子(银田红60,出自长沙市银田蔬菜种子实业有限公司),大叶茼蒿种子(油青大叶茼蒿608,出自丰农种业),土壤(取自武汉东湖花木城农林植林土),微囊藻毒素(0.001mg·L-1MC-RR溶液)。
2.1.2 实验药品
实验药品见表1

表1 实验药品
2.1.3 实验设备与仪器
实验设备与仪器见表2

表2 实验设备与仪器
2.2 分析方法
2.2.1 测定条件
高效液相色谱分析条件[10]:
流动相:V(乙腈)∶V(含0.1%甲酸的纯水)=35 ∶65
流速:1.0ml/min
紫外检测波长238nm
2.2.2 计算方法
用微囊藻的储备溶液配置不同浓度梯度的微囊藻毒素溶液,绘制标准曲线,得到标准曲线法方程。实验过程中用高效液相色谱法测量得到的峰面积带入方程中计算:
w=100%·y/z
c=x·v/m
a=lx-l0/l0
其中w表示种子的发芽率;y表示发芽的种子数目;z表示每个培养皿中参与实验的种子数目;c表示植株体内毒素含量(μg/kg),x表示处理植物后的溶液中微囊藻毒素的含量(mg/L),v表示处理植物后得到的溶液的体积(ml),m表示参与测量植株的质量(g)。a为促进率或抑制率(lx-l0为正则为促进,lx-l0为负则为抑制率),lx为测量植株株高,l0为空白植株株高。
2.3 实验内容
2.3.1 试剂配置
营养液的配置[11]如表3
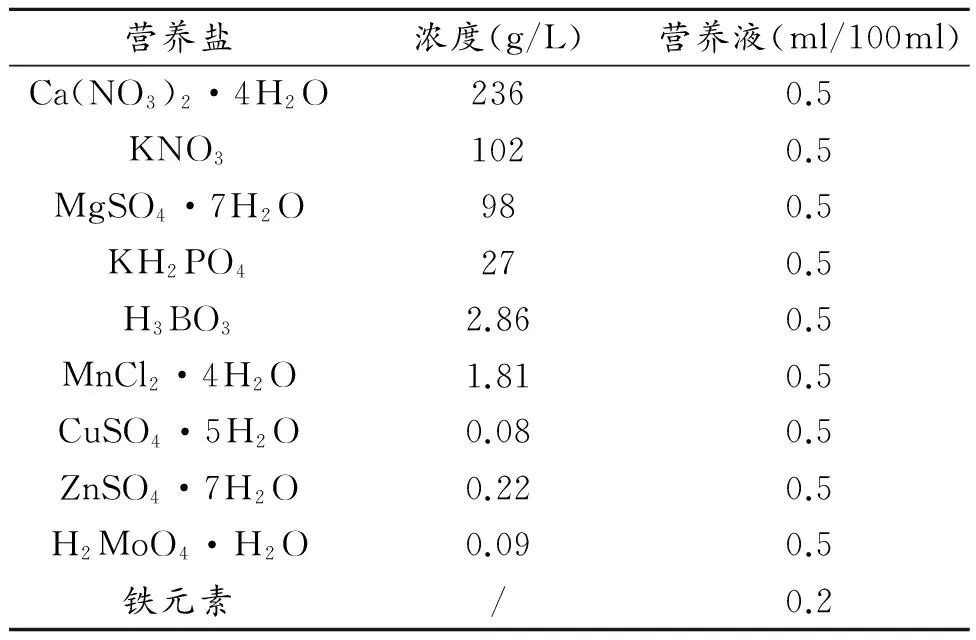
表3 营养液的配置
铁溶液的配置:
称取EDTA·Na23.77g加热新煮沸并冷却的温热的蒸馏水中,搅拌溶解,定容至100ml容量瓶密闭避光保存。
称取FeSO4·7H2O 2.78g 用新煮沸冷却的蒸馏水溶解,定容至100ml;将上述配置的EDTA·Na2溶液和FeSO4·7H2O溶液等量混合,密闭避光保存。
微囊藻毒素储备液配置:
用取液枪取50μL甲醇溶解50μg的标准样品中,再加入4950μL的超纯水,混匀,得到10μg/ml的储备液,放在-20℃存储备用。
取0.2ml储备液稀释至2000ml,配成浓度为0.001mg/L微囊藻毒液用于浇灌。
2.3.2 种子的发芽实验
将大白菜、菜薹、茼蒿种子用10%的H2O2消毒30min,后将种子用蒸馏水清洗干净,取直径为9cm玻璃培养皿3个,每个铺上3层滤纸,取三种圆润饱满的种子,每种50颗分别放入3个培养皿中,让每颗种子保持一定的距离,再向培养皿中加入含有微囊藻毒素为0.001mg/L的毒液2ml,以及配置好的营养液3ml。将种子至于室温(约20℃)和自然光照条件下发芽生长,保持培养皿的滤纸湿润(不能使其干涸),每日更换滤纸并加入同等量的溶液,以保持溶液的浓度不变[12]。
2.3.3 土培实验
将三种蔬菜在培养皿上培养7天,三种蔬菜的根长基本已经超过2cm,再将蔬菜移植至装有土壤的塑料碗中(直径是12cm使每个塑料碗中的土壤质量和土质相同),每个碗中的植株数目为5株,保持植株间间距为2cm,移植后每天向塑料碗中加入10ml毒液以及50ml营养液浇灌[6],培养至第21天,三种植物基本进入成熟期。
待用微囊藻毒素土培植物21天后,取大白菜、菜薹、茼蒿植株各5株,将其分为叶部、茎部以及根部,将其至于灭菌锅中杀菌,在65℃的烘箱中烘干至恒重,再将烘干的植株碾碎,加入2ml的甲醇后,在超声波破碎仪里破碎细胞1小时,在4℃的冰箱沉淀24h,沉淀完毕再在离心机中以4000r/min的转速离心半个小时,吸取上清液过滤存储于样品瓶中,保存以检测,同样保存于4℃的条件下[7]。
3 实验结果与讨论
3.1 标准曲线的测定
将配置好的微囊藻毒素标准储备液稀释成浓度为0.5μg/L、1.0μg/L、1.5μg/L、2.0μg/L、2.5μg/L、3μg/L的MC-RR标准溶液,经0.22μm的微孔滤膜过滤以后进样于高效液相色谱仪,得到毒素含量与峰面积的关系,所得数据用orgin6.0处理后其线性曲线关系如图1,由图可知标准曲线方程为y=812.29143x+757.84,R=0.9947,拟合程度较好,具有可信度。

图1 标准曲线
3.2 毒素对种子发芽率的影响
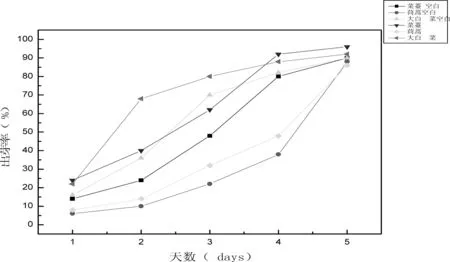
图2 发芽率与发芽天数的关系
如图2所示,种子发芽率是随着发芽天数的增加而增大,第5天时种子发芽率趋于平稳,我们可以观察到,大白菜、菜薹、茼蒿这三种植物在同种浓度的藻毒素作用下,MC-RR对大白菜和菜薹的出芽有明显的促进作用,而茼蒿受藻毒素影响不大甚至基本没有什么影响。
3.3 微囊藻毒素对大白菜、菜薹、茼蒿生长的影响
根据培养皿中植株总的生长趋势可知:在0.001mg/L微囊藻毒素的培养下,初始三种植物的长势迅猛,且基本毫无中毒迹象,而三种植物中,起初大白菜长势最为迅猛,从第3天开始菜薹长势超过大白菜,一直到第7天,菜薹的叶片出现了明显发黄的迹象,且菜薹和大白菜基本已经长到3cm的长度,而茼蒿一直生长缓慢,到第7天准备移土栽培时,最高的长度也只有2.1cm。因此从培养皿中的长势来看,在植物幼苗期,微囊藻毒素在菜薹上作用最为明显,才仅仅7天叶片的边缘位置已经出现明显的变黄的迹象(如图3),而在大白菜和茼蒿上没有明显的变化。

图3 培养皿中第七天菜薹幼苗情况
3.4 微囊藻毒素在大白菜、菜薹、茼蒿中的积累规律

图4 同种浓度下三种植物的根的累积情况
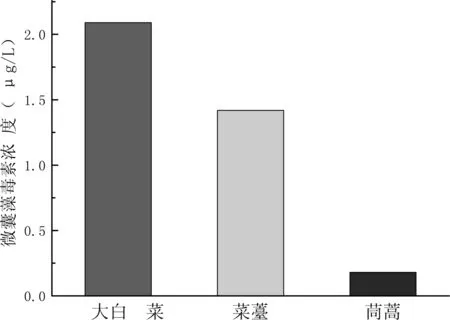
图5 同种浓度下三种植物的茎的累积情况
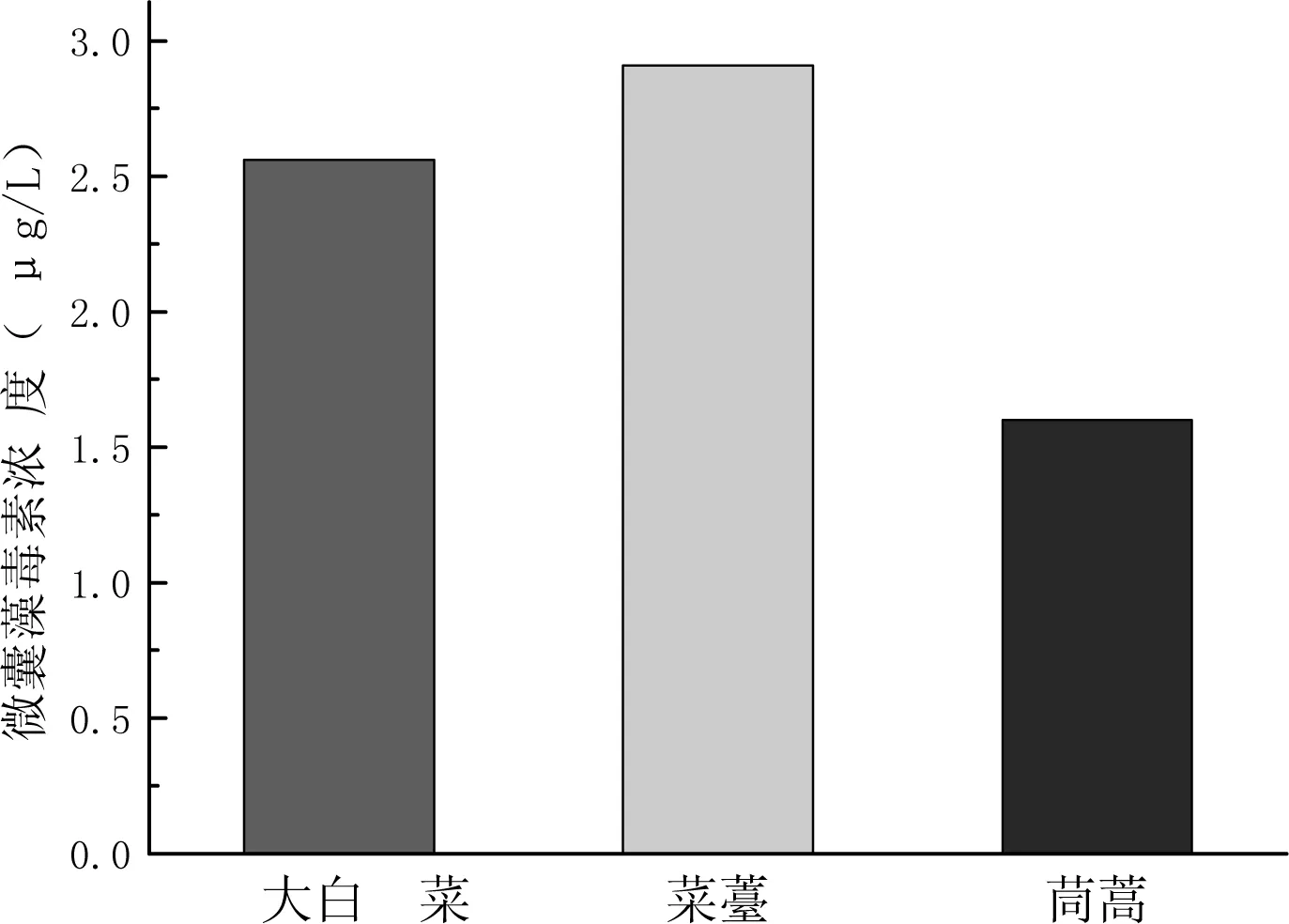
图6 同种浓度下三种植物的叶的累积情况
大白菜、菜薹、茼蒿生长至第21天,分别测量三种植物的根部、茎部、叶部的MC积累量;由数据可知对MC的积累量最大是菜薹的叶部,由图三可知在用0.001mg/L藻毒素处理下菜薹的叶部累积的毒素已经达到了2.91μg/L是三种植物地上部分中含量最多的,而人体每日允许的MC摄入量为2.5μg/L[5],菜薹叶片已经不适宜食用,同时在三种植物中高于该指标的植物部位还有大白菜的叶片。同时综合三种植物的分析来看,毒素一般在植物的根与叶中累积的最多,茎中累积的量明显少于根和叶。
4 结论
根据本实验研究可知微囊藻毒素对大白菜、菜薹种子的发芽有明显的影响,水中MC-RR含量在0.1mg/L以下,种子的发芽率均在85%以上,毒素对发芽的有促进作用。但这种促进作用在茼蒿种子上并没有明显表现。

表4 大白菜、菜薹、茼蒿各部位的毒素浓度
同种浓度下,叶部的根、茎部位更易累积毒素。菜苔中毒现象最为明显,茼蒿受影响较小。
[1]Hallegreff G M.A review of harmful algal bloom and their apparent global increase. Phycologia,1993,32(2):79.
[2]许敏,赵以军,程凯.水华和赤潮的毒素及其检测与分析[J].湖泊科学,2001,13(4):377-384.
[3]Chorus I,BartramJ.Toxic Cyanobacteria in Water[M].Geneva:WorId Health Organization(WHO),1999.
[4]黄艺,张郅灏. 微囊藻毒素的致毒机理和人体健康风险评价研究进展[J]. 生态环境学报, 2013, 22(2): 357-364.
[5]刘碧波,肖邦定,刘剑彤,等.天然水体中痕量微囊藻毒素的高效液相色谱测定方法优化[J].分析化学,2005,33(11):1577-1579.
[6]李彦文,黄献培,向垒,等. 典型微囊藻毒素对白菜种子发芽的生态毒性[J].农业环境科学报,2012,31(10):1879-1883.
[7]易能,薛延丰,李慧明,等. 微囊藻毒素对油菜幼苗生长及抗氧化酶活性的影响[J].西北植物学报,2009,29(6):1207-1213.
[8]夏商周,杨朝晖. 微囊藻毒素的检测及危害研究进展[J].四川环境,2012,31(3):90-93.
[9]聂晶晶,李元,李琴,等. 微囊藻毒素检测方法的研究进展[J].中国环境监测,2007,23(2):331-334.
[10]张杭君,张建英,焦荔,等.微囊藻毒素的快速提取方法研究[J].浙江大学学报,2005,31(6):736~740.
[11]张志良. 植物生理学实验指导(第三版)[M]. 北京:高等教育出版社,2003:121-124, 274-277.
[12]龚一富.植物组织培养实验指导[M].武汉:科学出版社,2011.
The Accumulation of Microcystin in Chinese Cabbage, Purple Flowering Stalks and Garden Chrysanthemum
LI Qian, YUAN Qian-qian, CHEN Chen, LUO Xue-ting
(School of Chemistry and Life Science, Hubei University of Education, Wuhan 430205, China)
The frequent occurrence of harmful algal blooms (HAB, algal bloom harmful) induced by eutrophication has become an environmental problem which has aroused widespread concern across the world.[1]This paper mainly introduces the experiment of microcystins’ (MCs) accumulation content in roots, stems and leaves of Chinese cabbage, purple flowering stalks and garden chrysanthemum when microcystin contents in the water are at the same level and promoting plant growth. The MC in the experiment is MC-RR with the concentration of 0.001mg/L. The experiment shows that by the action of same concentration of MC-RR, leaves are more likely to be poisoned than roots and stems. Furthermore, signs of poisoning are most distinct on purple flowering stalks among those three vegetables, while garden chrysanthemum is less affected by MC-RR without any obvious signs of poisoning.
microcystin; garden chrysanthemum; purple flowering stalks; accumulation
2016-07-10
2015年湖北省教育厅指导项目(B2015023);2015年湖北省大学生创新创业计划项目
李 倩(1984-),女,湖北武汉人,博士,研究方向为资源与环境综合利用。
X592
A
1674-344X(2016)08-0032-05

