两株不同地区干巴菌菌丝体培养基的优化*
王康康,沙涛,杨智,普春龙,孙赵龙
(云南大学省生物资源保护与利用重点实验室,云南昆明650091)
两株不同地区干巴菌菌丝体培养基的优化*
王康康,沙涛**,杨智,普春龙,孙赵龙
(云南大学省生物资源保护与利用重点实验室,云南昆明650091)
对分离自云南省玉溪市大营街镇平坝村及昆明市小哨乡的干巴菌菌丝体的最适营养条件及最适pH条件进行探究。通过单因子试验和正交试验优化培养基。结果表明,小哨菌种最适培养基为葡萄糖20 g、蛋白胨2 g、酵母粉2 g,磷酸二氢钾0.5 g、硫酸镁0.5 g,初始pH5.5,H2O 1 L。玉溪菌种最适培养基为葡萄糖20 g、硫酸铵4 g、酵母粉2 g,磷酸二氢钾0.5 g、硫酸镁0.5 g,初始pH5.5,H2O 1 L。
干巴菌;菌丝;培养基;优化
干巴菌(Thelephora ganbajun)又名干巴革菌,为革菌属(Thelephora)的可食用真菌,同时也是一种外生菌根真菌,尚不能进行人工栽培[1]。外生菌根是菌根真菌菌丝体侵染宿主植物尚未木栓化的营养根形成的,其主要特征是菌丝在植物营养幼根表面形成菌套,同时侵入到根的皮层组织细胞间隙中形成哈蒂氏网,但不侵入细胞内部,是自然界中普遍存在的一种共生现象[2]。干巴菌主要产于云南省,生长于亚热带云南松林或针阔混交林下,营养丰富且具有浓郁的牛肉干香味,具有很高的营养保健和经济价值[3]。由于干巴菌是云南特有的食用菌,与其它外生菌根真菌相比,目前国内对干巴菌的研究还比较少,仅有一些关于干巴菌生长的营养条件及成分分析的研究,也还不够系统、完善[4-10]。此外,沙涛等(2008)研究了云南省9个地区23个采样地156个样本的ITS序列差异,分析确定了34个ITS单倍型,具有较高的多样性。本文通过对2个不同地区的干巴菌菌丝体纯培养条件的探究,拟为下一步人工菌根合成及干巴菌资源开发提供理论基础。
1 材料与方法
1.1材料
干巴菌的2个菌种46号菌种和P2菌种分别从采自云南省昆明市小哨乡和云南省玉溪市平坝村的野生干巴菌中分离获得。菌种经过ITS序列测序鉴定为干巴菌(Thelephora ganbajun)[11-12]。
1.2方法
1.2.1不同pH对干巴菌菌丝生长的影响
干巴菌发生的土壤在整体上为山原红壤,少量为黄沙壤;母岩常为紫色沙岩或玄武岩。土壤中性偏酸[13],故以pH6为中心设置梯度:pH值为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5,分别用1 mol·L-1NaOH及HCl调节pH,每个梯度设3个重复。在无菌操作台上取5个摇瓶中、生长2个月的菌种过滤,并转移到灭过菌的三角瓶中,加入200 mL无菌水后打碎,每次取4 mL接种于150 mL PDA培养基中,置于28℃恒温暗培养。2个月后过滤,并用无菌水冲洗至洗出液无色,然后抽干菌丝体,在60℃烘箱烘干2 h,称重并记录数据。
1.2.2单因子试验筛选出2个菌种适合的氮源、碳源
碳源试验的2种基本培养基。合成培养基1:硝酸钙2 g、磷酸二氢钾0.5 g、硫酸镁0.5 g、琼脂15 g、水1 000 mL;PDA培养基。选取的碳源为葡萄糖、蔗糖和麦芽粉。分别在2种基础培养基上按15 g·L-1的浓度加入不同碳源。
每个处理设置3个重复,用塑料平板培养,在生长2个月的2种干巴菌菌落边缘取长5 mm的正方形菌块分别接入培养皿中央,置于28℃恒温暗培养。接种2个月后,用十字交叉法测量菌落半径,同时观察菌丝长势。
氮源实验2种基本培养基。合成培养基2:葡萄糖20 g、磷酸二氢钾0.5 g、硫酸镁0.5 g、琼脂15 g、水1 000 mL;PDA培养基。
选取的氮源为硝酸钠、蛋白胨、酵母粉、硫酸铵。分别在2种基础培养基上按2 g·L-1的浓度加入不同氮源。
其它测定方法、内容同上。
1.2.3马铃薯汁对干巴菌菌丝生长的影响
分别对2个菌种在不同基础培养基上生长的试验数据作独立样本t检验。利用t检验判断两总体均值是否存在显著差异。
1.2.4正交试验
选用L25(53)正交表,以最佳碳源A、最佳氮源B、C为直接因素进行正交试验,以便筛选各因素之间的最佳组合。培养基pH调节为5.5,无机盐磷酸二氢钾0.5 g·L-1,硫酸镁0.5 g·L-1。用SPSS软件对数据作方差分析,其他测定方法同单因子试验[14](表1、表2)。
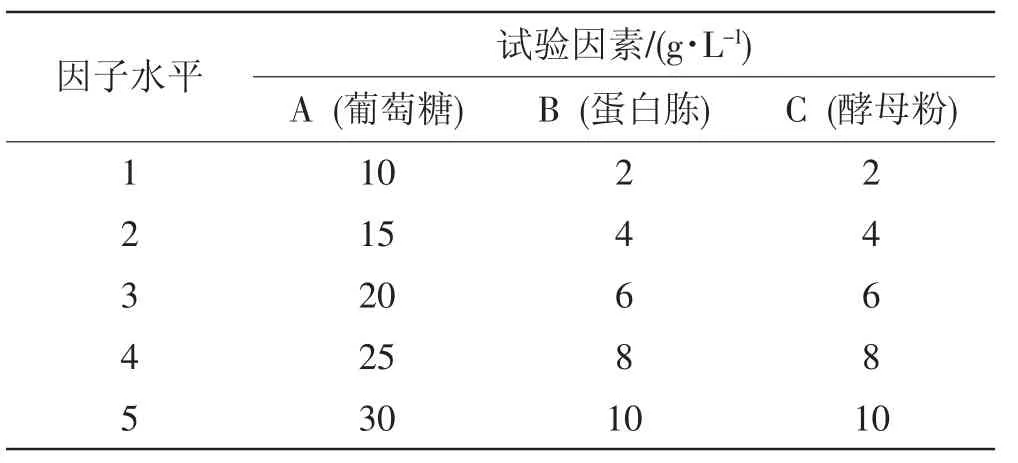
表1 干巴菌46号菌种L25(53)正交试验因素与水平Tab.1Orthogonal test factors and levels of Thelephora ganbajun 46 strain
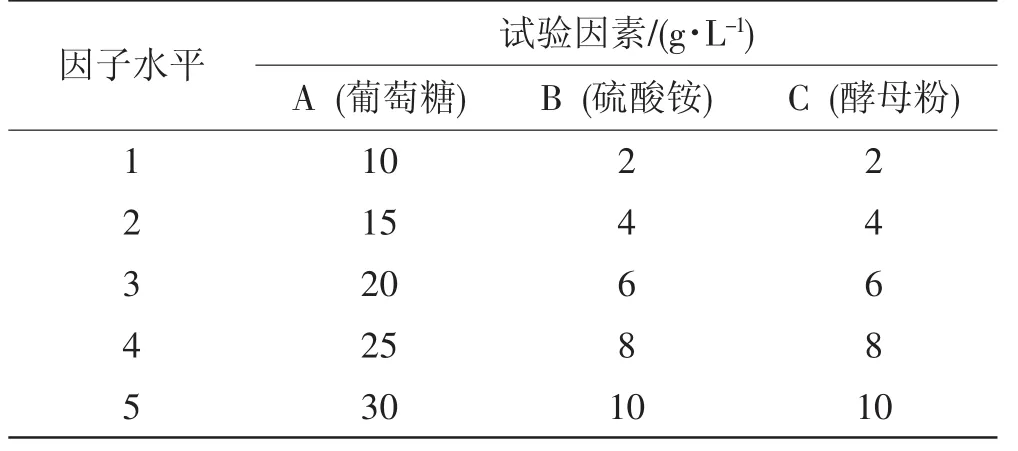
表2 干巴菌P2菌种L25(53)正交试验因素与水平Tab.2Orthogonal test factors and levels of Thelephora ganbajun P2 strain
2 结果与分析
2.1不同pH对干巴菌菌丝生长的影响
不同pH对干巴菌菌丝生长的影响见图1。由图1可知,46号菌种和P2菌种的最适pH均为5.5。
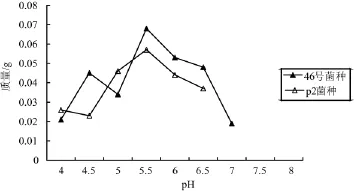
图1 不同pH值对干巴菌46号、P2菌种菌丝生长的影响Fig.1Effect of different pH on mycelia growth of Thelephora ganbajun 46 strain and P2 strain
2.2不同碳氮源对干巴菌菌丝生长的影响
不同碳氮源对干巴菌菌丝生长的影响,见图2、图3。

图2 不同碳源和氮源对干巴菌46号菌种菌丝生长的影响Fig.2Effect of different carbon and nitrogen sources on mycelia growth of Thelephora ganbajun 46 strain

图3 不同碳源和氮源对干巴菌P2号菌种菌丝生长的影响Fig.3Effect of different carbon and nitrogen sources on mycelia growth of Thelephora ganbajun P2 strain
由图2、图3可知,46号菌种和P2菌种的最适碳源都为葡萄糖;46号菌种最适氮源为蛋白胨,P2菌种最适氮源为硫酸铵。
2.3马铃薯汁对干巴菌菌丝生长的影响
对46号菌种在2种不同基础培养基上生长的试验数据作独立样本t检验,方差齐性检验认为方差齐性,故取方差齐次结果P=0.775>0.05,所以2组数据无明显差异,即对46号菌种而言,培养基成分中有无马铃薯汁均可。
对P2号菌种在2种不同基础培养基上生长的试验数据作独立样本t检验,方差齐性检验认为方差齐性,故取方差齐次结果P=0.795>0.05,所以两组数据无明显差异,即对P2号菌种而言培养基成分中有无马铃薯汁均可。
2.4正交试验结果
正交试验结果见表3和表4。
由表3可知,46号菌种最适碳、氮源配比为A3B1C1,即葡萄糖20 g、蛋白胨2 g、酵母粉2 g。极差分析表明3种营养物质中蛋白胨对46号菌种生长影响最大。由表4可知P2菌种最适碳氮源配比为A3B2C1,即葡萄糖20 g、硫酸铵4 g、酵母粉2 g。但B1B2值差距不大,从开发应用的角度考虑也可以取A3B1C1,即葡萄糖20 g、硫酸铵2 g、酵母粉2 g。极差分析表明3种营养物质中硫酸铵对P2菌种生长影响最大。

表3 干巴菌46号菌种正交试验结果Tab.3Orthogonal test results for Thelephora ganbajun 46 strain
3 讨论
本研究初步完成了2个干巴菌菌种的培养基筛选,研究结果显示2个菌种的适宜pH都是5.5,这也与干巴菌的生长土壤pH相吻合。最适碳源都为葡萄糖20 g,但最适氮源有所不同,46号为蛋白胨2 g和酵母粉2 g;P2为硫酸铵4 g和酵母粉2 g。2个菌种在葡萄糖浓度高于20 g·L-1且后气生菌丝明显较低浓度时发达,菌落越厚,但菌落面积也明显缩小。P2菌种对无机氮源硫酸铵的吸收利用能力明显优于46号菌种,另外P2菌种的生长速度明显较46号菌种缓慢。但P2与46号菌种在ITS序列上一致,还需进一步分析其遗传分化程度。2个菌种在营养吸收上的差异,可能是由于环境差异导致的适应性进化,2个菌种自然生长环境及其子实体在其它有效成分含量上是否也存在差异,有待作进一步理化分析。
由于外生菌根真菌需要与其宿主植物共生才能完成其生长发育,如果要得到干巴菌子实体,必然要先合成菌根或进行人工促繁,而筛选优良外生菌根真菌菌种,研究不同基因型菌种之间,以及菌种与宿主植物之间的关系是建立菌根化技术的重要前提,目前已得到大量的2种不同基因型菌丝体,使半人工栽培干巴菌成为可能。
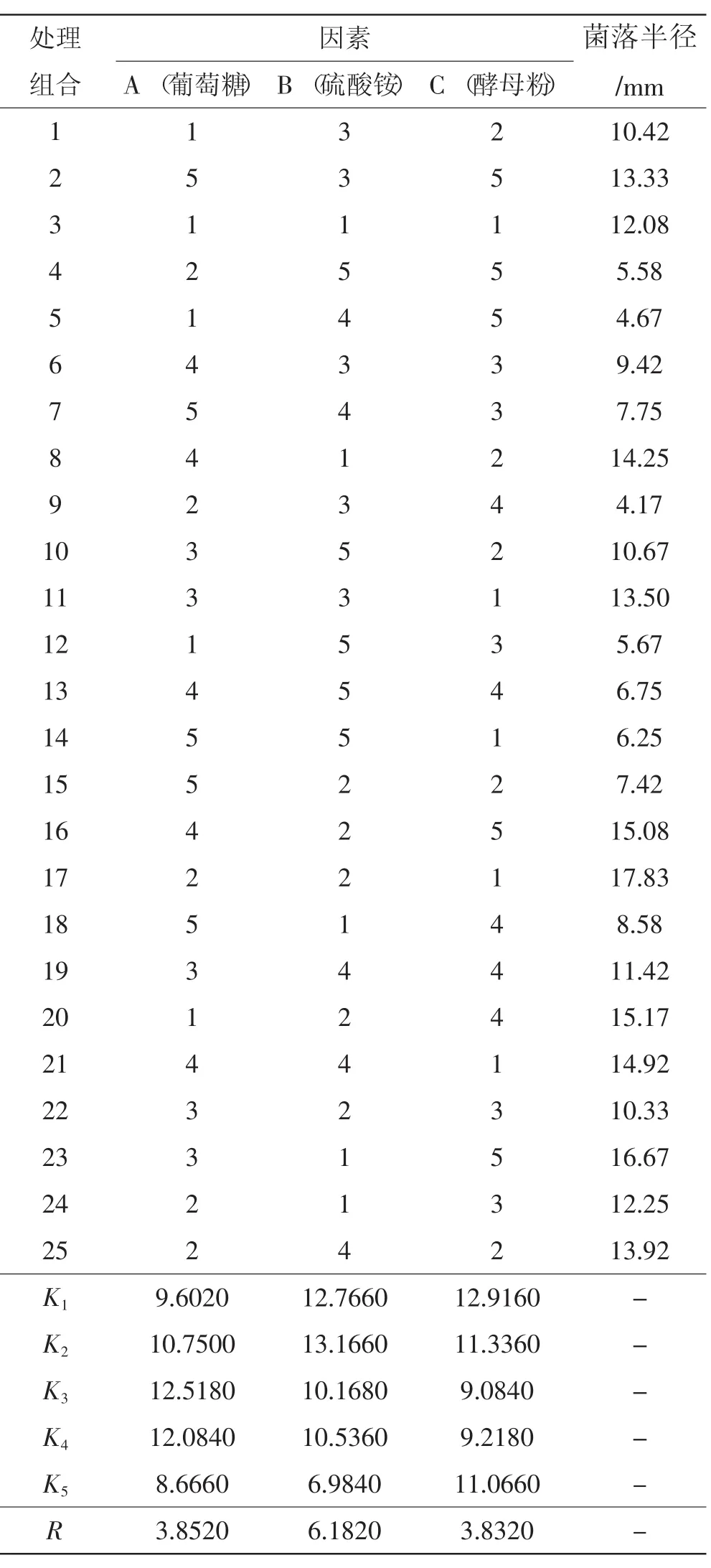
表4 干巴菌P2菌种正交试验结果Tab.4Orthogonal test results for Thelephora ganbajun P2 strain
[1]臧穆.“干巴菌”考[J].食用菌,1986(4):1-2.
[2]于富强,刘培贵.外生菌根研究及应用的回顾与展望[J].生态学报,2002,22(12):2217-2226.
[3]黄年来,林志彬,陈国良.中国食药用菌学[M].上海:上海科学技术文献出版社,2010:665-672.
[4]傅四清,杨丽源,张玲琪,等.干巴菌菌丝生长条件的研究[J].食用菌,1997,19(6):5.
[5]傅四清,张玲琪.干巴菌菌丝营养生理特性的初步研究[J].中国食用菌,1998,17(6):28-29.
[6]王茜茜,李军明,王亚琴,等.静态顶空与顶空固相微萃取法测定云南野生干巴菌香气成分比较[J].食品工业科技,2011(11):174-176.
[7]陈亚萍,邱开雄,陈亚娟,等.干巴菌抗氧化活性研究[J].昆明医学院学报,2012,33(1):40-42.
[8]李丽娟,王涛,申元英,等.干巴菌对小鼠免疫功能影响的实验研究[J].食品研究与开发,2012,33(6):40-43.
[9]Hu L,Liu JK.Two novel phenylacetoxylated p-terphenyls from Thelephora ganbajun Zang[J].Zeitschrift für Naturforschung C,2011 56(11-12):983-987.
[10]Zhang P,Luo XY,Wu Y et al.Optimization of submerged fermentation of Thelephora ganbajun Zang[J].Journal of Basic Microbiology,2014 54(8):866-872.
[11]沙涛,李文鹏,张亚平.干巴菌(Thelephora ganbajun Zang)鉴定的PCR方法及其特异引物:中国,CN102041311A[P].2011.
[12]Sha T,Xu J,Palanichamy MG,et al.Genetic diversity of the endemic gourmet mushroom Thelephora ganbajun from south-western China[J].Microbiology,2008 154(11):3460-3468.
[13]桂明英,刘蓓,朱萍,等.干巴菌生态学初步研究[J].西南农业学报,2005,18(3):325-327.
[14]徐向宏,何明珠.试验设计与Design-Expert、SPSS应用[M].北京:科学出版社,2010(7):109-133.
Optimized Mycelium Culture Medium of Two Strains Thelephora ganbajun from Different Regions in Yunnan
WANG Kang-kang,SHA Tao,YANG Zhi,PU Chun-long,SUN Zhao-long
(Laboratory for Conservation and Utilization of Bio-resources Yunnan University,Kunming 650091,China)
The optimal culture medium and pH of two strains Thelephora ganbajun Zang from town Xiaoshao and Daying in Yunnan province were studied.The single factor and the orthogonal array method used for optimal culture medium.The results of these experiments showed that the components of the medium for Xiaoshao strains comprised with glucose at 20 g·L-1,peptone 2 g·L-1,yeast extract 2 g·L-1,KH2PO40.5 g·L-1,MgSO40.5 g·L-1and initial pH 5.5,for Yuxi strains the medium comprised with glucose at 20 g·L-1,yeast extract 2 g·L-1,(NH4)2SO42 g·L-1,KH2PO40.5 g·L-1,MgSO40.5 g·L-1and initial pH 5.5.
Thelephora ganbajun;strain;culture medium;optimal
S646.9
A
1003-8310(2016)03-0033-04
10.13629/j.cnki.53-1054.2016.03.007
国家自然科学基金项目(No.31260006);云南省高校科技创新团队。
王康康(1990-),女,在读硕士研究生,研究方向为食用菌的栽培。E-mail:wkkwyf1990@foxmail.com
**通信作者:沙涛(1965-),男,本科,主要从事大型真菌的生理、遗传方面的研究。E-mail:shatao@ynu.edu.cn
2016-03-06

