干扰素治疗获得HBsAg消失的慢性乙型肝炎患者临床基线特征研究
谢尧 李明慧 张璐 靳丽 张丹 路遥 吴淑玲 申戈 刘如玉 胡蕾苹 常敏 宋淑静 张书凤 华文浩 成军 徐道振
100015 北京,首都医科大学附属北京地坛医院肝病中心肝病二科
·病毒病诊断与治疗·
干扰素治疗获得HBsAg消失的慢性乙型肝炎患者临床基线特征研究
谢尧 李明慧 张璐 靳丽 张丹 路遥 吴淑玲 申戈 刘如玉 胡蕾苹 常敏 宋淑静 张书凤 华文浩 成军 徐道振
100015 北京,首都医科大学附属北京地坛医院肝病中心肝病二科
谢尧、李明慧为并列第一作者
目的 探讨通过干扰素治疗获得HBsAg消失的慢性乙型肝炎患者临床基线因素特征。方法 从干扰素治疗的慢性乙型肝炎前瞻性临床观察队列中收集治疗期间发生HBsAg消失患者的人口学、病毒学和血清学基线因素,包括年龄、性别、HBV DNA含量、HBsAg/抗HBs水平、HBeAg/抗HBe含量和HBsAg消失发生的治疗时间,计量资料用独立样本t检验和方差分析进行组间比较,定性资料采用频数和频率进行统计描述。结果 2018干扰素治疗的慢性乙型肝炎患者中,329例患者发生HBsAg消失,201例初治患者,128例核苷类似物在治疗患者,年龄31(25,37)岁,ALT水平261.28±435.20U/L;HBV DNA阳性患者的HBV DNA水平5.16±1.83 log10IU/ml,高病毒含量(HBV DNA>106IU/ml)患者的ALT水平为337.00±414.87 U/l,52例HBV DNA>107IU/ml患者中的25例(48.08%)联合NA治疗。HBsAg基线水平2.92±1.15log10IU/ml,50.8%的患者HBsAg<1500 IU/ml,HBsAg消失的治疗时间90.2±63.0周,69.9%的HBsAg消失发生于48周疗程以上。HBsAg消失发生时间与基线HBsAg水平、HBeAg含量和ALT水平有独立相关性(P=0.000,P=0.035和P=0.014)。结论 经干扰素治疗获得HBsAg消失的慢性乙型肝炎患者具年轻、高ALT水平和低HBsAg水平特点,高HBV DNA含量伴高ALT水平者需加用NA联合治疗,多数患者需要治疗48周以上疗程。
抗病毒治疗是阻断和延缓慢性乙型肝炎肝脏疾病进展最重要的手段,无论HBeAg阳性抑或HBeAg阴性患者,理想的治疗终点是通过治疗达到HBsAg消失[1-3],HBsAg消失是预示慢性HBV感染具有长期良好结局唯一的指标[4],也被认为是从感染中恢复和临床治愈指标[1-3],是慢性乙型肝炎抗病毒治疗所最求的治疗目标[4]。干扰素抗乙肝病毒治疗受多因素的影响,高ALT水平、低HBV DNA含量、低血清HBsAg水平或肝脏组织病理学检查为中度以上的炎症,可以预测抗病毒疗效[5-9],而不加选择的对慢性乙型肝炎患者进行聚乙二醇干扰素α治疗48周HBsAg消失发生率仅有2.0%-7.0%[5, 10, 11],因此如何选择优势患者和给予个性化治疗是提高HBsAg消失的重要策略。本研究对通过干扰素治疗期间发生HBsAg消失慢性乙型肝炎的临床基线特征进行分析和总结。
1 材料与方法
1.1 研究对象 研究对象为2009年10月至2015年10月北京地坛医院肝病中心肝病二科2018例干扰素治疗慢性乙型肝炎前瞻性临床观察队列中,经治疗获得HBsAg消失的患者,包括干扰素初治和核苷类似物治疗转换干扰素治疗的患者。患者经普通干扰素500万单位隔日注射1次或聚乙二醇干扰素α-2a(PEG-IFNα-2a)180 μg每周皮下注射1次治疗,对干扰素治疗应答不佳者加用核苷类似物治疗,根据治疗中病毒与血清学应答给予患者个性化疗程。收集HBsAg消失患者干扰素治疗前的基线资料,对影响干扰素疗效的基线因素特征进行分析。该研究通过首都医科大学附属北京地坛医院伦理委员会通过,患者并签署知情书。
1.2 观察指标检测 根据影响慢性乙型肝炎干扰素治疗效果的主要因素,收集干扰素治疗前患者的年龄、性别、干扰素类型、NA治疗史、HBV DNA含量、HBsAg/抗HBs水平、HBeAg/抗HBe含量、ALT水平、核苷类似物联合治疗状况及干扰素治疗期间HBsAg消失的时间。ALT及肝功能其他指标经自动生化检测仪检测,血清HBV DNA含量经罗氏CobasAmpliPrep/CobasTaqMan96全自动实时荧光定量PCR检测试剂检测(检测下限为<20 IU/ml)。HBsAg/抗HBs水平、HBeAg/抗HBe经Abbott architac i2000 检测试剂检测,HBsAg水平检测范围0.05-250 IU/ml,HBsAg水平大于250IU/ml者将自动稀释500倍,实际HBsAg水平以检测值乘于500计算。HBsAg<0.05 IU/ml定义为HBsAg消失。治疗期间每3个月检查1次HBV DNA含量、HBsAg/抗HBs水平、HBeAg/抗HBe含量,间隔1-3个月检查外周血白细胞、中性粒细胞和血小板计数、肝功能和肾功能。
1.3 统计学方法 干扰素治疗期间获得HBsAg消失患者的临床基线特征。正态分布计量资料采用均值±标准差(Mean±SD)进行统计描述,偏态计量资料采用中位数和四分位距(Median,Q1,Q3)表示,组间差异及相关性检验采用t检验、方差分析和线性回归分析;定性资料采用频数和频率进行统计描述,组间差异采用卡方检验(Chisq-square test);统计分析应用SPSS17统计分析软件进行。
2 结果
2.1 人口学资料与治疗 2018例干扰素治疗慢性乙型肝炎患者观察队列中,329例治疗期间获得HBsAg消失,男性238例、女性91例,年龄31(25,37)岁。干扰素初治患者201例,核苷类似物在治疗患者128例(拉米夫定42例,阿德福韦酯48例,恩替卡韦36例,替比夫定2例)。PEG-IFNα-2a治疗226例,普通干扰素α(IFN α)治疗103例,见表1。
2.2 ALT水平ALT水平 261.28±435.20 U/L,62例>10 ULN,40例5-10 ULN,80例2-5 ULN,64例1-2 ULN,ALT水平正常83例(其中例为NA在治疗患者60例,19例肝脏组织学检查为G2或S2以上病变,其余4例根据以往肝炎发病和治疗历史,超声检查和肝脏弹性测定、肝功能指标和凝血功能等考虑有肝炎存在),见表1。95例(38.88%)高病毒载量者(HBV DNA>106IU/ml)的ALT水平为337.00±414.87 U/l。
2.3 HBV NDA含量与HBsAg水平 干扰素治疗前,96例NA治疗患者HBV DNA含量在检测线以下,233例HBV DNA阳性患者的HBV DNA含量为5.16±1.83log10IU/ml,95(38.88%)例高病毒载量者(HBV DNA>106IU/ml)的HBV DNA水平为7.00±0.63 log10IU/ml。48例干扰素初治患者因单用干扰素治疗HBV DNA未达检测线以下而加用NA治疗(LAM32例,ETV10例和ADV6例),48.08%(25/52)的HBV DNA>107IU/ml患者联合NA治疗。
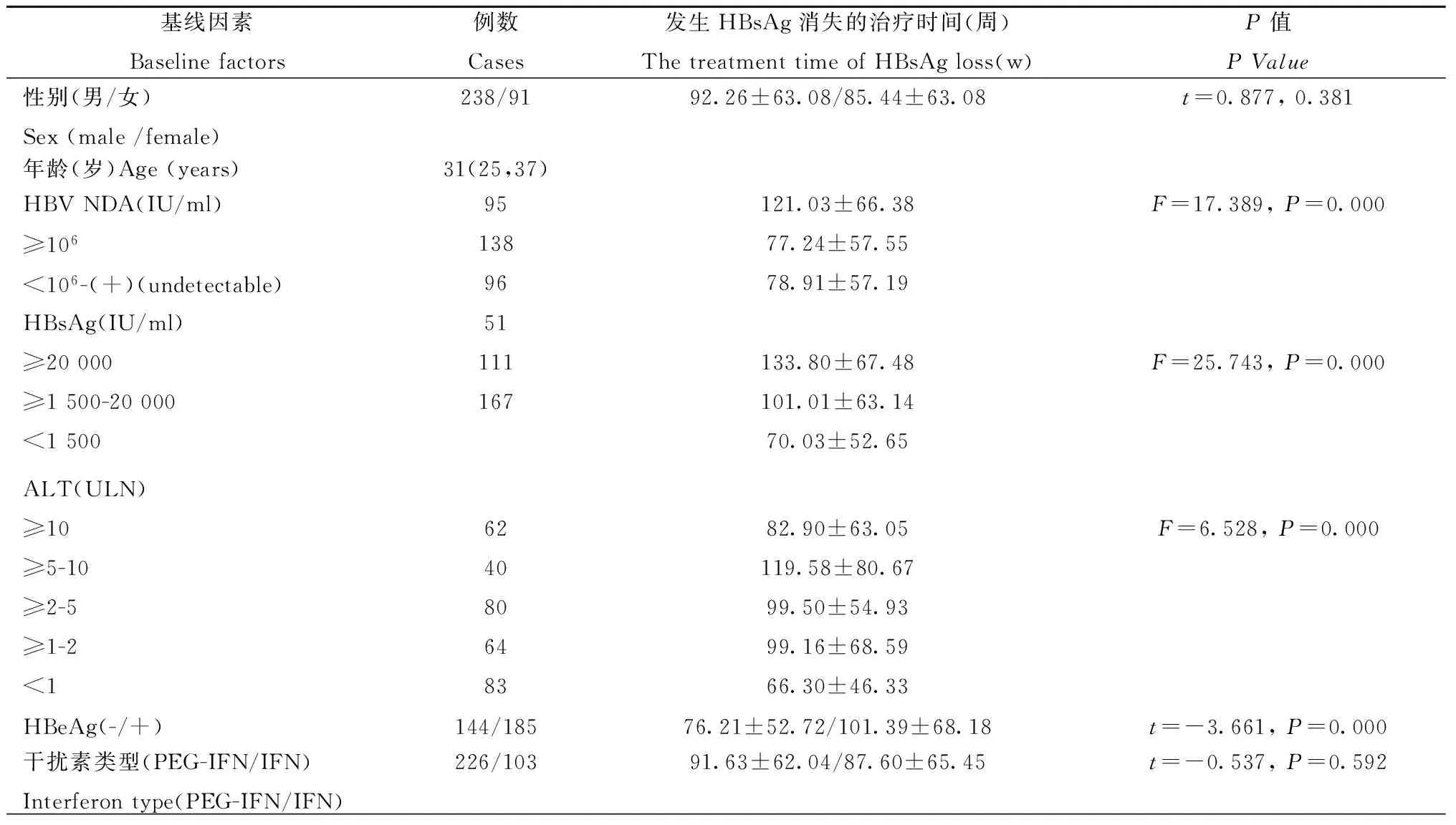
表1 临床基线因素与HBsAg消失的治疗时间
干扰素治疗前HBsAg基线水平2.92±1.15log10IU/ml,初治患者HBsAg水平(3.23±1.09 log10IU/ml)显著高于NA在治疗患者(2.44±1.06 log10IU/ml)(t=-6.425,P=0.000),167(50.8%)例HBsAg<1500 IU/ml(初治患者和NA治疗患者分别有89例和77例),见表1。HBV DNA阳性患者的HBsAg水平为3.23±1.06 log10IU/ml,显著高于HBV DNA阴性患者(2.16±0.98log10IU/ml)(t=8.353,P=0.000)。203例HBeAg阳性患者、126例HBeAg阴性患者和18例经NA治疗获得HBeAg消失患者的HBsAg水平分别为3.47±0.93 log10IU/ml、2.24±1.04 log10IU/ml和1.98±0.62 log10IU/ml,差异显著的统计学意义(F=70.854,P=0.000)。
2.4 HBsAg消失的治疗时间 HBsAg消失发生于干扰素治疗90.2±63.0周,69.9%的HBsAg消失发生于48周疗程以上。HBeAg阳性患者HBsAg消失的治疗时间(97.76±67.41周)显著长于HBeAg阴性患HBsAg消失发生的治疗时间(78.13±53.39周)(t=2.782,P=0.006)。HBsAg基线水平与发生HBsAg消失的治疗时间显著相关,基线HBsAg水平越高,发生HBsAg消失所需治疗时间越长(f=25.743,P=0.000),见表1。线性回归分析显示,HBsAg消失所需的治疗时间与基线HBsAg水平(t=4.298,P=0.000)、HBeAg含量(t=2.121,P=0.035)和ALT水平(t=-2.463,P=0.014)独立相关,虽然单因素分析HBV DNA含量与发生HBsAg消失的治疗时间显著相关,但回归分析无显著意义(t=1.191,P=0.235),HBsAg消失发生的治疗时间也与IFN类型(t=-0.144,P=0.885)、年龄(t=-0.071, 0.944)和性别(t=-1.556,P=0.121)无相关性。
3 讨论
HBsAg消失虽是慢性乙型肝炎抗病毒治疗理想的治疗终点和追求的治疗目标,但不进行优势患者的选择,干扰素标准治疗(聚乙二醇干扰素治疗48周)的总体HBsAg消失率仅有2.0%-7.0%[5, 10-11]。为了提高干扰素治疗的HBsAg消失发生率,需根据患者的基线选择干扰素治疗优势患者,并给与个性化治疗。
本研究结果显示,发生HBsAg消失患者年轻,75%的年龄在37岁以下;干扰素初治患者患者具有较高的ALT水平,高病毒载量者从病毒含量角度考虑可能不具对干扰素治疗的优势,但本组高病毒载量者较高的ALT水平(337.00±414.87 U/l),表明其有较好的免疫清除能力,而高ALT水平表明对干扰素治疗有良好的应答[12,13]。
HBV DNA含量是影响干扰素疗效的重要因素,基线HBV DNA含量越高,干扰素疗效越差[12, 14]。本研究结果显示,经干扰素治疗获得HBsAg消失者的总体HBV DNA含量为5.16±1.83 log10IU/ml,虽有38.88%为高病毒含量(HBV DNA>106IU/ml),且平均HBV DNA含量达7.00±0.63 log10IU/ml,甚至多因素回归分析显示,基线HBV DNA水平与HBsAg消失发生的治疗时间无显著性相关,其原因可能是,在本研究中高HBV DNA含量患者有较高的ALT水平,并有38例联合了NA治疗,特别是HBV DNA>107IU/ml者,近一半采用了干扰素/NA的联合治疗。研究结果提示,低HBV DNA含量有利于干扰素治疗,但高病毒含量患者,如具高ALT水平,且联合NA治疗仍可有可能获得理想的治疗终点。
HBsAg水平可反映慢性乙肝患者肝脏内转录活性的cccDNA水平[15]、对HBV的免疫控制能力[16]及病毒感染肝细胞的清除程度[15]。基线HBsAg水平可预测对干扰素治疗的疗效[10, 17, 18],而且比HBV DNA含量更有预测价值[19]。本研究经干扰素治疗获得HBsAg消失患者的HBsAg水平2.92±1.15 log10IU/ml,低于报道的亚洲普通慢性乙型肝炎患者的HBsAg水平(3.35-4.03 log10IU/ml)[20]。虽基线HBsAg>20000 IU/ml预示对干扰素疗效差[13],本研究也有38.88%为高病毒含量患者,但仅14.89%HBsAg≥20000 IU/ml,且HBV DNA>107IU/ml中的25例进行NA联合治疗。以往的研究显示,干扰素治疗前的基线HBsAg<1500 IU/ml[21, 22]或治疗24周HBsAg<1500 IU/ml均预示对干扰素良好的应答[23, 24],本研究中50.8%的患者为基线HBsAg<1500 IU/ml,特别在NA治疗患者,69.5%(89/128)的患者HBsAg<1500 IU/ml,提示低HBsAg水平是干扰素治疗获得HBsAg消失的优势患者。
本研究中绝大多数发生HBsAg消失的治疗所需治疗时间较长,HBeAg阳性和HBeAg阴性患者干扰素治疗发生HBsAg消失的平均时间为97.76周和78.13周;HBsAg水平与干扰素治疗发生HBsAg消失的治疗时间显著相关,HBsAg水平越高,获得HBsAg消失所需要的时间越长,虽然单因素分析HBV DNA含量与发生HBsAg消失的治疗时间显著相关,但回归分析无显著意义(t=1.191,P=0.235)。线性回归分析显示,基线HBsAg水平、HBeAg含量和ALT水平是干扰素治疗发生HBsAg消失的治疗时机独立相关因素,结果提示,在干扰素治疗优势患者的选择中,较低基线HBsAg水平、低HBeAg含量和高ALT水平是更重要考虑的因素。
总之,通过干扰素治疗达到HBsAg消失的患者有年轻、高ALT水平、低HBsAg水平和HBV DNA的特点,即便如此,要获得HBsAg消失多数患者仍需长时间治疗,而对高HBV DNA含量或HBsAg水平的患者,特别是伴有高ALT水平的患者,未必不能达到理想治疗终点,高HBV DNA含量患者常须采用干扰素和NA联合治疗,只要治疗期间有良好应答,不应放弃最求理想治疗终点。
[1] Lok AS, McMahon BJ. Chronic hepatitis B: update 2009[J]. Hepatology, 2009,50(3): 661-662. doi:10.1002/hep.23190.
[2] EASL clinical practice guidelines: Management of chronic hepatitis B virus infection[J]. J Hepatol, 2012,57(1): 167-185. doi:10.1016/j.jhep.2012.02.010.
[3] Sarin SK, Kumar M, Lau GK, et al. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update[J]. Hepatol Int, 2016,10(1):1-98. doi:10.1007/s12072-015-9675-4.
[4] Moucari R, Korevaar A, Lada O, et al. High rates of HBsAg seroconversion in HBeAg-positive chronic hepatitis B patients responding to interferon: a long-term follow-up study[J]. J Hepatol, 2009,50(6): 1084-1092. doi:10.1016/j.jhep.2009.01.016.
[5] Lau GK, Piratvisuth T, Luo KX, et al. Peginterferon Alfa-2a, lamivudine, and the combination for HBeAg-positive chronic hepatitis B[J]. N Engl J Med, 2005,352(26): 2682-2695. doi:10. 1056/NEJMoa043470.
[6] Lau GK, Marcellin P,Brunetto P, et al. On-treatment HBsAg decline during peginterferon alfa-2a (40kd) ± lamivudine in patients with hbeag-positive chb as a potential predictor of durable off-treatment response. AASLD 2008abstract 910.
[7] Zoulim F, Perrillo R. Hepatitis B: reflections on the current approach to antiviral therapy[J]. J Hepatol, 2008,48 Suppl 1: S2-19. doi:10.1016/j.jhep.2008.01.011.
[8] Cooksley G, Manns M, Lau GKK, et al. Effect of genotype and other baseline factors on response to peginterferon a-2a (40 kda) (pegasys®) in HBeAg-positive chronic hepatitis b: results from a large, randomised study. Journal of Hepatology, 2005, 42:(Suppl 2):30.
[9] Buster EH, Hansen BE, Lau GK, et al. Prediction of response to peginterferon-alfa in HBeAg positive chronic hepatitis b: a model based on 721 patients[J]. AASLD2008 abstract 929. doi:10.1002/jmv.21778.
[10] Moucari R, Mackiewicz V, Lada O, et al. Early serum HBsAg drop: a strong predictor of sustained virological response to pegylated interferon alfa-2a in HBeAg-negative patients[J]. Hepatology, 2009,49(4): 1151-1157. doi:10.1002/hep.22744.
[11] Flink HJ, van Zonneveld M, Hansen BE, et al. Treatment with Peg-interferon alpha-2b for HBeAg-positive chronic hepatitis B: HBsAg loss is associated with HBV genotype[J]. Am J Gastroenterol, 2006,101(2):297-303. doi:10.1111/j.1572-0241.2006.00418.x.
[12] Liaw YF, Jia JD, Chan HL, et al. Shorter durations and lower doses of peginterferon alfa-2a are associated with inferior hepatitis B e antigen seroconversion rates in hepatitis B virus genotypes B or C[J]. Hepatology, 2011,54(5): 1591-9. doi:10.1002/hep.24555.
[13] ChanHLY, Papatheodoridis GV, Messinger D, et al.A predictive tool for selecting HBeAg-positive chronic hepatitis B patients who have a high probability of HBV DNA suppression and HBeAg seroconversion with peginterferon alfa-2a. Hepatology, 2014, 60: (SUPPL):1108A.
[14] Fried MW, Piratvisuth T, Lau GK, et al. HBeAg and hepatitis B virus DNA as outcome predictors during therapy with peginterferon alfa-2a for HBeAg-positive chronic hepatitis B[J]. Hepatology, 2008,47(2): 428-434. doi:10.1002/hep.22065.
[15] Moucari R, Lada O, Marcellin P. Chronic hepatitis B: back to the future with HBsAg[J]. Expert Rev Anti Infect Ther, 2009,7(6): 633-636. doi:10.1586/eri.09.57.
[16] van Campenhout MJ, Janssen HL. How to achieve immune control in chronic hepatitis B[J]. Hepatol Int, 2015,9(1): 9-16. doi:10.1007/s12072-014-9571-3.
[17] Brunetto MR, Moriconi F, Bonino F, et al. Hepatitis B virus surface antigen levels: a guide to sustained response to peginterferon alfa-2a in HBeAg-negative chronic hepatitis B[J]. Hepatology, 2009,49(4): 1141-1450. doi:10.1002/hep.22760.
[18] Chan HL, Wong GL, Tse CH, et al. Viral determinants of hepatitis B surface antigen seroclearance in hepatitis B e antigen-negative chronic hepatitis B patients[J]. J Infect Dis, 2011,204(3): 408-414. doi:10.1093/infdis/jir283.
[19] Chan HL, Wong VW, Tse AM, et al. Serum hepatitis B surface antigen quantitation can reflect hepatitis B virus in the liver and predict treatment response[J]. Clin Gastroenterol Hepatol, 2007,5(12): 1462-1468. doi:10.1016/j.cgh.2007.09.005.
[20] Nguyen T, Thompson AJ, Bowden S, et al. Hepatitis B surface antigen levels during the natural history of chronic hepatitis B: a perspective on Asia[J]. J Hepatol, 2010,52(4): 508-513. doi:10.1016/j.jhep.2010.01.007.
[21] Ning Q, Han M, Sun Y, et al. Switching from entecavir to PegIFN alfa-2a in patients with HBeAg-positive chronic hepatitis B: a randomised open-label trial (OSST trial) [J]. J Hepatol, 2014,61(4): 777-784. doi:10.1016/j.jhep.2014.05.044.
[22] Ren H, Hu P, Jia S,et al.A multi-center randomized study on the efficacy and safety of switching to peginterferonα-2a (40KD) for 48 or 96weeks in HBeAg positive CHB patients with a prior NUC history for 1 to 3 years: an interim analysis of NEW SWITCHstudy. Hepatology, 2014, 60: suppl:1-1266.
[23] Lau G, Marcellin PBM. On treatment monitoring of HBsAg levels to predict response to peginterferon alfa-2a in patients with HBeAg-positive chronic hepatitis B[J]. J Hepatol, 2009, 50:333.
[24] Gane E, Jia J, Han K, et al.Neptune study: On- treatment HbsAg level analysis confirms prediction of response observed in ppase 3 study of peginterferon alfa-2a in HbeAg-positive patients [J]. J Hepatol, 2011,54: Supplement 1: S31.
The baseline characteristics of patients with chronic hepatitis B and achieved HBsAg loss during treatment of interferon
XieYao,LiMinghui,ZhangLu,JinLi,ZhangDan,LuYao,WuShuling,ShenGe,LiuRuyu,HuLeiping,ChangMin,SongShujing,ZhangShufeng,HuaWenhao,ChengJun,XuDaozhen.
SecondDivisionofLiverDiseasesCenter,BeijingDitanHospital,CapitalMedicalUniversityBeijing100015,China
XieYaoandLiMinghuiarethefirstauthorswhocontributedeaquallytothearticle
s:XieYao,Email:xieyao00120184@sina.com;LiMinghui,Email:wuhm2000@sina.com
Objective To investigate the clinical baseline characteristics of patients with chronic hepatitis B who received interferon therapy and achieved HBsAg loss on-treatment of interferon. MethodsDemographic, viral, and serological baseline factors, Including age, sex, DNA HBV levels, HBsAg/anti HBs levels, HBeAg/anti HBe levels, in patients achieved HBsAg loss on-treatment from a prospective observational cohort of chronic hepatitis B treated with interferon and their time of HBsAg loss during treatment were collected. Quantitative data was expressed as mean±standard deviation, difference between groups was tested byttest or variance analysis, and the relationship was analyzed by linear regression analysis. Qualitative data wasStatistical performed by frequency or percent. Results A total of 329 patients achieved HBsAg loss during interferon treatment, including 201 naïve patients and 128 undergoing nucleoside analogue(NA) therapy patients. Average age of these patients was 32 years old, the ALT levels were 261.28±435.20U/L.TheHBV DNA levels of HBV DNA positive patients were 5.16±1.83 log10IU/ml, and the ALT levels of patients with HBV DNA>106IU/ml were 337.00±414.87 U/l. 48.08%(25/52) of patients with HBV DNA>107IU/ml were treated by IFN added NA. Baseline HBsAg were 2.92±1.15 log10IU/ml, and 50.8% of patients were HBsAg<1 500 IU/ml. the time of HBsAg loss occurred at treatment of 90.2±63.0 weeks, 69.9% of them occurred at treatment course above 48 weeks. The time of HBsAg loss occurred during interferon treatment was correlated with baseline levels of HBsAg, HBeAg and ALT independently. Conclusions Patients with Chronic hepatitis B and achieved HBsAg loss during interferon treatment have characteristics of young, high ALT and low HBsAg levels. Patients with higher HBV DNA load and ALT levels should receive interferon combined with NA therapy for achieving HBsAg loss.
Hepatitis B, chronic;Antiviral therapy; Hepatitis B virus; Polyethylene glycols
谢尧,Email:xieyao00120184@sina.com;李明慧,Email:wuhm2000@sina.com
10.3760/cma.j.issn.1003-9279.2016.05.016
肝炎,乙型,慢性;抗病毒治疗;肝炎病毒,乙型; 聚乙烯二醇类
2016-06-06)

