重组腺病毒载体HIV-1 env疫苗合用佐剂的免疫效果研究
余炼 何小周 王琬玓 冯霞 徐柯 曾毅
100124 北京工业大学生命科学与生物工程学院病毒与药理室(余炼、曾毅);中国疾病预防控制中心病毒病预防控制所传染病预防控制国家重点实验室(何小周、王琬玓、冯霞、曾毅、徐柯)
·论著·
重组腺病毒载体HIV-1 env疫苗合用佐剂的免疫效果研究
余炼 何小周 王琬玓 冯霞 徐柯 曾毅
100124 北京工业大学生命科学与生物工程学院病毒与药理室(余炼、曾毅);中国疾病预防控制中心病毒病预防控制所传染病预防控制国家重点实验室(何小周、王琬玓、冯霞、曾毅、徐柯)
目的 探讨添加IL-7、IL-21基因佐剂及Poly(I:C)、CpG ODN对艾滋病疫苗的免疫效果有无增强作用。方法 构建了表达IL-7、IL-21基因的质粒pVR-IL7、pVR-IL21,以DNA疫苗(pVR-HIVenv)对小鼠进行初免,以腺病毒载体疫苗(Ad5-HIVenv)添加佐剂进行加强免疫,末次免疫后两周分别采用酶联免疫斑点法(ELISPOT)和酶联免疫吸附法(ELISA)检测免疫小鼠诱导的特异性细胞免疫反应和体液免疫反应。结果 ELISPOT结果显示Ad5-HIVenv疫苗联合IL7组小鼠每百万个脾淋巴细胞中分泌IFN-γ的细胞数(SFC)/106高于疫苗单独免疫组小鼠(P<0.05);IL-7和CpG ODN作为佐剂同时使用可以进一步的提高免疫反应(P<0.05)。结论 Ad5-HIVenv疫苗联合IL7佐剂及CpG ODN具有较强的细胞免疫反应,而联用IL21佐剂则未见明显的免疫增强作用。
Fund programs: National Science and Technology Major Project of China for Infectious Diseases (2012ZXl0001009-005,2012ZX10001009-002-002)
人类免疫缺陷病毒(Human Immunodeficiency Virus, HIV)因其高度的变异性和独特的复制周期,直到现在仍然没有有效的疫苗问世。相较于疫苗单独免疫,添加佐剂能诱导出更高强度针对病原体的保护性免疫反应[1]。有研究发现,细胞因子及Toll样受体激动剂在免疫应答过程中起重要作用,因而可作为疫苗佐剂使用[1,2]。IL-7是一类主要由非骨髓来源的基质细胞和上皮细胞产生的细胞因子,在促进T淋巴细胞产生和发育成熟的过程中发挥重要作用。IL-21与其受体结合后可以调节B细胞的增殖,促进T细胞、NK细胞的增殖等。Poly(I:C)是人工合成的双链RNA类似物,目前Poly(I:C)被用于基于树突状细胞疫苗等疫苗的佐剂[3]。CpG ODN是一种寡脱氧核苷酸,国外有临床研究证明,CpG ODN能显著增强受体的体液免疫和细胞免疫应答,作为乙肝疫苗佐剂能提高人体免疫应答[4]。本研究通过比较DNA疫苗(pVR-HIVenv)初免之后,Ad5-HIVenv疫苗单独免疫小鼠,以及分别与IL-7、IL-21基因佐剂以及Poly(I:C)、CpG ODN联合免疫小鼠的效果,来探究一种更强的佐剂联合免疫方案。
1 材料与方法
1.1 材料 表达密码子优化的HIV-1 B 亚型env基因的E1、E3缺失的重组5 型腺病毒载体疫苗Ad5-HIVenv、表达密码子优化的HIV-1 B亚型env基因的pVR质粒pVR-HIVenv由本室构建[5],pVR质粒由本室保存,4-6周龄的雌性BALB/c小鼠(SCXK2012-0004,中国食品药品检定研究院),Mice IFN-γ ELISPOT Kit(Mabtech公司),PMA、ionomycin(Sigma-Aldrich公司),env多肽(旭和源生物技术公司合成),FuGENE HD(Promega公司),Poly(I:C)、CpG ODN(InvivoGen公司),gp120、gp41蛋白(Immune technology公司),限制性内切酶Xbal、BglII(上海捷瑞生物工程有限公司)。
1.2 方法
1.2.1 表达小鼠IL-7、IL-21基因的质粒pVR-IL7、pVR-IL21的构建:本研究以GenBank中小鼠的IL-7、IL-21的氨基酸参考序列出发,进行密码子优化后人工合成IL-7、IL-21基因序列并克隆至pVR质粒载体中,构建成表达小鼠IL-7、IL-21的基因佐剂pVR-IL7、pVR-IL21质粒,并进行酶切、测序及Western Blot鉴定。
1.2.2 Ad5-HIVenv疫苗添加IL-7、IL-21基因佐剂及Poly(I:C)、CpG ODN的小鼠分组及免疫:4-6周龄的雌性BALB/c小鼠随机分为8组,每组5只,按表1所示方案免疫小鼠,免疫小鼠采用后肢肌肉注射。免疫剂量分别为:PBS,100 μl/只;DNA(pVR-HIV env),100 μg/只;Ad5(Ad5-HIVenv),2×108VP/只;pVR-IL7、pVR-IL21质粒、Poly(I:C)、CpG ODN均为100 μg/只。各组小鼠于末次免疫后两周脱颈处死,眼眶静脉丛采血并分离血清,同时取脾脏并分离脾淋巴细胞。
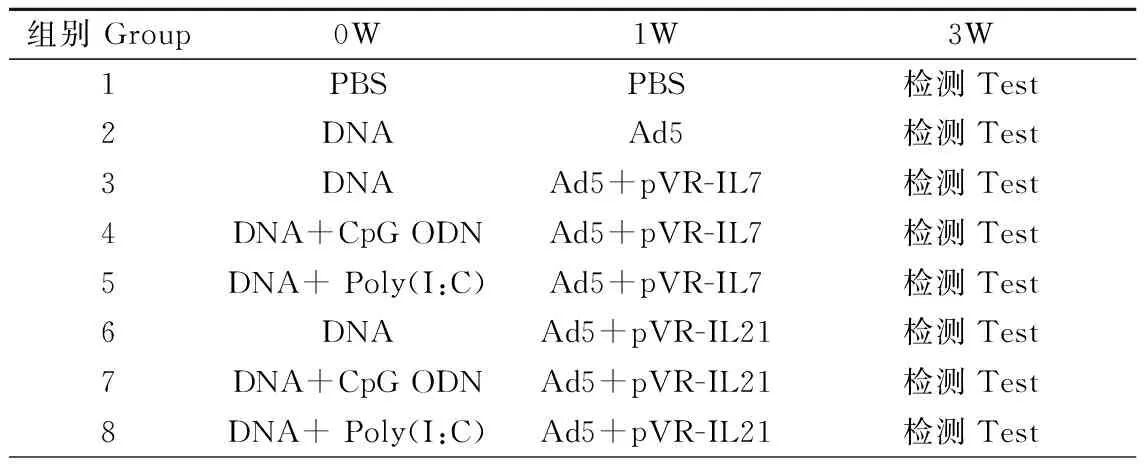
表1 表达HIV env的Ad5疫苗与不同佐剂联用
1.2.3 HIV-1 env特异性细胞免疫反应的检测:实验采用ELISPOT法检测免疫小鼠诱导的HIV-1 env特异性细胞免疫反应,以1.2.2中分离得到的脾淋巴细胞作为样本按照MABTECH公司的Mice IFN-γ ELISPOT试剂盒说明书进行操作,调整细胞浓度为4×106个/ml,配制阳性刺激物ionomycin(2 μg/ml)和PMA(50 ng/ml)、env多肽(4 μg/ml)。阳性孔每孔加入50 μl阳性刺激物,实验孔每孔加入50 μl env多肽,阴性孔每孔加入50 μl 10% FBS的1640培养基,各孔再加入细胞悬液50 μl,空白孔不加细胞和刺激物(终体积为100 μl/孔),置37 ℃ 5% CO2培养箱培养48 h,显色后记录斑点数目,计算每百万淋巴细胞中的斑点形成细胞数(SFC)/106。
1.2.4 HIV-1 env特异性体液免疫反应的检测:实验采用ELISA法检测1.2.2中分离得到的血清样本中gp120、gp41抗体IgG滴度。在4 ℃过夜包被gp120、gp41抗原(0.5 μg/ml)的96孔滴定板中,加入从1∶50开始4倍梯度稀释的小鼠血清,37 ℃温浴1 h;弃血清,洗板机洗5次,加入辣根氧化酶(HRP)标记的山羊抗小鼠IgG(1∶5000),37 ℃温浴1 h;弃二抗,洗板机洗5次,加显色液室温30 min,遮光显色;最后,加入终止液终止反应,酶标仪450/630 nm波长测OD值,计算抗体滴度。
1.3 统计学方法 用SPSS17.0 统计软件对实验数据进行统计分析,组间两两比较采用Dunn′s Multiple Comparison 检验,各组间结果采用非参数检验Kruskal-Wallis test,以P<0.05 有统计学意义。
2 结果
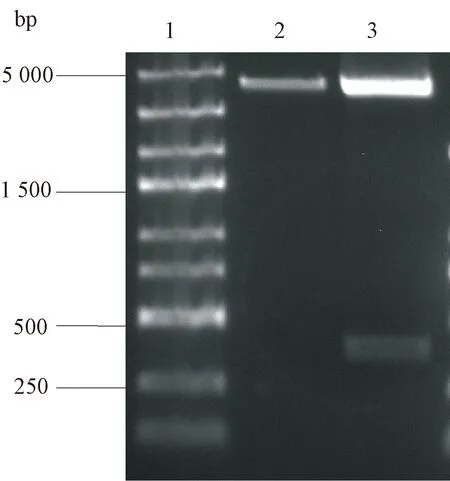
1:DNA分子量标准;2:pVR酶切图谱;3:pVR-IL7酶切图谱图1 pVR和pVR-IL7双酶切电泳结果1:DNA Marker;2:Result of pVR;3:Result of pVR-IL7Fig.1 Gel electrophoresis of pVR and pVR-IL7 and their double-digestion patterns

1:DNA分子量标准;2:pVR酶切图谱;3:pVR-IL21酶切图谱图2 pVR和pVR-IL21双酶切电泳结果1:DNA Marker;2:Result of pVR;3:Result of pVR-IL21Fig.2 Gel electrophoresis of pVR and pVR-IL21 and their double-digestion patterns
2.1 表达小鼠IL-7、IL-21基因的重组质粒的鉴定。 构建的两个重组质粒(pVR-IL7)和(pVR-IL21),经Xbal和BglII双酶切鉴定后,均符合预期结果(如图1和图2所示)。两质粒均送至北京擎科新业生物技术有限公司测序鉴定,连接框架和准确性均符合要求,说明两个重组质粒构建成功。2.2 蛋白表达与鉴定 以测序和酶切鉴定结果正确的重组质粒pVR-IL7和pVR-IL21按照FuGENE HD的说明书分别转染293细胞,培养48-72 h后,采用Western Blot鉴定IL-7、IL-21的蛋白表达,显示均有外源蛋白表达,相对分子质量与预期大小一致。

1:蛋白分子质量标准; 2:转染pVR-IL7的293细胞; 3:正常的293细胞图3 质粒pVR-IL7中IL7基因表达水平鉴定1:Prestained Protein Manker; 2:293 cells transfected with pVR-IL7; 3:Mock 293 cellsFig.3 Expression of pVR-IL7 in vitro
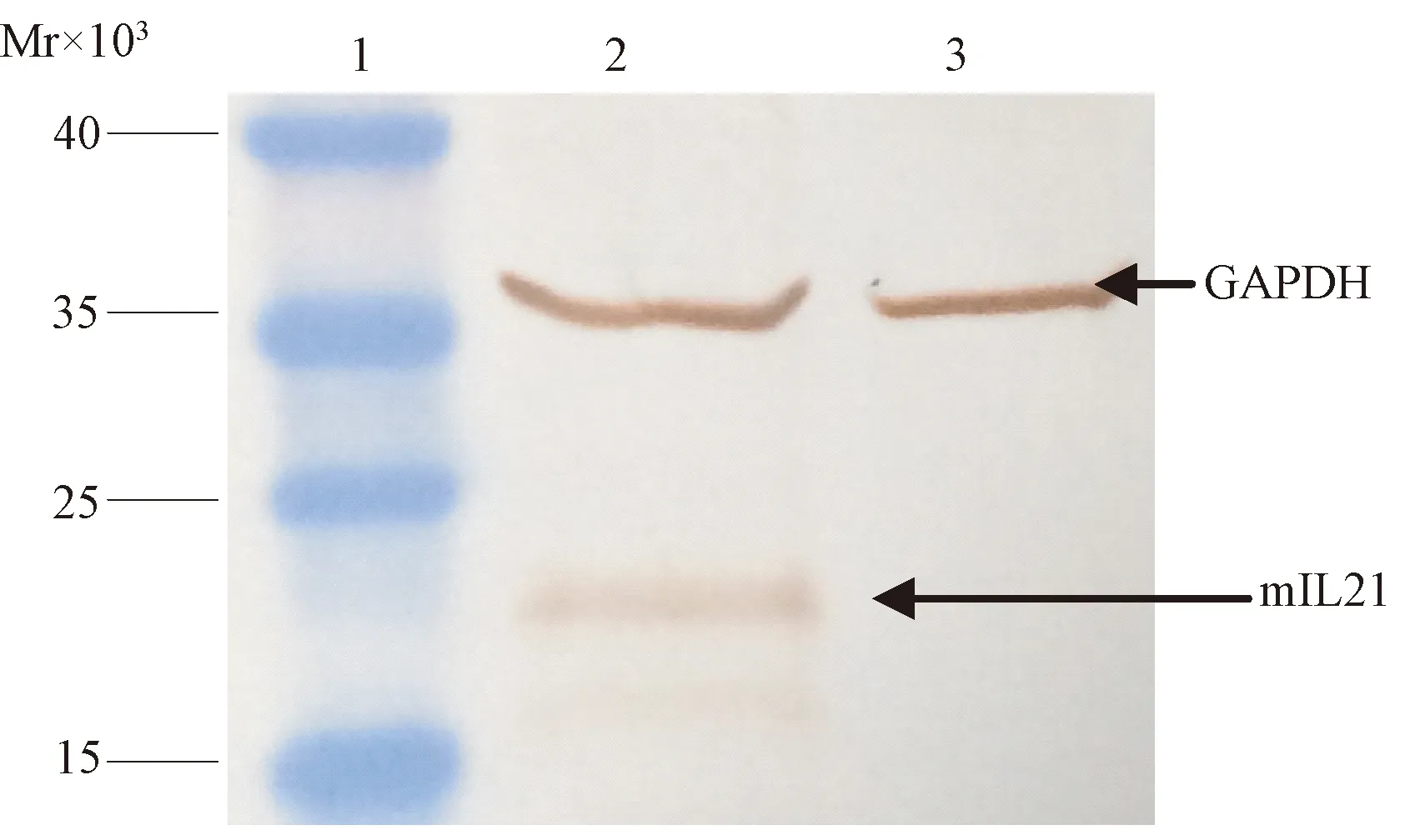
1:蛋白分子质量标准;2:转染pVR-IL21的293细胞; 3:正常的293细胞图4 质粒pVR-IL21中IL21基因表达水平鉴定1:Prestained Protein Manker; 2:293 cells transfected with pVR-IL21; 3:Mock 293 cellsFig.4 Expression of pVR-IL21 in vitro
2.3 Ad5-HIV env疫苗添加IL-7、IL-21基因佐剂及Poly(I:C)、CpG ODN的小鼠ELISPOT和ELISA结果 ELISPOT结果显示Ad5-HIVenv疫苗联合pVR-IL7佐剂组小鼠(SFC)/106高于疫苗单独免疫组小鼠(P<0.05);Ad5-HIVenv疫苗联合pVR-IL7佐剂及CpG ODN组的(SFC)/106高于Ad5-HI env疫苗联合pVR-IL7佐剂组(P<0.05);而添加IL-21基因佐剂组的(SFC)/106与疫苗单独免疫组小鼠相比,并没有增强作用,如图5所示。
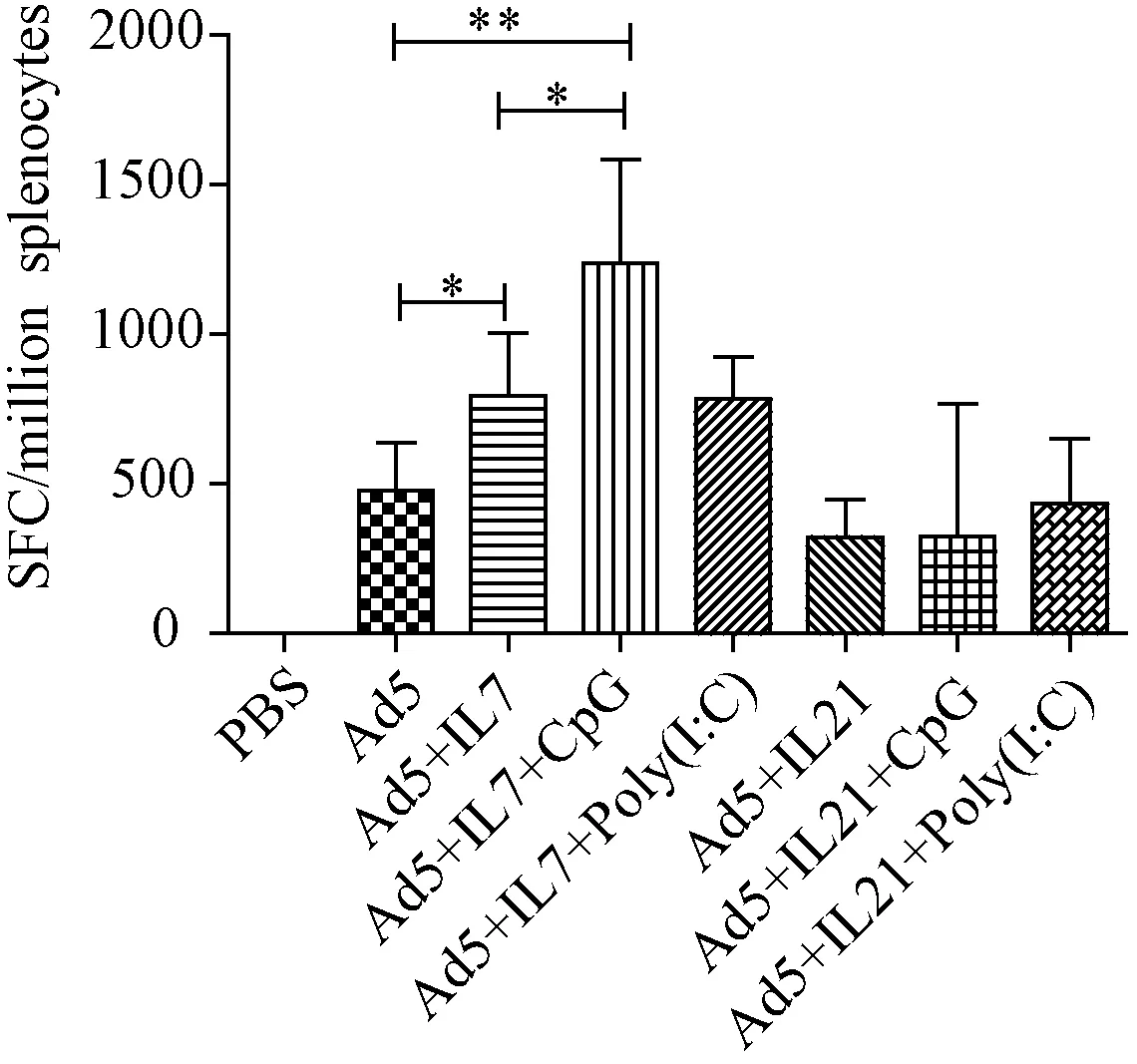
图5 免疫小鼠的特异性细胞免疫反应Fig.5 Cellular immune response in immunized mice
通过ELISA方法进一步研究表明,添加佐剂组小鼠血清中gp120、gp41抗体IgG滴度与疫苗单独免疫组相比,并无显著性差异(结果未显示)。
3 讨论
艾滋病毒因其基因具有较大变异性,目前仍没有有效的艾滋病预防性疫苗问世,研制治疗性疫苗因此成为目前艾滋病疫苗研发的主要方向,同时利用各种佐剂如细胞因子佐剂和Toll样受体激动剂佐剂增强艾滋病疫苗的免疫效力也是目前研究中的新策略。SIN等证实IL-7作为疫苗佐剂可以增强抗原特异性CTL反应[6]。近年来,一些研究报道以细胞因子作为HIV疫苗佐剂可以增强疫苗的免疫效果,其中包括白细胞介素21[2]。Poly(I:C)、CpG ODN均为Toll样受体激动剂,均能够通过与相应的受体结合,激活机体免疫系统,并增强特异性细胞免疫反应。
本课题组前期的研究中提出的使用多载体HIV疫苗进行重复和序贯免疫的策略证实,在接受多载体疫苗序贯免疫的动物体内能诱导持续时间较长、反应强度较高的HIV特异性免疫反应。本研究构建了表达小鼠IL7、IL21的质粒pVR-IL7和pVR-IL21,经酶切、测序鉴定均正确,并将这两个质粒瞬
时转染293细胞,Western blot显示IL7、IL21均能在293细胞中有效表达。我们将pVR-IL7和pVR-IL21质粒及Poly(I:C)、CpG ODN以不同的组合联合免疫小鼠,发现Ad5-HIVenv疫苗联合pVR-IL7佐剂及CpG ODN组的细胞免疫水平高于 Ad5-HIVenv疫苗联合pVR-IL7佐剂组,并且显著高于疫苗单独免疫组;而添加IL-21基因佐剂组与疫苗单独免疫组小鼠相比,并没有增强作用。这一结果提示添加pVR-IL7基因佐剂及CpG ODN可以增强艾滋疫苗DNA初免,载体疫苗加强免疫策略诱导的特异性细胞免疫反应,为艾滋病疫苗添加佐剂的应用提供了参考。
[1] Robert LC, Alan S, Robert AS. Vaccine Adjuvants: Putting Innate Immunity to Work[J]. Immunity, 2010,33(4): 492-503.doi:10.1016/j.immuni.2010.10.002.
[2] Tovey M G, Lallemand C. Adjuvant Activity of Cytokines[J]. Methods Mol Biol, 2010, 626:287-309.doi:10.1007/978-1-60761-585-9_19.
[3] Trumpfheller C, Caskey M, Nchinda G, et al. The Microbial Mimic Poly IC Induces Durable and Protective CD4+ T Cell Immunity together with a Dendritic Cell Targeted Vaccine[J]. Proc Natl Acad Sci USA, 2008,105(7):2574-2579.doi:10.1073/pnas.0711976105.
[4] Halperin SA, Ward B, Cooper C, et al. Comparison of safety and immunogenicity of two doses of investigational hepatitis B virus surface antigen co -administered with an immunostimulatory phosphorothioate oligodeoxyribonucleotide and three doses of a licensed hepatitis B vaccine in healthy adults 18-55 years of age[J].Vaccine, 2012,30(15):2556-2563.doi:10.1016/j.vaccine.2012.01.087.
[5] 杨海儒,张凌斐,冯霞,等.表达HIV-1 B亚型env基因的质粒DNA及腺病毒载体疫苗 的免疫原性研究[J].中华实验和临床病毒学杂志, 2010,24(6):415-417.doi:10.3760/cma.j.issn.1003-9279.2010.06.007.
[6] Sin Ji, Kim J, Patchuk C,et al.Interleukin 7 can enhance antigen-specific cytotoxic-T-lymphocyte and/or Th2-type immune responses in vivo[J]. Clin Diagn. Lab. Immunol,2000,7(5):751-758.doi:10.1128/CDLI.7.5.751-758.2000.
Adjuvants enhance cellular immune response induced by recombinant adenoviral vector encoding HIV-1 env gene in mice
YuLian,HeXiaozhou,WangWandi,FengXia,XuKe,ZengYi
LaboratoryofVirologyandPharmocology,CollegeofLifeScienceandBioengineering,BeijingUniversityofTechnology,Beijing100124,China(YuL,ZengY); (HeXZ,WangWD,FengX,XuK)
XuKe,Email:xukecdc@163.com;ZengYi,Email:zengyicdc@163.com
Objective To study the immune effects of IL-7, IL-21 as gene adjuvants, Poly(I:C) and CpG ODN for HIV vaccine. Methods Mouse interleukin 7 DNA adjuvant (pVR-IL7) and mouse interleukin 21 DNA adjuvant (pVR-IL21) were constructed. BALB/c mice received DNA prime-adenoviral vector boost immunization with pVR-HIVenv-Ad5-HIVenv alone or combined with pVR-IL7,pVR-IL21, Poly(I:C) and CpG ODN. Cellular and humoral immune responses were assessed by IFN-g enzyme-linked immunosorbent spot assay and enzyme-linked immunosorbent assay. Results Compared with those immunized with vaccines alone, the mice immunized with pVR-IL7 had increased specific cellular response (P<0.05), CpG ODN had synergic effects with IL7 as adjuvants(P<0.05) Conclusion IL7 but not IL21 can enhance the specific cellular immune response of Ad5-HIVenv in mice.
HIV vaccine;Adjuvant;IL-7;IL-21
徐柯,Email:xukecdc@163.com;曾毅,Email:zengyicdc@163.com
10.3760/cma.j.issn.1003-9279.2016.05.011
HIV疫苗;佐剂;IL-7;IL-21
国家科技重大专项艾滋病和病毒性肝炎等重大传染病防治(2012ZXl0001009-005,2012ZX10001009-002-002)
2016-03-15)

