甘蔗醋发酵产物在体外及模拟人体肠胃环境中的抗氧化活性
郑 平,吴幼茹,杨继伟,邹 毅,王在谦,李 楠,*(.广西大学生命科学与技术学院,广西 南宁 50004;.广西大学糖业工程技术研究中心,广西 南宁 50004;.广西海铭威酿酒股份有限公司,广西 来宾 546500)
甘蔗醋发酵产物在体外及模拟人体肠胃环境中的抗氧化活性
郑 平1,吴幼茹1,杨继伟1,邹 毅2,王在谦3,李 楠1,*
(1.广西大学生命科学与技术学院,广西 南宁 530004;2.广西大学糖业工程技术研究中心,广西 南宁 530004;3.广西海铭威酿酒股份有限公司,广西 来宾 546500)
甘蔗中含有丰富的多酚和黄酮类物质,本研究以总酚含量、黄酮含量、清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基能力、清除羟自由基(·OH)能力、总还原能力为指标,探讨由甘蔗汁发酵而成的甘蔗酒、甘蔗醋在体外及模拟人体消化环境整个过程中抗氧化活性的变化。结果表明,在酒精发酵阶段酒精对多酚和黄酮具有一定的提取作用;在醋酸发酵阶段多酚和黄酮含量呈现波动状态,这可能和发酵过程中的氧化、水解作用有关。甘蔗醋发酵产物在体外具有极强的清除DPPH自由基能力,同时甘蔗酒还具有较强清除·OH的能力。多酚和黄酮经过模拟人体肠胃消化环境后发生了一系列反应:多酚和黄酮在胃液环境中的含量极显著下降(P<0.01),而在肠液环境中含量略有上升。通过对不同发酵产物在体外及模拟人体肠胃消化环境下清除DPPH自由基能力、清除·OH能力、总还原能力的比较,表明人体肠胃环境中的抗氧化活性不仅受食物中抗氧化物质的影响,而且受消化液中pH值、蛋白酶、磷酸盐等多种生理因素的影响。
甘蔗汁;甘蔗酒;甘蔗醋;多酚;黄酮;模拟肠胃环境;抗氧化活性
甘蔗是一种重要的粮食作物,在热带和亚热带国家主要用于制糖工业[1]。甘蔗中含有丰富的蔗糖、氨基酸、维生素、尼克酸、核黄素、钾、钙、磷、铁以及蔗蜡等多种营养成分,其中铁含量在各种水果中,雄踞“冠军”宝座,素有“补血果”的美称[2]。据报道,甘蔗中还含有丰富的多酚和黄酮类物质,已被鉴定的低相对分子质量的多酚和黄酮类有20 多种,还有一些高相对分子质量的聚合物(如单宁和鞣酸)[3]。医学研究表明,甘蔗汁中丰富的多酚和黄酮类物质,具有较强的抗氧化能力、抗突变能力、抗发炎能力以及酪氨酸酶抑制能力[4-5]。因此将营养丰富的甘蔗汁通过微生物发酵制作成风味独特的甘蔗果酒和甘蔗醋饮品,对人体健康具有重要意义。
多酚类物质是植物代谢过程中的天然次生副产物,存在于各种水果蔬菜中,是一类具有实用前景的天然抗氧化剂以及自由基清除剂[6]。流行病学研究证实,自由基导致的氧化损伤与人类的衰老和疾病密切相关,一些慢性病和冠心病的发病率与摄入富含酚类物质的食物的多少有关。而黄酮类物质是具有多种生物活性的多酚类化合物,它是一种很强的抗氧剂,可有效清除人体内的氧自由基,如花青素可以抑制油脂性过氧化物的全阶段溢出,这种阻止氧化的能力是VE的10 倍以上,这种抗氧化作用可以阻止细胞的退化、衰老,也可阻止癌症的发生[7]。
食品或药品服用后先经过胃肠道消化、吸收后才能为机体所利用。食品或药品在胃肠道的消化受 pH值、消化酶、无机盐等多种生理因素的影响[8]。研究表明,多酚和黄酮在植物中能以蛋白络合物、苷原、聚合物等多种形式存在,肠胃消化作用对它们的释放和吸收具有较大影响[9]。目前,关于食品在人体体内环境的抗氧化活性研究报道较少。因此,本研究以总酚含量、黄酮含量、清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基能力、清除羟自由基(·OH)能力、总还原能力为指标,探讨甘蔗醋发酵阶段产物在体外环境、模拟人体胃环境以及十二指肠环境下的抗氧化活性,为甘蔗资源的研究开发提供科学依据。
1 材料与方法
1.1 材料与试剂
甘蔗汁 广西农业科学院甘蔗研究所成熟甘蔗(糖度16~18 °Bx);酿酒酵母(Hanseniaspora uvarum)、醋酸菌(Acetobacter pasteurianus) 广西大学生命科学与技术学院朗姆酒研发实验室。
DPPH 美国Sigma 公司;磷酸(食用级) 广田生化试剂经营部;抗坏血酸、碳酸氢钠、氢氧化钠、氯化钠 西陇化工股份有限公司;Folin-酚试剂、没食子酸、芦丁、硝酸铝、碳酸钠、亚硝酸钠、水杨酸钠、铁氰化钾、磷酸二氢钾 国药集团化学试剂有限公司;硫酸亚铁、三氯化铁、三氯乙酸、盐酸 广州市金华大化学试剂有限公司。
1.2 仪器与设备
PAL-1迷你数显折射计 广州市爱宕科学仪器有限公司;PL-303 电子分析天平 梅特勒-托利多仪器(上海)有限公司;N510C手提式高压灭菌锅、TW-12恒温水浴锅 重庆雅马拓科技有限公司;ZHWY-211B 新型大容量全温度恒温培养振荡器 上海智城分析仪器制造有限公司;UV mini-1240型紫外-可见分光光度计 日本岛津公司;HC-2517高速离心机 安徽中科中佳科学仪器有限公司;QJH-L100A 水果榨汁机 浙江千家汇电器制造有限公司。
1.3 方法
1.3.1 甘蔗醋发酵工艺操作要点
对甘蔗进行表面清洗,榨汁机榨取,将甘蔗汁加热至沸腾维持5 min,静置3 h以上,取上清液,用蒸馏水调整糖度为18 °Bx,得到甘蔗汁。用磷酸(食用级)调整pH值至4.5,按体积分数10%接入酿酒酵母(Hanseniaspora uvarum)种子液,28 ℃乙醇发酵7 d,当乙醇体积分数为8%时,对果酒进行过滤,得到甘蔗酒,再以甘蔗果酒为原料按体积分数12%接入醋酸菌(Acetobacter pasteurianus)种子液,于32 ℃、160 r/min条件下醋酸发酵6 d,当酸度达到6.0 g/100 mL,对醋液进行过滤,得到甘蔗醋。所得甘蔗汁、甘蔗酒和甘蔗醋作为后续实验样品,抗坏血酸(100 mg/L)作为后续实验对照组。
1.3.2 抗氧化活性的测定
1.3.2.1 总酚含量的测定
采用Folin-酚法,以没食子酸为标准品[10-11]。分别取0、1.0、2.0、3.0、4.0、5.0、6.0 mL 0.02 mg/mL的没食子酸标准溶液,依次加入Folin-酚试剂1.0 mL和7.5 g/100 mL的碳酸钠溶液3.0 mL,用蒸馏水定容至10 mL,摇匀,显色2 h,在765 nm波长处测定吸光度。得线性回归方程:y=108.196x+0.019(R2=0.999 8)。
1.3.2.2 总黄酮含量的测定
采用亚硝酸钠-硝酸铝-氢氧化钠比色法,以芦丁为标准品。参考文献[12-13],略有改动:分别取0、2.0、4.0、6.0、8.0、10.0 mL 0.1 mg/mL的芦丁标准溶液,用70%的乙醇溶液补到10mL,加入5 g/100 mLNaNO2溶液0.8 mL混合均匀,放置6 min,然后加入10 g/100 mL的Al(NO3)3溶液0.8 mL混合均匀,放置6 min,最后加入4 g/100 mL的NaOH溶液10 mL,以蒸馏水定容至25 mL,放置15 min,在510 nm波长处测定吸光度。得线性回归方程:y=14.093x+0.004(R2=0.999 7)。
1.3.2.3 DPPH自由基清除能力的测定
[14]的测定方法,修改如下:准确移取0.06 mmol/L的DPPH乙醇溶液5 mL,分别加入0.6 mL含有体积分数为5%、10%、15%、20%、25%、30%、35%、40%、45%、50%的样品水溶液,混匀,室温避光反应30 min,4 ℃、3 500 r/min条件下离心10 min取上清液,517 nm波长处测定吸光度(Ai),同时将5 mL DPPH乙醇溶液和0.6 mL无水乙醇混匀按上述方法测定吸光度(Ac),以及5 mL无水乙醇溶液和0.6 mL样品水溶液混匀按上述方法测定吸光度(Aj),根据下式计算DPPH自由基清除率。

1.3.2.4 ·OH清除能力的测定
Fenton反应中H2O2与Fe2+混合可产生·OH,当体系中存在水杨酸时能够有效俘获·OH并产生红色产物,此物质在510 nm波长处有最大吸光度。根据文献[15-16]的测定方法略有改动:依次向试管中加入0.5 mL 0.15 mol/L FeSO4溶液,2 mL的2 mmol/L水杨酸钠溶液,2.5 mL蒸馏水和1 mL体积分数为5%、10%、15%、20%、25%、30%、35%、40%、45%、50%的样品水溶液,最后加入1 mL 6 mmol/L的H2O2溶液启动反应,37 ℃下反应1 h,4 ℃、3 500 r/min条件下离心10 min取上清液,510 nm波长处测定吸光度(Ai),加入1 mL蒸馏水作为空白对照,按上述方法测定吸光度(Ac),用蒸馏水替代上述试剂和1 mL不同质量分数的样品,按上述方法测定吸光度(Aj)。

1.3.2.5 总还原能力的测定
参考Oyaizu[17]的方法进行测定,修改如下:分别取含有体积分数为5%、10%、15%、20%、25%、30%的样品水溶液1 mL,依次加入2.5 mL 0.2 mol/L pH 6.6的磷酸缓冲液,混匀。再加入2.5 mL 1 g/100 mL的铁氰化钾溶液。混合物于50 ℃恒温水浴20 min后取出,流水冷却,加入1 mL 10 g/100 mL的三氯乙酸终止反应。4 ℃、3 500 r/min条件下离心10 min取上清液2.5 mL,加蒸馏水2.5 mL以及0.5 mL 0.1 g/100 mL 的三氯化铁溶液,摇匀,静置5 min,于700 nm波长处测定吸光度。
1.3.3 模拟人体肠胃环境
1.3.3.1 模拟人体胃环境
根据文献[18-20]的测定方法,修改如下:将6.0 g胃蛋白酶溶于540 mL水中,加盐酸调节pH值至1.2,再加入2.0 g NaCl,将溶液稀释至600 mL,使其质量浓度为1 g/100 mL,将甘蔗醋阶段产物样液按体积分数40%加入到模拟胃环境的胃液中,避光于37 ℃、130 r/min摇床中水浴70 min(此转速模拟体内胃蠕动),迅速冷冻,即得被测样液。分析时将样液经过常温解冻,进行指标测定。
1.3.3.2 模拟人体十二指肠环境
模拟胃环境中,KH2PO4质量浓度为0.68 g/100 mL、NaHCO3质量浓度为8.5 g/100mL,然后用4 mol/L的NaOH调节pH值至6.8,最后按照1 g/100 mL的质量浓度分别加入胰蛋白酶和脂肪酶,充分溶解。37 ℃、45 r/min避光条件下摇床水浴120 min,迅速冷冻,即得被测样液。分析时将样液常温解冻,以上述相同浓度的胃液和肠液作为空白对照,进行指标测定。
1.4 数据处理
运用Origin 7.5软件作图,进行线性分析;通过SPSS Statistics 22对数据进行差异显著性分析,P<0.01为差异极显著。
2 结果与分析
2.1 甘蔗醋酿造过程中总酚和黄酮含量的变化
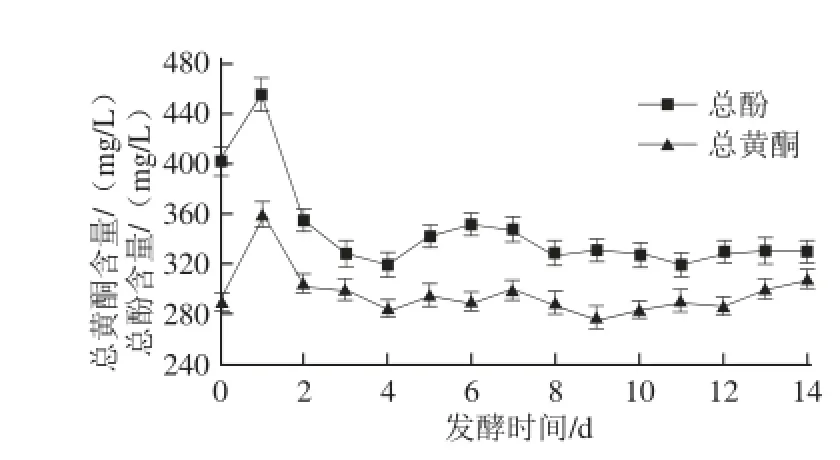
图1 甘蔗醋发酵阶段总酚和黄酮含量的变化情况Fig. 1 Changes in the contents of total polyphenols and total fl avonoids during the fermentation of sugar cane vinegar
由图1可知,总酚和总黄酮含量在甘蔗醋酒精发酵阶段(1~7 d)呈现先升高后降低,再缓慢上升的趋势。发酵前总酚和总黄酮含量分别为402、290 mg/L,发酵第1天结束时含量分别达到456、360 mg/L,之后含量开始逐渐降低,原因很可能是发酵前期酵母活力较强,发酵产生大量乙醇对总酚和总黄酮起到提取作用所致[21]。酒精发酵阶段前后比较,总酚含量减少,总黄酮含量相对上升,可能原因是在发酵过程中甘蔗汁中部分酚类物质如单宁、原花青素、花色苷等物质被部分氧化或被降解,转变为黄酮类物质或其他物质所致[22-23];总酚和总黄酮含量在醋酸发酵阶段(7~14 d)呈现波动状态,这与醋酸发酵过程中的氧化以及水解作用有关[24]。
2.2 不同阶段产物在体外的抗氧化活性
2.2.1 清除DPPH自由基的能力
DPPH自由基是一种稳定的、以氮为中心的自由基,如果受试物能将其清除,则意味着受试物具有降低烷自由基或过氧化自由基的能力,同时具有能打断脂质过氧化链反应的作用。酚类物质(ArOH)清除DPPH自由基存在2种机制:1)直接提供酚的氢离子给DPPH自由基(即H原子转移反应);2)从酚(ArOH)或其酚阴离子(ArO·)转移电子到DPPH自由基(即电子转移反应)。一般在非极性溶液中氢原子转移反应机制占优越性,但在极性溶液中,如乙醇、甲醇,DPPH自由基能和酚(ArOH)形成较强的氢键,从而电子转移反应机制占主要,二者也可同时发生[25]。由图2可知,3 种物质均具有极强清除DPPH自由基的能力,甘蔗汁、甘蔗酒、甘蔗醋对DPPH自由基的清除能力(IC50)分别为:10.70%、11.01%、12.34%。可以认为酚类物质含量及反应机制的差异影响了三者的清除能力。

图2 不同甘蔗醋发酵阶段样品对DPPH自由基的清除作用Fig. 2 DPPH radical scavenging capacity of fermented products at different fermentation stages
2.2.2 清除·OH的能力

图3 不同甘蔗醋发酵阶段样品对·OH的清除作用Fig. 3 Hydroxyl radical scavenging capacity of fermented products at different fermentation stages
由图3可知,甘蔗汁、甘蔗酒、甘蔗醋、100 mg/L抗坏血酸对·OH的清除作用基本成线性增强关系,但清除能力差异较为明显。当样品体积分数为50%时,甘蔗汁、甘蔗酒、甘蔗醋对·OH清除率分别为:69.28%、93.21%、84.40%。3 种甘蔗样品对·OH的清除能力依次为:甘蔗酒>甘蔗醋>甘蔗汁。甘蔗酒和甘蔗醋均具有较强·OH清除能力,特别是甘蔗酒在较低体积分数下仍然具有较好的清除能力。酒精和醋酸发酵阶段,酒精和有机酸的作用有利于多聚体酚类物质(如单宁)降解、黄酮类物质的浸出,使得整个发酵过程中黄酮类物质含量呈现上升趋势,可能影响了甘蔗酒和甘蔗醋对·OH的清除能力。
2.2.3 总还原能力
一种物质具有较强还原能力时能够将Fe3+转化为Fe2+,从而使还原能力测定体系中普鲁士蓝的量增加,导致样液在700 nm波长处吸光度增大。一般而言,反应体系在700 nm处吸光度越大,说明样液还原能力越强,即抗氧化能力越好。由图4可知,虽然甘蔗汁、甘蔗酒、甘蔗醋中多酚和黄酮含量存在差异,但三者总还原能力相当,且均具有较好的还原能力,说明甘蔗醋阶段产物的总还原能力是由多种因素决定,与多酚、黄酮、还原糖以及有机酸等的协同作用具有较大关系[26]。

图4 不同甘蔗醋发酵阶段样品的总还原能力Fig. 4 Total reducing power of fermented products at different fermentation stages
2.3 模拟人体肠胃环境下不同阶段产物的抗氧化活性2.3.1 模拟人体肠胃环境下不同阶段产物中总酚和总黄酮含量的变化

表1 在不同环境下甘蔗醋发酵阶段样品总酚和总黄酮的含量(x ±s,n=3)3Table 1 Changes in total polyphenols and total fl avonoids contents of sugarcane juice, wine and vinegar in different environments (x ±ss, , n = 3) = 3) mg/L
由表1可知,经过模拟人体肠胃环境相对于体外水溶液环境,甘蔗汁、甘蔗酒和甘蔗醋中总酚和黄酮含量均极显著下降(P<0.01),说明胃肠道消化对食物活性成分和抗氧化性具有显著的影响,同时也表明,通过体外化学法测定的结果,并不能直接说明食物在人体内经消化吸收后也能发挥相同的功效。
3种甘蔗醋发酵阶段样品经过模拟胃液环境后总酚和总黄酮含量下降较大,再经过模拟肠液环境时总酚和总黄酮含量又有所回升。植物多酚含有多种活性基团,容易发生氧化反应、水解反应、酚醛缩合和曼尼希等反应,多酚在酸性溶液或无机盐溶液中不稳定,容易水解成多酚苷元或盐析而形成浑浊物。Argyri等[27]研究了模拟消化以及铁、抗坏血酸、肉、酪蛋白等对红酒中总酚及抗氧化能力的影响,发现模拟消化后红酒中酚类含量显著下降。另外,他们还发现铁和蛋白质与红酒中的酚类物质发生交互作用,并导致红酒抗氧化能力下降。结合本实验结果,说明食物在人体肠胃消化过程中的抗氧化活性不仅受食物基质中成分的影响,而且受肠胃环境中分泌的各种蛋白酶液、磷酸盐以及环境pH值等因素的影响。
2.3.2 模拟人体肠胃环境下不同甘蔗醋发酵阶段样品清除DPPH自由基、清除·OH以及总还原能力变化情况

图5 模拟人体肠胃环境下不同甘蔗醋发酵阶段样品DPPH自由基清除率(a)、a·OH清除率(b)和总还原能力(c)cFig. 5 DPPH radical scavenging capacity (a), hydroxyl radical scavenging capacity (b) and total reducing power (c) of fermented products at different fermentation stages
由图5a可知,3种甘蔗醋发酵阶段样品在模拟人体肠胃环境下仍然具有较强的清除DPPH自由基能力,其中在模拟胃液环境下清除DPPH自由基能力最强。虽然多酚和黄酮在胃液中胃蛋白酶和盐酸的消化作用下含量大幅下降,但同时发生了某些化学反应(类似如多酚和黄酮水解为苷元、多酚蛋白络合物酶解),影响了酚类清除DPPH自由基的能力。由图5b可知,3种甘蔗醋发酵阶段样品在不同环境下清除·OH能力差别较大,其中在水溶液环境和肠液环境下三者清除·OH能力较强,在胃液环境清除能力较差。这一方面与总酚和黄酮含量的大量减少有关,另一方面可能在胃液低pH值环境下,高浓度H+影响了Fenton反应体系中Fe2+和Fe3+的络合平衡体系,影响了产生·OH反应的启动,对测定结果具有一定影响[28]。在肠液环 境下5 组(包括空白对照组)都具有较强的清除·OH自由基能力,分析原因可能和肠液中较高浓度的磷酸缓冲盐对·OH的捕获有关[29-30]。由图5c可知,3种甘蔗醋发酵阶段样品在不同环境下总还原能力变化不大,从图中可知不同环境下总还原能力依次为:水溶液环境>模拟肠液环境>模拟胃液环境。甘蔗汁、甘蔗酒和甘蔗醋的总还原能力是由多种因素决定的,人体肠胃环境对其具有一定的影响。
3 结 论
甘蔗汁含有丰富的多酚和黄酮类物质,在微生物发酵过程中多酚受环境和菌体影响,被部分氧化或降解,导致含量下降明显,而黄酮含量略有上升,可能与发酵过程中黄酮类物质的浸出以及酚类向黄酮类的转化有关。在体外抗氧化活性研究中,甘蔗汁、甘蔗酒及甘蔗醋均具有较强清除DPPH自由基能力、清除·OH能力以及总还原能力;模拟研究表明,在人体肠胃环境中低pH值或高盐环境影响下,多酚和黄酮类物质容易水解成苷元或盐析而形成浑浊物,导致消化过程中多酚和黄酮含量发生了较大的差异。本研究发现,甘蔗汁、甘蔗酒及甘蔗醋在肠胃环境下清除DPPH自由基和·OH能力与体外水溶液环境相比差异较大,该差异与总酚和黄酮含量相关性不明显。分析原因,一方面与肠胃环境对抗氧化物质的消化作用有关,另一方面与肠胃环境本身具有一定的抗氧化能力有关。结合模拟实验表明,食物在消化道中的抗氧化活性不仅受其本身所含抗氧化物质的影响,而且受消化液中pH值、蛋白酶、磷酸盐等多种生理因素的影响,该影响是一个较为复杂的过程,还有待更深入的研究。
总体来说甘蔗汁、甘蔗酒及甘蔗醋在体外及模拟人体肠胃环境下均具有较强的抗氧化能力,是较好的天然抗氧化剂。传统制糖工业只利用了甘蔗汁中主要的糖分,产品附加值较低,然而考虑到甘蔗汁中丰富的营养成分和较强的抗氧化能力,利用微生物发酵法将新鲜浓缩后的甘蔗汁酿制成风味独特的营养型甘蔗酒和甘蔗醋饮品,这对热带或亚热带国家甘蔗产业转型升级具有重要意义。
参考文献:
[1] ASIKIN Y, TAKAHASHI M, MISHIMA T, et al. Antioxidant activity of sugarcane molasses against 2,2’-azobis (2-amidinopropane) dihydrochloride-induced peroxyl radicals[J]. Food Chemistry, 2013, 141(1): 466-472. DOI:10.1016/j.foodchem.2013.03.045.
[2] 黄美娥, 高中松, 张羽, 等. 白茅根-甘蔗饮料的研制[J]. 食品与发酵工业, 2006, 32(2): 141-143. DOI:10.3321/j.issn:0253-990X.2006.02.038.
[3] DUARTE-ALMEIDA J M, SALATINO A, GENOVESE M I, et al. Phenolic composition and antioxidant activity of culms and sugarcane (Saccharum officinarum L.) products[J]. Food Chemistry, 2011, 125(2): 660-664. DOI:10.1016/j.foodchem.2010.09.059.
[4] TAKARA K, OTSUKA K, WADA K, et al. 1, 1-Diphenyl-2-picrylhydrazyl radical scavenging activity and tyrosinase inhibitory effects of constituents of sugarcane molasses[J]. Bioscience, Biotechnology, and Biochemistry, 2007, 71(1): 183-191. DOI:10.1271/ bbb.60432.
[5] WANG B S, CHANG L W, KANG Z C, et al. Inhibitory effects of molasses on mutation and nitric oxide production[J]. Food Chemistry, 2011, 126(3): 1102-1107. DOI:10.1016/j.foodchem.2010.11.139.
[6] SCALBERT A, WILLIAMSON G. Dietary intake and bioavailability of polyphenols[J]. The Journal of Nutrition, 2000, 130(Suppl 8): 2073-2085.
[7] ROMAGNOLO D F, SELMIN O I. Flavonoids and cancer prevention: a review of the evidence[J]. Journal of Nutrition in Gerontology and Geriatrics, 2012, 31(3): 206-238. DOI:10.1080/21551197.2012.702534.
[8] BOUAYED J, HOFFMANN L, BOHN T. Total phenolics, fl avonoids, anthocyanins and antioxidant activity following simulated gastrointestinal digestion and dialysis of apple varieties: bioaccessibility and potential uptake[J]. Food Chemistry, 2011, 128(1): 14-21. DOI:10.1016/j.foodchem.2011.02.052.
[9] 赵旭. 体外模拟消化对小麦和大米抗氧化活性和抗细胞增殖作用影响的研究[D]. 广州: 华南理工大学, 2013: 31-32.
[10] VELIOGLU Y S, MAZZA G, GAO L, et al. Antioxidant activity and total phenolics in selected fruits, vegetables, and grain products[J]. Journal of Agricultural and Food Chemistry, 1998, 46(10): 4113-4117. DOI:10.1021/jf9801973.
[11] 孙莹莹, 刘建书, 李志西, 等. 葡萄醋抗氧化活性比较研究[J]. 食品科学, 2013, 34(5):120-123.
[12] ZHISHEN J, MENGCHENG T, JIANMING W. The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals[J]. Food Chemistry, 1999, 64(4): 555-559. DOI:10.1016/S0308-8146(98)00102-2.
[13] 化志秀, 芦艳, 鲁周民, 等. 红枣醋发酵阶段主要成分及抗氧化性的变化[J]. 中国食品学报, 2013(8): 248-253.
[14] SUM S, CHIEN P J. Antioxidant activity, anthocyanins, and phenolics of rabbiteye blueberry (Vaccinium ashei) fl uid products as affected by fermentation[J]. Food Chemistry, 2007, 104(1): 182-187. DOI:10.1016/j.foodchem.2005.05.023.
[15] LIN S H, LO C C. Fenton process for treatment of desizing waste water[J]. Water Research, 1997, 31(8): 2050-2056. DOI:10.1016/ S0043-1354(97)00024-9.
[16] 谢思芸, 钟瑞敏, 肖仔君, 等. 杨梅果醋体外抗氧化活性的研究[J]. 食品与机械, 2012, 28(6): 125-128. DOI:10.3969/ j.issn.1003-5788.2012.06.031.
[17] OYAIZU M. Studies on products of browning reaction-antioxidative activities of products of browning reaction prepared from glucosamine[J]. The Japanese Society of Nutrition and Dietetics, 1986, 44(6): 307-315. DOI:10.5264/eiyogakuzashi.44.307.
[18] 郑影, 何玉龙, 郑洪亮, 等. 蓝莓花色苷体外及模拟人体胃肠环境的抗氧化活性研究[J]. 食品与生物技术学报, 2014, 33(7): 736-742.
[19] MCDOUGALL G J, FYFFE S, DOBSON P, et al. Anthocyanins from red cabbage–stability to simulated gastrointestinal digestion[J]. Phytochemistry, 2007, 68(9): 1285-1294. DOI:10.1016/ j.phytochem.2007.02.004.
[20] MCDOUGALL G J, DOBSON P, SMITH P, et al. Assessing potential bioavailability of raspberry anthocyanins using an in vitro digestion system[J]. Journal of Agricultural and Food Chemistry, 2005, 53(15): 5896-5904. DOI:10.1021/jf050131p.
[21] BALÍK J. Dynamics of changes in total anthocyanins during the fermentative maceration of grapes[J]. Horticultural Science (Prague), 2006, 33(3): 103-107.
[22] MORATA A, GÓMEZ-CORDOVÉS M C, COLOMO B, et al. Cell wall anthocyanin adsorption by different Saccharomyces strains during the fermentation of Vitis vinifera L. cv Graciano grapes[J]. European Food Research and Technology, 2005, 220(3/4): 341-346. DOI:10.1007/s00217-004-1053-8.
[23] ROMERO-CASCALES I, FERNÁNDEZ-FERNÁNDEZ J I, LÓPEZROCA J M, et al. The maceration process during winemaking extraction of anthocyanins from grape skins into wine[J]. European Food Research and Technology, 2005, 221(1/2): 163-167. DOI:10.1007/s00217-005-1144-1.
[24] 黄晓杰, 柴哲, 杨钟燕, 等. 蓝莓酒发酵过程中抗氧化物质变化规律研究[J]. 食品工业科技, 2013, 34(17): 103-105.
[25] FOTI M C, DAQUINO C, GERACI C. Electron-transfer reaction of cinnamic acids and their methyl esters with the DPPH radical in alcoholic solutions[J]. The Journal of Organic Chemistry, 2004, 69(7): 2309-2314. DOI:10.1021/jo035758q.
[26] 孙璐宏, 鲁周民, 包蓉, 等. 柿果醋酿造过程中抗氧化性能的变化[J].食品科学, 2011, 32(19): 37-41.
[27] ARGYRI K, KOMAITIS M, KAPSOKEFALOU M. Iron decreases the antioxidant capacity of red wine under conditions of in vitro digestion[J]. Food Chemistry, 2006, 96(2): 281-289. DOI:10.1016/ j.foodchem.2005.02.035.
[28] CHEN C, XIE B, REN Y, et al. The mechanisms of affecting factors in treating wastewater by Fenton reagent[J]. Chinese Journal of Environmental Science, 2000, 21(3): 93-96.
[29] 陈健, 欧阳玥, 闫静, 等. 磷酸盐缓冲溶液对邻二氮菲-Fe2+氧化法测定羟基自由基的影响[J]. 分子科学学报, 2012, 28(4): 350-352.
[30] 杨德敏, 袁建梅, 夏宏. 羟基自由基抑制剂对臭氧氧化降解苯酚的影响[J]. 化工环保, 2014, 34(1): 24-27. DOI:10.3969/ j.issn.1006-1878.2014.01.006.
Antioxidant Activity of Sugarcane Vinegar and Intermediate Products in Vitro and under Simulated Human Gastrointestinal Conditions
ZHENG Ping1, WU Youru1, YANG Jiwei1, ZOU Yi2, WANG Zaiqian3, LI Nan1,*
(1. College of Life Science and Technology, Guangxi University, Nanning 530004, China; 2. Center for Sugar Technology Research, Guangxi University, Nanning 530004, China; 3. Guangxi Haimingwei Brewing Co. Ltd., Laibin 546500, China)
Sugarcane contains abundant polyphenols and flavonoids. In the present study, total polyphenols content, fl avonoids content, 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging capacity, hydroxyl radical scavenging capacity and total reducing power were used as the indicators to evaluate the antioxidant activity of sugarcane juice, and the corresponding wine and vinegar in vitro and after simulated human gastrointestinal digestion. Results showed that at the alcohol fermentation alcohol extractable polyphenols and fl avonoids were detected. At the acetic acid fermentation stage, the contents of polyphenols and fl avonoids presented some volatility. This may be related to the occurrence of oxidation and hydrolysis during the fermentation process. The sugar cane vinegar possessed strong DPPH radical scavenging capacity in vitro, and the sugarcane wine had strong hydroxyl radical scavenging capacity. A series of reactions of polyphenols and fl avonoids after simulated gastrointestinal digestion took place, and as a result, the contents of both compounds dropped very signifi cantly (P < 0.01) in simulated gastric environment, but increased slightly in simulated intestinal environment. The antioxidant activity of the beverages in the human gastrointestinal environment is infl uenced not only by their antioxidant substances, but also by pH, protease, phosphate and other physiological factors in the digestive juice.
sugarcane juice; sugarcane wine; sugarcane vinegar; polyphenols; flavonoids; simulated gastrointestinal environment; antioxidant activity
10.7506/spkx1002-6630-201611043
TS262.7
A
1002-6630(2016)11-0242-06
郑平, 吴幼茹, 杨继伟, 等. 甘蔗醋发酵产物在体外及模拟人体肠胃环境中的抗氧化活性[J]. 食品科学, 2016, 37(11): 242-247. DOI:10.7506/spkx1002-6630-201611043. http://www.spkx.net.cn
ZHENG Ping, WU Youru, YANG Jiwei, et al. Antioxidant activity of sugarcane vinegar and intermediate products in vitro and under simulated human gastrointestinal conditions[J]. Food Science, 2016, 37(11): 242-247. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611043. http://www.spkx.net.cn
2015-08-16
朗姆酒(RUM)生产工艺技术研究项目(桂工信投资[2013] 258)
郑平(1989—),男,硕士研究生,研究方向为甘蔗汁、糖蜜食品发酵与利用。E-mail:734439146@qq.com
*通信作者:李楠(1969—),男,副教授,博士,研究方向为食品微生物学及发酵工程。E-mail:linan97690612@163.com

