婴儿利什曼原虫细胞免疫优势抗原预测
敬昊东,敬保迁
(川北医学院免疫学与分子生物学研究所,四川 南充 637000)
婴儿利什曼原虫细胞免疫优势抗原预测
敬昊东,敬保迁
(川北医学院免疫学与分子生物学研究所,四川 南充637000)
目的:预测婴儿利什曼原虫全基因组编码蛋白中刺激细胞免疫应答的优势抗原。方法:以计算机软件NetCTLpan对婴儿利什曼原虫基因组编码蛋白进行分析,确定与各类人HLA I类分子超型强结合抗原蛋白,综合预测细胞免疫优势抗原。结果:84个婴儿利什曼原虫基因组编码蛋白可与人HLA A2超型强结合,其中13个蛋白质还可与人HLA A1、A3、A26、B44、B7、B8、B58、B62、B39及B27超型强结合,它们大多数为膜蛋白,具有种属特异性。结论:预测婴儿利什曼原虫优势抗原可为发展抗内脏利什曼病疫苗提供新的视角。
婴儿利什曼原虫;免疫优势抗原;疫苗;免疫组学
内脏利什曼病主要由婴儿利什曼原虫与杜氏利什曼原虫引起,目前全世界每年新发病例约50万,我国新疆、甘肃、四川地区内脏利什曼病流行严重[1-2]。由于利什曼原虫感染宿主呈多样性,传播媒介具有复杂性,抗利什曼病药物品种少、疗效差、毒副作用严重,发展疫苗是控制利什曼病的根本方法[3]。先前许多有关内脏利什曼病候选疫苗抗原的研究均是选择单个抗原分子对实验动物免疫保护试验来进行,所获得的候选疫苗分子对人的免疫保护较弱,至今仍未研制出应用于现场的抗内脏利什曼病疫苗[4]。鉴于婴儿利什曼原虫全基因组DNA序列测定及基因注释已完成,总共含8 241个基因[5]。随着免疫信息学的发展,有关MHC分子结合肽相关实验数据积累增多,使用生物信息学方法可较准确地预测MHC分子结合表位,
从而判断病原体刺激机体细胞免疫和体液免疫应答的相关抗原蛋白。本研究立足人体免疫系统,采用计算机软件NetCTLpan,从婴儿利什曼原虫全基因组编码蛋白质中预测刺激细胞免疫应答优势抗原,其目的是为发现抗人内脏利什曼病候选疫苗分子提供新的视角。
1 数据库和方法
1.1数据库
为2015年6月更新的婴儿利什曼原虫JPCM5株基因组注释蛋白序列库(TriTrypDB-9.0_LinfantumJPCM5_AnnotatedProteins.fasta ),共计8 241个蛋白。
1.2计算机软件
采用丹麦技术大学MHC结合肽预测服务器中NetCTL 1.2版软件(http://www.cbs.dtu.dk/services/NetCTL/)[6]与NetCTLpan 1.1版软件(http://www.cbs.dtu.dk/services/NetCTLpan/)[7]。蛋白质亚细胞定位软件为WoLF PSORT(http://www.genscript.com/wolf-psort.html)[8]。蛋白质相似性检索采用软件BLASTP(http://blast.ncbi.nlm.nih.gov/Blast.cgi)。
1.3方法
1.3.1基于HLAA2超型筛选婴儿利什曼原虫细胞免疫优势抗原 从Gene DB库中下载婴儿利什曼原虫JPCM株9.0版本基因组注释蛋白序列库,分批将各注释蛋白上传至丹麦技术大学MHC结合肽预测服务器NetCTL 1.2(http://www.cbs.dtu.dk/services/NetCTL/)进行运算。MHC超型设定为A2,将C末端切割权重设定为默认值0.15,TAP转运效率权重设定为默认值0.05,表位识别阈值设定为默认值0.75。若目标蛋白肽链长度≥400 aa,A2超型强结合表位的频度大于或等于2/100aa者,则认定为A2超型强结合抗原蛋白。若目标蛋白肽链长度<40 0 aa,A2超型强结合表位的频度大于或等于3/100 aa者,则认定为A2超型强结合抗原蛋白。
1.3.2基于其它HLAI类分子超型筛选婴儿利什曼原虫细胞免疫优势抗原 将上述筛选的与HLA A2超型强结合婴儿利什曼原虫蛋白,逐个上传至丹麦技术大学MHC结合肽预测NetCTLpan 1.1服务器(http://www.cbs.dtu.dk/services/NetCTLpan/)进行运算。HLA超型分别设定为A1、A3、A26、B44、B7、B8、B58、B39、B27及B62,肽长度设定为9 mer,C末端切割权重设定为默认值0.225,TAP转运效率权重设定为默认值0.025,表位识别阈值设定为默认值1.0。若各目标蛋白含有上述所有HLA超型强结合表位,则认定为细胞免疫优势抗原。
1.3.3婴儿利什曼原虫细胞免疫优势抗原的特异性与表达定位登录蛋白质相似性检索软件BLASTP服务器(http://blast.ncbi.nlm.nih.gov/Blast.cgi)与蛋白质亚细胞定位软件WoLF PSORT服务器(http://www.genscript.com/wolf-psort.html),分别将上述筛选的各婴儿利什曼原虫细胞免疫优势抗原蛋白的氨基酸序列发送至服务器,分别推测上述各婴儿利什曼原虫细胞免疫优势抗原的种属特异性和亚细胞定位。
2 结果
2.1婴儿利什曼原虫基因组编码蛋白中与HLA A2超型强结合抗原
婴儿利什曼原虫JPCM株基因组编码的8,241个蛋白质经NetCTL 1.2计算机软件分别分析各蛋白质所含HLA A2超型强结合表位数,发现有166个编码蛋白质含有A2超型强结合表位的频度大于2个/100 aa,剔除重复基因及序列高度相似的家族基因等,84个编码蛋白被认定为A2超型强结合的抗原蛋白质(表1)。其中,蛋白肽链氨基酸小于400 aa的A2超型强结合蛋白质有24个,蛋白肽链氨基酸大于或等于400aa的A2超型强结合蛋白质有56个。在肽链长度小于400 aa的A2超型强结合蛋白质中,以无鞭毛体素样蛋白(LinJ.08.0700|amastin-like protein)含A2超型强结合表位的频度最高,平均每100 aa长的肽链中含有7个超型A2强结合表位;另外,脂肪酸延长酶(LinJ.14.0760|fatty acid elongase)假定蛋白(LinJ.29.0970| hypothetical protein, conserved)、假定蛋白(LinJ.23.1830| hypothetical protein)、假定蛋白(LinJ.36.3110| hypothetical protein)、假定蛋白(LinJ.36.3110| hypothetical protein)、假定蛋白(LinJ.16.0510| hypothetical protein)等,平均100aa的肽链中含5~6个A2超型强结合表位。在肽链长度大于或等于400 aa的A2超型强结合蛋白质中,以(LinJ.35.5320| amino acid permease)含A2超型强结合表位的频度最高,平均每100 aa长的肽链中含有5.61个A2超型强结合表位,另乙醇胺磷酸转移酶(LinJ.18.0810|ethanolamine phosphotransferase)、甘油摄取蛋白(LinJ.35.2120| glycerol uptake protein)、假定蛋白(LinJ.33.1650| hypothetical protein)及假定蛋白(LinJ.29.0970| hypothetical protein)等,平均100 aa的肽链中含4~5个A2超型强结合表位,并且随着蛋白质分子量的增大,所含A2超型强结合表位的比例呈下降趋势。
2.2婴儿利什曼原虫基因组编码蛋白中与其它HLA I类分子超型结合的抗原
以NETMHCPAN计算机软件分别计算上述84个A2超型强结合婴儿利什曼原虫蛋白质序列含HLA A1、A3、A26、B44、B7、B8、B58、B39、B27及B62等10个超型的强结合表位,结果发现其中有13个蛋白质含有全部上述10个HLA I类分子超型强结合表位(表2),认定为婴儿利什曼原虫细胞免疫优势抗原蛋白。其中ATP结合盒蛋白超家族分子成员2(LinJ.11.1210 | ATP-binding cassette protein subfamily A,member 2)、保守性假定蛋白(LinJ.34.3020 | hypothetical protein)及保守性假定蛋白(LinJ.31.0040 | hypothetical protein),它们不仅含A2超型强结合表位的频度较高,平均100 aa的肽链所含A2超型强结合表位达4个,而且还含有全部其它10个HLA I类分子超型强结合表位,提示这些蛋白质用作抗利什曼病疫苗候选疫苗分子,不仅对最常见HLA I类分子超型—A2超型人群具有较好的细胞免疫刺激效应,而且对其它HLA I类分子超型人群亦有效。上述婴儿利什曼原虫细胞免疫优势抗原蛋白的肽链长度介于437~1 897 aa,而肽链长度小于400 aa的婴儿利什曼原虫A2超型强结合抗原蛋白其序列则缺乏某些HLA I类分子超型强结合表位,说明中小分子婴儿利什曼原虫A2超型强结合抗原蛋白不能激发某些HLA I类分子超型人群产生强的细胞免疫保护。
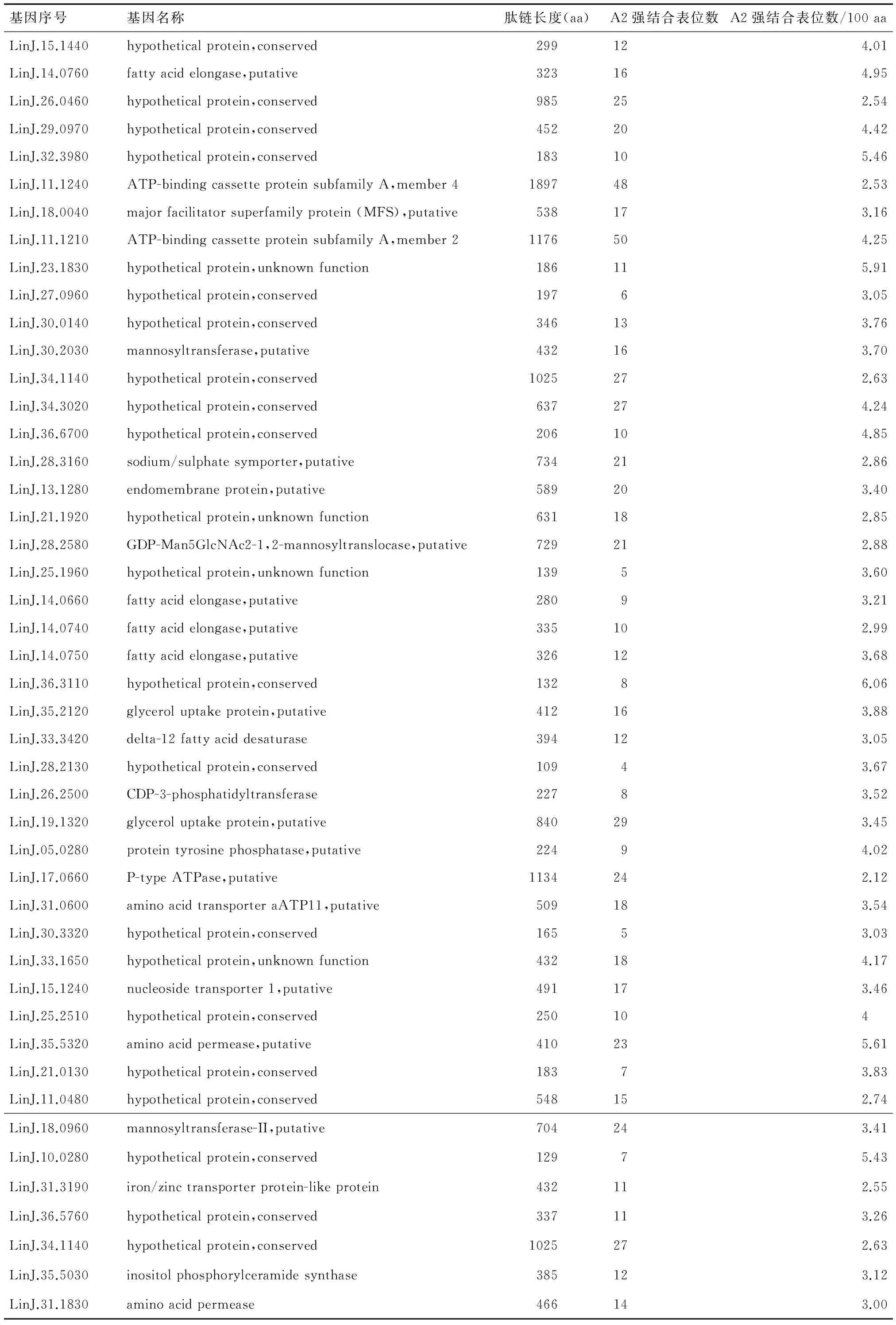
表1 婴儿利什曼原虫基因组编码蛋白中与HLA A2超型强结合抗原

表2 与HLA I类分子常见超型强结合的婴儿利什曼原虫基因组编码蛋白的强结合表位数
2.3婴儿利什曼原虫细胞免疫优势抗原蛋白的细胞定位与特异性
上述13个婴儿利什曼原虫细胞免疫优势抗原蛋白质经BLASTP检索及WoLF PSORT计算机软件分析,结果这些蛋白质均具有种属特异性,亚细胞定位于细胞膜。
3 讨论
利什曼原虫为细胞内感染病原体,病人痊愈后,可获得对相同种株再次感染的持续性免疫保护,保护免疫性质主要为细胞免疫[9]。说明利什曼原虫含有可刺激人产生保护性细胞免疫的抗原分子,成功研制出抗利什曼病疫苗可能性较大。
本研究采用计算生物学方法同时分析婴儿利什曼原虫整个基因组编码的8 241个蛋白质抗原对HLA I类分子间的结合性能,筛选婴儿利什曼原虫编码蛋白中可刺激人体细胞免疫的优势抗原。克服了先前许多学者随机选择单个抗原进行抗利什曼病候选疫苗分子研究的盲目性[10],也克服了其它规模性筛选技术如四聚体技术与TCR识别技术等不能识别隐蔽性表位的缺陷,也克服了免疫蛋白质组学等不能直接反应细胞免疫状况的局限性,使结果更加全面、贴切地反映婴儿利什曼原虫全基因组编码蛋白激发人细胞免疫状况。本研究以HLA I类分子来研究靶抗原激发细胞免疫特征,所获结果直接反映靶抗原激发人体细胞免疫应答状况,克服了以实验动物膜型反映人利什曼病感染免疫的差异性[11]。并且,本研究中不仅观测了婴儿利什曼原虫全基因组编码蛋白与人类最常见A2超型间的相互作用,而且也观测了婴儿利什曼原虫全基因组编码蛋白与其它HLA I类分子超型间的相互作用,综合筛选出的婴儿利什曼原虫细胞免疫优势抗原蛋白可激发绝大多数人群细胞免疫保护。
计算生物学研究获得可靠结果关键在于所采用的计算机软件及参数设置。先前Stober等观察101个随机选择的硕大利什曼原虫cDNA序列标签做成的DNA候选疫苗对Balb/c小鼠的免疫保护性,发现14个候选疫苗具有免疫保护性能,其中功能明确的仅有P型ATP酶(P-type ATPase)和无鞭毛体素样蛋白(amastin-like protein)等分子,其余10个均为假定蛋白编码基因,以MHC结合表位预测软件RANKPEP(http://mif.dfci.harvard.edu/Tools/rankpep.html)计算,上述14个具有免疫保护性能的抗原蛋白与其它无免疫保护性的硕大利什曼原虫抗原蛋白所含MHC结合表位数无明显差异,说明RANKPEP预测的准确性较差。而本研究所采用的预测软件NetCTL 1.2与NetMHCPAN,整合了蛋白酶体切割,TAP转运效率及MHC I类分子结合表位预测,优于其它如EpiJen,MAPPP, MHC-pathway和WAPP等CTL表位预测软件[6],本研究预测结果发现P-type ATPase和amastin-like protein及部分假定蛋白等存在大量HLA I类分子强结合表位,与Stober等的动物实验结果存在一致性。说明本研究采用的软件及所设参数较为准确[12]。
本研究筛选出的绝大多数婴儿利什曼原虫细胞免疫优势抗原蛋白在既往利什曼病感染免疫研究中均未曾认识,它们分子量较大,具有种属特异性,大多为膜型蛋白,说明免疫原性较好。深入认识这些抗原蛋白,对发展抗利什曼病疫苗极为有利[13]。
[1]余大为,丁国武,格鹏飞,等.2005-2014年甘肃省内脏利什曼病流行情况的回顾性分析[J] .中国寄生虫学与寄生虫病杂志,2015,33(3):208-211.
[2]伊斯拉音·乌斯曼,阿迪力·司马义,凯赛尔·克尤木,等.2014 年新疆伽师县内脏利什曼病暴发的调查分析[J].中国寄生虫学与寄生虫病杂志,2015,33(5):357-361.
[3]Chappuis F,Sundar S,Hailu A,etal.Visceral leishmaniasis:what are the needs for diagnosis,treatment and control[J]. Nat Rev Microbial,2007,5(11):873-882.
[4]Joshi S,Rawat N,Yadav NK,etal.Visceral leishmaniasis:advancements in vaccine development via classical and molecular approaches[J].Front Immunol,2014,5:380.doi:10.3389/f
[5]Peacock CS,Seeger K,Harris D,etal.Comparative genomic analysis of three Leishmania species that cause diverse human disease[J].Nat Genet,2007,39(7):839-847.
[6]Larsen MV,Lundegaard C,Lamberth K,etal.Large-scale validation of methods for cytotoxic T-lymphocyte epitope prediction[J].BMC Bioinformatics,2007,8:424.
[7]Stranzl T,Larsen MV,Lundegaard C,etal.NetCTLpan-Pan-specific MHC class I epitope predictions[J].Immunogenetics,2010,62(6):357-368.
[8]Horton P,Park KJ,Obayashi T,etal.WoLF PSORT:protein localization predictor[J].Nucleic Acids Res. 2007,35:W585-7.
[9]刘鹏,敬保迁.利什曼原虫减毒活疫苗研究进展[J].川北医学院学报,2015,30(5):590-594.
[10]Duthie MS,Raman VS,Piazza FM,etal.The development and clinical evaluation of second-generation leishmaniasis vaccines[J].Vaccine,2012,30(2):134-141.
[11]Kamhwi S,oliveiar F,Valenzuela JG.Using humans to make a human leishmaniasis vaccine[J].Sci Transl Med,2014,6(234):234fs8.
[12]Stober CB,Lange UG,Roberts MT,etal.From genome to vaccines for leishmaniasis:screening 100 novel vaccine candidates against murine Leishmania major infection[J].Vaccine,2006,24(14):2602-2616.
[13]Das S,Freier A,Boussoffara T,etal.Moduler multiantigen T cell epitope-enriched DNA vaccine against human leishmaniasis[J].Sci Transl Med,2014,6(234):234ra56.
(学术编辑:谢勇恩)
Prediction of Leishmania infantum immunodominant antigens
JING Hao-dong,JING Bao-qian
(InstituteofImmunologyandMolecularBiology,NorthSichuanMedicalCollege,Nanchong637000,Sichuan,China)
Objective:To predict the dominant antigen to stimulate human cellular immune responses in whole genome encoding proteins of Leishmania infantum.Methods:The whole genome encoding proteins of Leishmania infantum were analyzed with NetCTLpan computer software,and all kinds of HLA I molecules supertype strong binding protein antigen could be finalized,and the dominant antigens that stimulate human cellular immune responses be the comprehensively predicted.Results:84 Leishmania infantum genome encoding proteins could bind to human HLA A2 supertype compactly.Among these proteins,13 proteins could bind to human HLA A1,A3,A26,B44,B7,B8,B58,B62,B39 and B27 supertype,most proteins are species-specific proteins, and located in membrane.Conclusion:The dominant antigen prediction of Leishmania infantum provides a new insight to develop the vaccines against visceral leishmaniasis.
Leishmania infantum;Dominant antigen;Vaccine;Immunomics
10.3969/j.issn.1005-3697.2016.03.08
国家自然科学基金(30872234)
2016-04-01
敬昊东(1993-),男,川北医学院临床医学系2013级。通讯作者:敬保迁,E-mail:bqjing@nsmc.edu.cn
时间:2016-6-1617∶46
http://www.cnki.net/kcms/detail/51.1254.R.20160616.1746.016.html
1005-3697(2016)03-0310-06
R382.22
A

