中国人群中Hsp90AB1基因多态性和SLE发病的关联研究
谷园园,邹延峰,徐建华,胡华青,孙秀秀,陶金辉,徐胜前,刘 爽,王德光,刘盛秀,蔡 静,肖 会,陈佩玲,连 莉,宋亚平,梁春梅,王中新,黄海良,潘发明,苏 虹,潘海峰,叶冬青
◇临床医学研究◇
中国人群中Hsp90AB1基因多态性和SLE发病的关联研究
谷园园1,邹延峰1,徐建华2,胡华青3,孙秀秀1,陶金辉4,徐胜前2,刘 爽2,王德光5,刘盛秀6,蔡 静2,肖 会2,陈佩玲2,连 莉2,宋亚平1,梁春梅7,王中新8,黄海良9,潘发明1,苏 虹1,潘海峰1,叶冬青1
目的 探讨Hsp90AB1基因多态性与中国汉族人群系统性红斑狼疮(SLE)发病之间的关系。方法 对278例SLE患者和278例正常对照者采用病例对照研究。HapMap数据库和Haploview软件筛选出中国人群Hsp90AB1基因标签SNPs,采用Multiplex SNaPshot技术进行基因分型。运用SPSS 10.01软件进行统计分析。应用在线软件进行单倍型统计分析。结果 rs9367190位点的基因型(CC、CA、AA)的频率在SLE组与对照组分布差异无统计学意义(P>0.012 5),而等位基因C、A的频率在SLE组与对照组分布差异有统计学意义(P<0.012 5);采用显性模型(CC vs CA+AA:校正OR=0.649,95%CI:0.464~0.908,P=0.012)分析结果差异有统计学意义,但隐性模型分析结果差异无统计学意义(P>0.012 5)。而rs13296位点的基因型GG、GA、AA的频率以及其等位基因G、A频率在SLE组与对照组的分布均差异无统计学意义(P>0.0125);显性模型和隐性模型分析结果差异均无统计学意义(P>0.012 5)。单倍型A/G与SLE发病之间存在关联(OR=0.668,95%CI:0.512~0.871,P=0.003)。结论 在中国人群中Hsp90AB1基因多态性(rs9367190)可能和SLE发病关联。
Hsp90AB1;基因多态性;系统性红斑狼疮;易感性
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种自身免疫性疾病,临床特征表现为累及多器官脏器,病程迁延反复,且发病存在性别差异,男女比例约1∶>8。家族聚集性与同卵双生患病率高于异卵双生,说明遗传因素在SLE发病中起着重要作用。热休克蛋白90(heat shock protein 90,Hsp90)广泛存在于真核和原核细胞中,是细胞质内最活跃的分子伴侣。人类Hsp90以是否含有丰富的谷氨酰胺片段而分为Hsp90AA1和Hsp90AB1两类[1]。Hsp90AB1基因在SLE的发病中的作用是通过翻译调节Hsp90表达,Hsp90和白细胞介素6(interleukin-6,IL6)表达增加,能诱导B淋巴细胞分化为浆细胞,促进自身抗体产生;降低CD8+抑制性T细胞的活性;免疫球蛋白分泌增加[2]。此外,SLE的最常用药物是糖皮质激素类(glucocorticoids,GCs)药物,GCs与其受体结合的稳定性受Hsp90表达量的调控,Hsp90AB1基因也可能通过控制Hsp90的表达调节SLE疗效。该研究采用病例对照的方法首次探究Hsp90AB1基因多态性与SLE之间关联。
1 材料与方法
1.1 病例资料 本研究获得安徽医科大学伦理委员会审批通过,每个研究对象在接受调查前由研究员告知其本次研究内容,获患者本人同意并签字。SLE患者来源于安徽医科大学第一附属医院以及安徽医科大学第二附属医院,共278例SLE患者,其中女257例,男21例;年龄16~72(33.96±11.51)岁。所有确诊患者符合1997年美国风湿病学会(ACR)的SLE分类标准。同期随机选择年龄、性别、地区和民族与SLE患者相匹配的278例健康体检者作为正常对照,正常对照符合下列要求:①本人及其直系亲属均无自身免疫性疾病;②不具有SLE分类标准中的任何一条;③入选前1周无明显身体不适症状且无重大疾病史。正常对照中女257例,男21例;年龄15~71(34.31±9.54)岁。所有纳入对象无血缘关系。
1.2 标本的收集 由专业医护人员从SLE患者和正常对照者前臂采取静脉血5 ml用于SNP(single nucleotide polymorphism)分型:EDTA抗凝,离血浆和血细胞。DNA的提取:从外周白细胞中提取,使用Qiagen提取试剂盒,-80℃分装冻存。
1.3 SNP选择和检测方法 使用HapMap数据库(Chinese Han in Beijing,release No.24/phaseII Nov08,on NCBI B36 assembly)查询Hsp90AB1基因SNPs,共获得rs9367190、rs9381303、rs13296、rs11538975和rs5046975共5个SNPs。采用Haploview(4.0版)软件,通过Linkage Distance(LD)图对候选基因SNPs的筛选,共筛选出2个标签SNPs(tagger SNPs,与其余的3个SNPs有强的连锁相关性):rs9367190、rs13296。SNP分型采用Multiplex SNaPshot技术(美国应用生物公司ABI开发),利用连接反应的高特异性,获取不同长度高度多重(48~192)连接产物,并通过双连接反应扩大连接产物的长度范围,使用通用荧光引物扩增不同长度连接产物,对扩增后的产物进行荧光毛细管电泳,采用GeneMapper软件进行数据读取。SNP分型人员不知道研究对象分组情况。
1.4 统计学处理 采用SPSS 10.01软件进行分析,定量资料以±s进行描述,组间比较采用t检验;定性资料以例数和百分比表示,组间比较采用χ2检验。用直接计数法计算基因型和等位基因频率。显性模型和隐性模型使用Logistic回归分析(Y变量赋值:0=对照,1=病例;单因素分析)和多元Logistic回归分析(多因素分析,校正因素为年龄和性别)。Hardy-Weinberg(HWE)平衡采用χ2检验检测基因型频率分布。在线(http://analysis.bio-x. cn/)进行Haplotype分析,要求所有单倍型频率都不小于0.03。采用Bonferroni法校正后的检验水平α为P<0.012 5。
2 结果
2.1 研究对象的基本特征和HWE平衡结果 SLE组和对照组年龄和性别差异无统计学意义。见表1。SLE组和对照组的rs9367190和rs13296的基因型及等位基因的频率分布均满足HWE平衡。见表2。研究对象有群体代表性。
2.2 SLE组和对照组Hsp90AB1基因rs9367190位点基因型和等位基因的频率分布比较Hsp90AB1基因rs9367190位点CC、CA、AA基因型频率在SLE组和对照组分别为56.47%、38.13%、5.40%和45.68%、44.24%、10.08%,分布差异无统计学意义(P>0.012 5);等位基因C、A频率在SLE组和对照组分别为75.54%、24.46%和67.81%、32.19%,分布差异有统计学意义(P<0.012 5)。见表3。
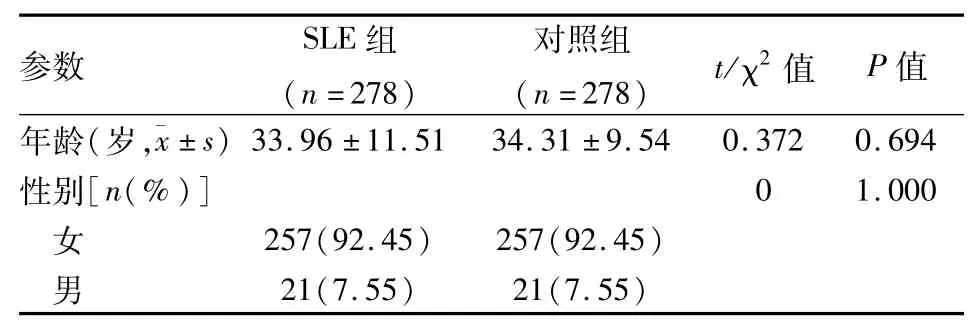
表1 SLE组和对照组的基本特征比较
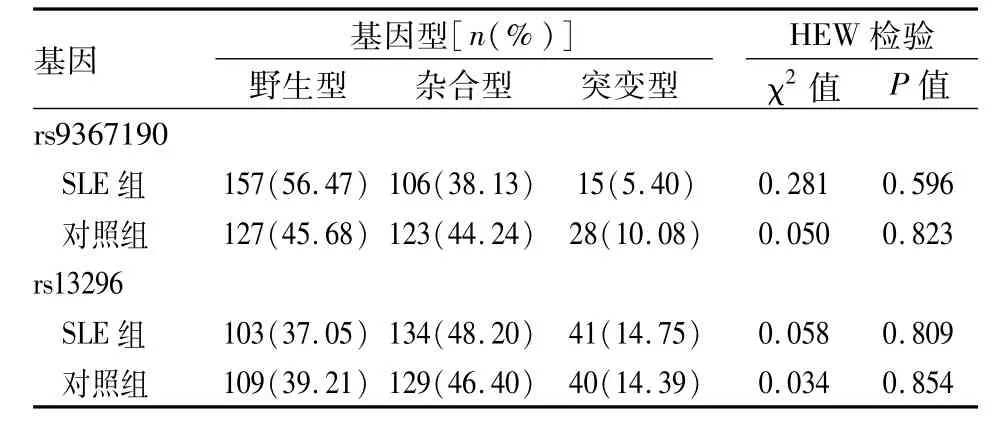
表2 HSP90AB1的多态性HWE平衡结果
2.3 SLE组和对照组Hsp90AB1基因rs13296位点基因型和等位基因的频率分布比较 Hsp90AB1基因rs13296位点GG、GA、AA基因型频率在SLE组和对照组分别为37.05%、48.20%、14.75%和39.21%、46.40%、14.39%,分布差异无统计学意义(P>0.012 5);等位基因G、A频率在SLE组和对照组分别为61.15%、38.85%和62.41%、37.59%,分布差异无统计学意义(P>0.012 5)。见表3。
2.4 Hsp90AB1基因rs9367190位点基因多态性与SLE发病关系 显性模型(CC vs CA+AA:粗OR= 0.648,95%CI:0.464~0.906,P=0.011)单因素Logistic回归分析统计分析显示rs9367190基因多态性与SLE发病存在关联,隐性模型(CC+CA vs AA:粗OR=0.509,95%CI:0.266~0.976,P=0.042)分析显示rs9367190基因多态性与SLE发病不存在关联。考虑到混杂因素年龄、性别可能对结果的影响,以年龄、性别为校正因素进行校正,校正后的显性模型分析结果仍存在关联(校正OR=0.649,95% CI:0.464~0.908,P=0.012),而隐性模型分析结果仍不存在关联(校正OR=0.509,95%CI:0.265~0.977,P=0.042)。见表4。结果表明rs9367190位点基因多态性与SLE发病存在一定的关联性,且rs9367190位点突变为SLE发病保护因素。
2.5 Hsp90AB1基因rs13296基因多态性与SLE发病之间的关系 显性模型(GG vs GA+AA:粗OR =1.096,95%CI:0.778~1.543,P=0.600);隐性模型(GG+GA vs AA:粗OR=1.029,95%CI:0.643~1.649,P=0.904)分析,rs13296基因多态性与SLE发病之间均无关联。以年龄、性别为校正因素进行校正,校正后的结果仍无关联(显性模型:校正OR =1.090,95%CI:0.773~1.538,P=0.623;隐性模型:校正OR=1.023,95%CI:0.638~1.640,P= 0.926)。见表4。结果表明rs13296位点基因多态性与SLE发病无关。

表3 SLE组和对照组Hsp90AB1基因rs9367190与rs13296基因型和等位基因的频率分布[n(%)]
2.6 Hsp90AB1基因2个SNP位点Haplotype分析 单倍型A/G与SLE发病之间存在关联(OR= 0.668,95%CI:0.512~0.871,P=0.003)。单倍型C/A(OR=1.045,95%CI:0.819~1.333,P= 0.723)和C/G(OR=1.367,95%CI:1.065~1.753,P=0.014)与SLE发病之间不存在关联。单倍型A/A在SLE组与对照组的频率分别为0.009和0.005,均小于0.03,未纳入Haplotype分析。见表5。
3 讨论
SLE是一种典型的自身免疫性病,主要的临床特征是血清中出现以抗核抗体为代表的多种自身抗体和多器官多系统累及,SLE患者发生感染最常受累的部位是呼吸道(肺部最常见),其次是皮肤及尿道、口腔黏膜等部位[3-4]。遗传因素和环境因素共同作用导致的免疫紊乱是SLE可能的发病原因。SLE发病的个体差异性和家族聚集性说明遗传因素是其发病的主要影响因素之一。近年来,利用全基因组关联研究(genome-wide association study,GWAS)技术,SLE的遗传学研究有了很大的进展,相继发现很多基因与SLE遗传易感性有关[5]。但由于GWAS本身亦存在一定局限性,导致其结果不能被很好重复,产生了很多假阳性和假阴性结果[6]。其局限性如研究之前不基于现有证据构建任何假设,不能严格按照环境因素(如年龄和性别)进行匹配,检验水平采用保守的Bonferroni法校正等。因此,可能还有很多SLE的易感基因并没有被发现。在我国,SLE的患病率较高且生存率不断增加,疾病痛苦和长期的诊疗费用对患者而言是一个相当大的疾病负担。因此,探讨SLE的可能致病机制是必要的,为SLE的早期诊断、治疗及预后监测提供依据。
Hsp90是热休克蛋白家族中重要一员,是具有高度保守性的广泛存在于生物界的蛋白质,应激时高表达,在机体的肿瘤免疫、自身免疫和抗感染免疫反应中起着重要作用[7]。Hsp90的客户蛋白多达100多种,广泛存在组织细胞中,活化态的Hsp90作为分子伴侣与客户蛋白结合形成复合物,保护对应客户蛋白不被蛋白酶降解[8]。Hsp90AB1是Hsp90的一个亚型,作为分子伴侣参与细胞对多种刺激的保护作用,容易受有丝分裂的诱导,与结构构建和细胞分化有关[9]。Hsp90AB1基因转录增加与Hsp90的表达增加有关,并且在SLE患者外周血单个核细胞中发现Hsp90表达增加。Hsp90作为分子伴侣蛋白与IL-6表达的增加有关,可能在SLE调节自身免疫的发病机制发挥重要作用。Hsp90与自身免疫性疾病(包括SLE)的发生发展密切相关[10]。近几年关于Hsp90与SLE的发病研究不断证实Hsp90在SLE中的表达高于正常人群。但目前国内外尚无Hsp90AB1基因多态性与SLE发病的关联性研究。因此,本文从遗传因素的层面来探讨Hsp90AB1基因突变和SLE发病之间的关联。
本研究表明Hsp90AB1基因rs9367190位点SLE组和对照组等位基因的频率分布之间存在明显差异。对照组突变基因的频率多高于SLE组,这表明rs9367190位点突变可能是SLE发病的保护因素。进一步分析Hsp90AB1基因rs9367190位点多态性与SLE发病关系,显性模型分析结果差异有统计学意义,rs9367190位点多态性与SLE发病存在关联且rs9367190位点突变可能是SLE发病的保护因素。因此,可能机制是Hsp90AB1基因突变导致Hsp90AB1的表达改变,而Hsp90AB1作为分子伴侣与IL-6或其它因子共同作用,从而导致个体患SLE风险不同。同时,单倍型分析结果也显示2个SNP所构成单倍型A/G与SLE发病之间存在关联,可能与SLE易感基因相连锁。rs9367190位点及与其连锁不平衡位点的功能研究有助于揭示其具体机制。本研究在调整年龄、性别混杂因素干扰后,这种相关性仍然存在,年龄、性别在此位点上对相关性影响不大。

表4 Hsp90AB1基因rs9367190与rs13296基因多态性与SLE发病之间的关系[n(%)]
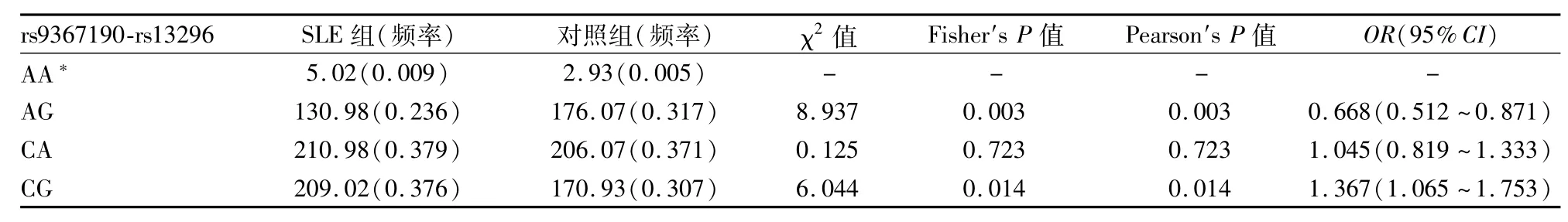
表5 Hsp90AB1基因2个SNP位点Haplotype分析
本研究显示Hsp90AB1基因rs13296位点SLE组和对照组基因型及等位基因的频率分布之间不存在明显差异,显性模型和隐性模型分析结果差异均无统计学意义。Hsp90AB1基因rs13296位点多态性的研究分析显示rs13296位点多态性可能与SLE发病无关。但是,考虑到本研究的局限性,rs13296位点多态性与SLE发病是否有关联需要进一步的研究证实。本研究局限性包括:①此次研究收集的样本量有限,使可能存在的差异没有体现出来,rs13296位点对照组和SLE组的频率相差很小,检验效能不高,可能出现假阴性结果;②所搜集的研究对象来自安徽省,地域的局限性可能对结果产生干扰;③目前国内外尚无Hsp90AB1多态性(rs13296)与SLE发病的研究,不能进行比较。
近年来,随着热休克蛋白作为肿瘤细胞的重要靶点被证实,Hsp90AB1基因多态性也逐渐受到关注。如Hsp90AB1基因多态性与印度奶牛的耐热性和产奶量性状关联的动物实验研究[11],证实印度奶牛的耐热性和产奶量性状与Hsp90AB1基因多态性有关;Hsp90AB1基因多态性与土耳其人非小细胞肺癌关联的人群研究[12]中,证实土耳其人Hsp90AB1基因多态性与非小细胞肺癌发生有关。
综上所述,本研究首次在中国汉族人群中初步探究Hsp90AB1基因多态与SLE易感性的关系。结果提示rs9367190位点多态性可能与SLE存在关联,且rs9367190突变可能是SLE发病的保护因素,但是rs13296位点多态性可能与SLE的易感性无关。这为以后SLE发病机制的研究提供了新的依据,但是需要更大样本量的研究及后续的基因功能研究来证实。
[1] Shukla H D,Pitha P M.Role of hsp90 in systemic lupus erythematosus and its clinical relevance[J].Autoimmune Dis,2012,2012:728605.
[2] Tackey E,Lipsky P E,Illei G G.Rationale for interleukin-6 blockade in systemic lupus erythematosus[J].Lupus,2004,13(5):339 -43.
[3] 曾转萍,廖日房,庾永基,等.广州市系统性红斑狼疮患者发生感染的影响因素研究[J].中华疾病控制杂志,2015,19(2):158-61.
[4] 冀 琨,李亚莉.专项护理质量监控小组在护理管理中的应用[J].中华现代护理杂志,2010,16(4):448-50.
[5] 李若洁,叶冬青.系统性红斑狼疮的全基因组关联研究进展[J].中华疾病控制杂志,2011,15(7):614-8.
[6] 涂 欣,石立松,汪 樊,等.全基因组关联分析的进展与反思[J].生理科学进展,2010,41(2):87-94.
[7] Taipale M,Jarosz D F,Lindquist S.HSP90 at the hub of protein homeostasis:emerging mechanistic insights[J].Nat Rev Mol Cell Biol,2010,11(7):515-28.
[8] 林 怡,吴丽贤.Hsp90抑制剂的研究进展[J].海峡药学,2014,26(9):6-8.
[9] 陈美霓,许静洪,赵菊梅,等.HSP90在肿瘤中的研究[J].延安大学学报(医学科学版),2015,13(2):62-4.
[10]Shimp S K,Chafin C B,Regna N L,et al.Heat shock protein 90 inhibition by 17-DMAG lessens disease in the MRL/lpr mouse model of systemic lupus erythematosus[J].Cell Mol Immunol,2012,9(3):255-66.
[11]Sajjanar B,Deb R,Singh U,et al.Identification of SNP in HSP90AB1 and its association with the relative thermotolerance and milk production traits in Indian dairy cattle[J].Anim Biotechnol,2015,26(1):45-50.
[12]Coskunpinar E,Akkaya N,Yildiz P,et al.The significance of HSP90AA1,HSP90AB1 and HSP90B1 gene polymorphisms in a Turkish population with non-small cell lung cancer[J].Anticancer Res,2014,34(2):753-7.
Association between polymorphism of Hsp90AB1 gene and
susceptibility of systemic lupus erythematosus in Chinese population
Gu Yuanyuan1,Zou Yanfeng1,Xu Jianhua2,et al
(1Dept of Epidemiology and Biostatistics,School of Public Health,Anhui Medical University,Hefei 230032;
2Dept of Rheumatology and Immunology,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
Objective To explore the association between Hsp90AB1 gene polymorphism and systemic lupus erythematosus(SLE)susceptibility in Chinese han population.Methods A case-control study was conducted by 278 SLE patients and 278 normal controls.Hsp90AB1 genetic tag SNPs(single nucleotide polymorphisms)in Chinese population were selected by the HapMap database and Haploview software,and the Tag SNPs were genotyped by Multiplex SNaPshot technology.Statistical analysis was performed with SPSS 10.01 software.An online software was used in haplotypes analysis.Results The rs9367190 genotypes(CC,CA,AA)had significant difference between SLE group and the control group(P>0.012 5),but the allele(C,A)frequency distribution had significant difference between SLE group and the control group(P<0.012 5);there was significant association between Hsp90AB1 gene rs9367190 polymorphism and SLE under the dominant model analysis(CC vs CA+AA:adjust OR =0.648,95%CI:0.464~0.906,P=0.011),but there was no statistically significant difference of the result in the recessive model analysis(P>0.012 5).However,the genotypes(GG,GA,AA)and the allele(G,A)frequency distributions of the rs13296 polymorphism all had no statistically significant difference between SLE group and the control group(P>0.012 5).The results of the dominant model analysis and the recessive model analysis had no significant difference(P>0.012 5).There was an association between SLE and haplotype A/G(OR=0.668,95%CI:0.512~0.871,P=0.003).Conclusion Hsp90AB1 gene polymorphism(rs9367190)may be associated with SLE in Chinese population.
Hsp90AB1;genetic polymorphism;systemic lupus erythematosus;susceptibility
R 593.241;R 181.26;R 394.112
A
1000-1492(2016)08-1151-05
时间:2016-6-22 14:44:58
http://www.cnki.net/kcms/detail/34.1065.R.20160622.1444.034.html
2016-04-14 接收
国家自然科学基金(编号:81373073)
安徽医科大学公共卫生学院1流行病与卫生统计学系、7检验系,合肥 230032
安徽医科大学第一附属医院2风湿免疫科、3健康体检中心、6皮肤性病科、8检验科,合肥 230022
4安徽医科大学附属省立医院风湿免疫科,合肥 230001
5安徽医科大学第二附属医院肾内科,合肥 230601
9安徽医科大学生物化学教研室,合肥 230032
谷园园,女,硕士研究生;
邹延峰,男,副教授,硕士生导师,责任作者,E-mail:zouyanfeng2015@163.com

