三叉神经痛模型大鼠三叉神经节神经元中NPR-A表达量的变化
韩 良,崔曼曼,徐文华,刘悦雁,王烈成,王元银
三叉神经痛模型大鼠三叉神经节神经元中NPR-A表达量的变化
韩 良1,崔曼曼1,徐文华1,刘悦雁2,王烈成3,王元银1
目的 检测三叉神经痛(TN)模型大鼠的三叉神经节(TG)神经元中NPR-A受体mRNA表达量的变化。方法
三叉神经节;慢性压迫性损伤;三叉神经痛
三叉神经痛(trigeminal neuralgia,TN)是一种神经病理性疼痛,累及三叉神经一支或几支,其分布区域内出现阵发性、电击样剧烈疼痛,持续数秒钟至数分钟,疼痛具有周期性,间歇期无症状[1]。近年来已经建立多种较为成熟的TN动物模型,如光化学损伤诱导TN动物模型[2]、眶下神经缩窄TN动物模型[3]以及本课题组前期建立的经眶下孔注射相关炎症因子制造大鼠TN模型[4]。利钠肽(natriuretic peptides,NPs)是一种神经肽,包括心房利钠肽、脑利钠肽(brain natriuretic peptide,BNP)、C型利钠肽、D型利钠肽和V型利钠肽。BNP在与其受体NPR-A结合后,通过第二信使cGMP在体内发挥相应的生理学功能。该研究将建立两种不同的TN模型,即眶下神经缩窄模型和经眶下孔注射肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)模型,观察其行为学改变及TG神经元中NPR-A的mRNA的动态变化,以探讨NPR-A在两种不同造模方式下三叉神经元内的变化规律,为TN新的治疗途径提供生理学基础。
1 材料与方法
1.1 实验动物 成年雄性SD大鼠,普通级,由安徽医科大学实验动物中心提供,180~200 g,分笼常规饲养、自由饮水,在标准环境下饲养(相对湿度:约50%,温度:20~25℃,12 h明/12 h暗)。实验开始前1周,对实验大鼠进行适应性刺激(用Von-Frey hairs疼痛测试棒刺激大鼠双侧三叉神经分布区域内的颜面部触须垫),每日连续刺激5次,间歇不少于30 s,双侧交替进行,选用对以上刺激反应平静且口鼻部毛发触须完整的大鼠用于造模。
1.2 实验分组及造模方法 将符合实验标准的大鼠随机分为6组,即对照组1(假手术组)、眶下神经慢性缩窄1周组、眶下神经慢性缩窄2周组、对照组2(生理盐水注射组)、TNF-α 1周组、TNF-α 2周组。每组5只。配置10%水合氯醛,将各组大鼠称重后,按0.35 ml/100 g的标准腹腔注射,待麻醉显效后,缩窄模型组大鼠沿大鼠手术侧(左颊部)颧骨下缘距鼻背部约0.5 cm,做长度为0.5~1 cm切口,钝性分离肌肉,显露眶下神经。从近端向远端分离约4~5 mm的长度。生物解剖镜下将两根铬线(4-0)力度适中的结扎眶下神经,间距约2~3 mm。压迫标准:在镜下可见眶下神经直径稍微变细,但是神经传导不能完全被阻断,且其外膜的血液循环畅通。假手术组除不结扎眶下神经外,其余手术方法均与ION-CCI模型组相同。TNF-α组大鼠待麻醉显效后,对注射侧(左侧)触须垫常规消毒后,固定大鼠头部,持微量注射器自左侧鼻翼旁约1 cm处与皮肤呈45°向上、后进针1.5 cm,刺入眶下孔,注射5 μl用0.1%牛血清白蛋白配制的0.01 ng/μl TNF-α。生理盐水注射组注射5 μl 0.9%Nacl。操作均在无菌条件下进行。
1.3 模型的验证 眶下神经支配区机械痛阈测定参照Christensen[5]、Vos et al[6]的标准,在安静的实验环境下,将大鼠置于鼠笼10 min后,持VonFrey hairs疼痛测试棒缓慢靠近大鼠,刺激大鼠手术侧触须垫,在刺激过程中测试棒强度需由小到大缓慢增加,每个强度分别刺激10次,2次刺激应至少间隔30 s。大鼠的阳性反应包括:①攻击行为,表现出大鼠迅速抓咬刺激物;②缩头反应,表现出头部迅速后缩;③连续搔抓面部受刺激区域的行为,一般情况下均伴随后退动作。刺激实验阳性标准:出现以上3种反应中任意1项或1项以上。使大鼠产生阳性反应的最小刺激强度值即为手术侧触须垫机械痛阈值。
1.4 Q-PCR法检测NPR-A的mRNA含量 大鼠断头处死后,快速取出左侧三叉神经节(trigeminal Ganglion,TG),用TRizol提取液提取组织总RNA,然后用NanoDrop ND-3000(美国NanoDrop公司)定量RNA样品。通过PrimeScriptTMRT试剂盒进行逆转录。使用sybrgreen takara PCR试剂盒进行PCR的扩增,总反应体系20 μl。所涉及的引物序列见表1。
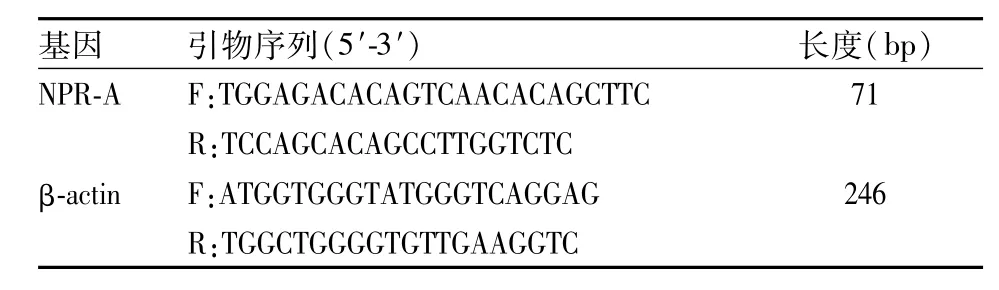
表1 荧光定量PCR引物序列
1.5 统计学处理 采用SPSS 22.0软件进行分析,两组数据间的比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 实验侧触须垫机械痛阈的变化 ION-CCI组大鼠术后1周,面部触须垫机械痛域明显下降[从(16.66±1.59)g下降到(7.90±1.34)g],术后第2周时痛域降至最低(4.22±1.06)g,这种效应至少持续至术后第8周(9.17±1.66)g,与假手术组比较差异均有统计学意义(n=5,F=74.32、282.59,P<0.01)(图1A、表2)。TNF-α组大鼠注射后1周即出现面部机械痛域降低[从(16.65±1.69)g下降至(5.86±1.23)g],术后第2周下降至最低(3.66±1.26)g,与生理盐水注射组比较差异有统计学意义(n=5,F=103.04、123.16,P<0.01)(图1B、表3)。TNF-α组大鼠后期机械痛域逐渐上升,至第8周(14.61±1.85)g基本恢复到术前水平(图1B)。而两组对照组大鼠术前术后的疼痛阈值没有显著性改变(图1)。
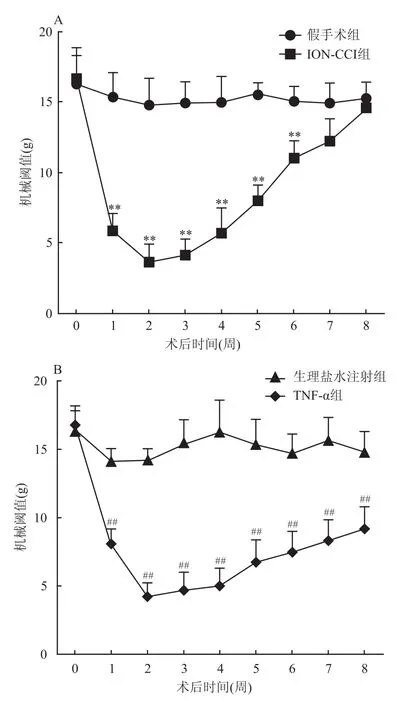
图1 ION-CCI组和TNF-α组触须垫机械痛域的变化
2.2 NPR-A的mRNA在TG的表达 与相应对照组比较,ION-CCI组和TNF-α组在术后1周NPRA mRNA的表达皆有所升高,其中TNF-α组差异有统计学意义(n=4,F=4.99、30.30,P<0.05)。术后第2周,ION-CCI组和TNF-α组的NPR-A mRNA含量均进一步升高,与相应对照组比较差异具有统计学意义(n=4,F=16.10、109.43,P<0.01)。见图2。
表2 假手术组和ION-CCI组触须垫机械痛域的统计结果(±s)

表2 假手术组和ION-CCI组触须垫机械痛域的统计结果(±s)
与同时间点假手术组比较,**P<0.01
项目假手术组ION-CCI组F值注射前16.46±1.4016.66±1.590.04注射后1周14.17±0.927.90±1.34**74.32注射后2周14.25±0.814.22±1.06**282.59注射后3周15.45±1.744.63±1.42**116.53注射后4周16.35±2.284.97±1.37**91.38注射后5周15.42±1.826.78±1.61**63.21注射后6周14.76±1.387.53±1.50**62.64注射后7周15.70±1.668.31±1.58**51.99注射后8周14.88±1.459.17±1.66**33.76
表3 对照组2和TNF-α组触须垫机械痛域的统计结果(±s)

表3 对照组2和TNF-α组触须垫机械痛域的统计结果(±s)
与同时间点生理盐水注射组比较:**P<0.01
项目生理盐水注射组TNF-α组F值注射前16.26±2.5816.65±1.69 8.34注射后1周15.41±1.705.86±1.23**103.04注射后2周14.83±1.863.66±1.26**123.16注射后3周14.99±1.464.19±1.13**171.26注射后4周15.03±1.825.78±1.73**67.91注射后5周15.57±0.797.99±1.13**151.55注射后6周15.08±1.0511.02±1.24**31.14注射后7周14.97±1.4112.27±1.578.14注射后8周15.31±1.1414.61±1.850.51

图2 ION-CCI组和TNF-α组NPR-A的mRNA表达含量变化趋势
3 讨论
本实验中ION-CCI模型和经眶下孔注射TNF-α模型大鼠,在术后第1周出现面部眶下神经支配区域机械痛域显著降低,到约第2周到达痛域的最低值,至少可以维持至术后第6周。对照组术后相同区域机械痛域无显著性改变,与前期文献[4,7]报道相一致。
现已发现神经节中存在多种神经肽及其受体。CGRP在TG中直径较小的细胞中表达,受到刺激后可有C纤维和A纤维释放[8]。生长抑制素及其受体在TG有表达,可抑制较小直径的TG神经元的兴奋性[9]。这些神经肽及其受体的含量在外周神经受损或炎症时有较大的改变。这种改变暗示着神经肽及其受体可能在TN的痛觉传递和调节中有潜在的作用。BNP最初是从猪脑组织中分离出来,其合成和分泌主要是在心房和心室内,而且心房中BNP量是心室中BNP量的50~100倍[10]。至目前为止,在哺乳动物体内发现三种利钠肽受体(natriuretic peptide receptor,NPR),即NPR-A、NPR-B、NPR-C,NPs选择性与其相应受体结合并产生生理学效应。NPR-A基本上分布在某些大血管、肾脏、肾上腺,其是心房利钠肽和BNP的共同受体[11]。NPR-A是一种鸟嘌呤环化酶受体,分子量120~140 ku,分为细胞外结构域、激酶同源结构域以及鸟嘌呤环化酶结构域3个结构域。BNP与其受体的细胞外结构域结合,激活细胞内鸟嘌呤环化酶,产生第二信使cGMP[12],继而调节cGMP依赖蛋白的活性来发挥生理学活性。这三种cGMP依赖蛋白分别是依赖于cGMP的蛋白激酶(cGMP-dependent protein kinases G,PKG)、依赖于cGMP的磷酸二酯酶、环核苷酸门控离子通道。细胞外结构域可与ATP结合,使其鸟嘌呤环化酶活性增大;细胞外结构域在一定条件下可磷酸化和去磷酸化,这种结构的变化对NPR-A的生理功能调节发挥极大影响[13]。在外周神经节中,BNP在与NPR-A受体结合后,通过其受体的腺苷酸环化酶催化GTP转化成第二信使cGMP,再通过cGMP参与PKG等不同信号通路的调节,可能会参与疼痛的发生发展,且对疼痛起调节作用。
近年来,有研究显示BNP对痛觉具有调控作用,主要集中在背根神经节和脊髓组织;其可能机制是伤害性感觉神经元中BNP及其受体NPR-A的基因表达在外周组织炎症作用下显著增加,并在谷氨酸作用条件下,BNP通过增大BKca开放概率来减少伤害性感觉神经元兴奋性,抑制了痛觉信息的传入。在脊髓腔内注射BNP后,急性和慢性炎症痛可被显著性的抑制[14]。通过激活位于突触前的NPR-A,由伤害性感觉传入纤维分泌的BNP可对兴奋性突触传递起抑制性调节作用。在大鼠的离体TG中小神经元中也有BNP及其受体的存在,并可通过调节TRPV1和P2X3受体的活性参与疼痛的传导[15]。本研究显示大鼠ION-CCI模型中术后1周NPR-A的mRNA表达约为对照组的1.7倍,术后2周时NPR-A的mRNA的表达约为对照组的2.9倍。在经眶下孔注射TNF-α制造大鼠TN模型中,术后第1周NPR-A的mRNA约为对照组1.94倍,术后第2周其mRNA约为对照组的4.9倍。此结果的变化趋势与术后大鼠机械痛域的变化趋势相符,提示NPRA可能会参与疼痛的发生发展。
综上所述,本实验从两种不同的TN模型大鼠中均可检测到NPR-A的mRNA表达升高,提示在疼痛的发生发展过程中NPR-A可能会起调节作用。在后续研究中,将进一步观察两种不同模型大鼠三叉神经元中BNP和NPR-A对疼痛的具体调节机制,为深入探索TN的病因及其机制提供依据。
[1] 张志愿.口腔颌面外科学[M].7版.北京:人民卫生出版社,2012:405-7.
[2] 崔 悦,赵 佳,王 晔,等.一种光化学损伤的三叉神经痛的建立[J].中国药理学通报,2014,30(7):1026-30.
[3] 孙 晖,李国超,王元银,等.眶下神经慢性缩窄环三叉神经痛动物模型的研究进展[J].医学综述,2013,19(12):2113-6.
[4] 马腾飞,王霁蕾,黄珊珊,等.经眶下孔注射相关炎症因子制造大鼠三叉神经痛模型的实验研究[J].安徽医科大学学报,2015,50(6):753-5.
[5] Christensen D,Gautron M,Guilbaud G,et al.Combined systemic administration of the glycine/NMDA receptor antagonist,(+)-HA966 and morphine attenuates pain-related behaviour in a rat model of trigeminal neuropathic pain[J].Pain,1999,83(3):433-40.
[6] Vos B P,Strassman A M,Maciewicz R J.Behavioral evidence of trigeminal neuropathic pain following chronic constriction injury to the rat′s infraorbital nerve[J].J Neurosci,1994,14(5 Pt 1):2708-23.
[7] 赵莉莉,雷 洁,王元银,等.P2X2/3受体在大鼠眶下神经慢性压迫性损伤中表达水平的动态变化[J].中国药理学通报,2012,28(5):676-808.
[8] Eftekhari S,Warfvinge K,Blixt F W,et al.Differerntiation of nerve fibers storing CGRP and CGRP receptors in the peripheral trigeminovascular system[J].J Pain,2013,14(11):1289-303.
[9] Takeda M,Kadoi J,Takahashi M,et al.Somatostatin inhibits the excitability of rat small-diameter trigeminal ganglion neurons that innervate nasal mucosa and project to the upper cervical dorsal horn via activation of somatostatin 2a receptor[J].Neuroscience,2007,148(3):744-56.
[10]Sudoh T,Kangawa K,Minamino N,et al.A new natriuretic peptide in porcine brain[J].Nature,1988,332(6159):78-81.
[11]Pandey K N.Endocytosis and trafficking of natriuretic peptide receptor-A:potential role of short sequence motifs[J].Membranes(Basel),2015,5(3):253-87.
[12]de Denus S,Pharand C,Williamson D R.Brain natriuretic peptide in the management of heart failure:the versatile neurohormone[J]. Chest,2004,125(2):652-68.
[13]徐 丽,陈兰英.利钠肽结构、受体的生理和病理作用[J].中国病理生理杂志,2004,20(8):1517-21.
[14]Zhang F X,Liu X J,Gong L Q,et al.Inhibition of inflammatory pain by activating B-type natriuretic peptide signal pathway in nociceptive sensory neurons[J].J Neurosci,2010,30(32):10927 -38.
[15]Vilotti S,Marchenkova A,Ntamati N,et al.B-type natriuretic peptide-induced delayed modulation of TRPV1 and P2X3 receptors of mouse trigeminal sensory neurons[J].PLoS One,2013,8(11):e81138.
Variation of NPR-A receptor expression on mouse
trigeminal ganglion neurons of trigeminal neuralgia model
Han Liang,Cui Manman,Xu Wenhua,et al
(College of Stomatology,Anhui Medical University,The Affiliated Stomatological Hospital of Anhui Medical University,Key Lab of Oral Diseases Research of Anhui Province,Hefei 230032)
Objective To investigate the expression of NPR-A receptor on mouse trigeminal ganglions of trigeminal neuralgia model.Methods Male SD rats were randomly assigned into 6 groups:control group 1(sham group),control group 2(infraorbital foramen inject normal saline group),chronic constriction injury of the infraorbital nerve guoup(ION-CCI group)1 week and 2 weeks and infraorbital foramen inject TNF-α group(TNF-α group)1 week and 2 weeks.The expressions of NPR-A mRNA were detected by Q-PCR.Results The expression of NPR-A was detected in all groups.And the expressions of NPR-A in the ION-CCI group 2 weeks and TNF-α group 1 week and 2 weeks were higher than that in the corresponding control group.Conclusion NPR-A receptor on mouse trigeminal ganglions may be involved in the trigeminal neuralgia and inflmmatory pain.
trigeminal ganglion;chronic constriction injury;trigeminal neuralgia
R 745.7
A
1000-1492(2016)08-1097-04
时间:2016-6-22 14:44:58
http://www.cnki.net/kcms/detail/34.1065.R.20160622.1444.010.html
2016-04-19 接收
国家自然科学基金(编号:81271162);安徽省高等学校省级优秀青年人才基金项目(编号:2012SQRL070);安徽省高校省级优秀青年人才基金重点项目(编号:2013SQRL146ZD)
1安徽医科大学口腔医学院,安徽医科大学附属口腔医院,合肥 230032
2皖西卫生职业学院生理学教研室,六安 237000
3安徽医科大学基础医学院生理学教研室,合肥 230032作者简介:韩 良,女,硕士研究生;
王元银,男,教授,主任医师,博士生导师,责任作者,E-mail:wyy1970548@sohu.com
采用眶下神经缩窄术和经眶下孔注射肿瘤坏死因子α(TNF-α)将雄性SD大鼠随机分成6组,即对照组1(假手术组)、对照组2(生理盐水注射组)、眶下神经缩窄模型组(ION-CCI组)术后1周和2周以及经眶下孔注射TNF-α组(TNF-α组)注射后1周和2周。Q-PCR法检测NPR-A受体mRNA的表达。结果 每组大鼠TG均表达NPR-A受体mRNA。其中ION-CCI组术后2周以及TNF-α组注射后1周和2周TG内NPR-A受体mRNA表达含量均显著高于相应对照组(n=4,P<0.05)。结论 大鼠TG表达的NPR-A受体可能与大鼠TN及炎性痛的发生和发展相关。

