柠檬醛调控突变型p53基因和AIF基因表达诱导急性早幼粒细胞白血病细胞株NB4凋亡
王亚萍,王 娟,吴中惠,张 慧,侯小芳,宋 琴,夏海龙
柠檬醛调控突变型p53基因和AIF基因表达诱导急性早幼粒细胞白血病细胞株NB4凋亡
王亚萍1,王 娟1,吴中惠1,张 慧1,侯小芳1,宋 琴2,夏海龙1
目的 探讨柠檬醛诱导急性早幼粒细胞白血病细胞株NB4凋亡的分子机制。方法 用不同浓度的柠檬醛处理NB4细胞48 h,通过实时荧光定量PCR(qPCR)法检测突变型p53(mtp53)基因和凋亡诱导因子AIF基因的mRNA表达变化。结果 柠檬醛实验组与空白对照组比较,mtp53基因表达量减低(P<0.05);柠檬醛实验组与空白对照组比较,AIF基因表达量增加(P<0.05);乙醇对照组与空白对照组比较,mtp53和AIF的mRNA表达量无明显差异;随着柠檬醛浓度(5、10、20 mg/L)的递增,mtp53 mRNA表达量逐渐下降,AIF mRNA的表达量逐渐上升,mtp53、AIF在不同浓度柠檬醛实验组表达量差异有统计学意义(P<0.05)。结论
柠檬醛;白血病;急性早幼粒细胞白血病细胞株;p53;凋亡诱导因子
山苍子油的主要成分柠檬醛,不仅可作为香料和食品添加剂,还有抗菌、抑菌、平喘等多种作用。研究[1-3]表明柠檬醛可诱导多种肿瘤细胞如A549、RAW264.7、HL-60、U937、MCF-7等的凋亡,且对人正常胸腺细胞和脾细胞无毒性作用。研究[4-5]表明柠檬醛可以通过激活内源性线粒体途径,抑制核因子NF-κB的表达,诱导急性早幼粒细胞白血病(acutepromyelocyticleukemia,APL)细胞株NB4的凋亡,但具体机制尚不明确。该研究旨在通过研究柠檬醛诱导NB4细胞凋亡过程中突变型p53(mtp53)基因、凋亡诱导因子(apoptosis inducing factor,AIF)基因表达的变化,进一步探讨柠檬醛诱导NB4细胞凋亡的可能分子机制。
1 材料与方法
1.1 试剂 胎牛血清、RPMI 1640购自美国Gibco公司;柠檬醛购自美国Sigma公司,纯度>95%,用乙醇溶解备用;TRIzol、SuperScriptⅢRT反转录试剂盒购自美国Invitrogen公司;引物由北京百奥思科生物医学技术有限公司合成。目的基因及内参基因引物序列和产物长度见表1。所测引物用Primer-BLAST软件验证,p53 Tm 58.8℃,AIF Tm 58.0℃。
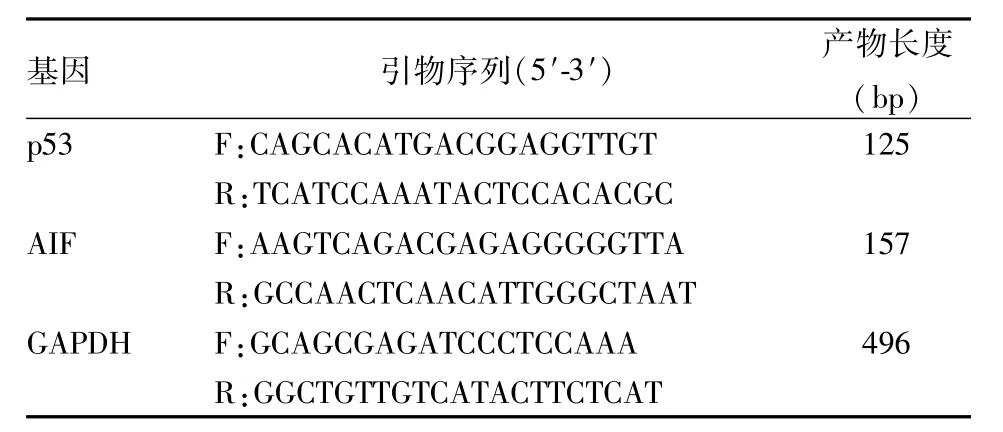
表1 实时荧光定量PCR的引物序列以及产物长度
1.2 细胞来源与培养 APL细胞株NB4细胞由天津血研所惠赠,该细胞株p53基因是突变型。NB4细胞于5%CO2、37℃、饱和湿度条件下,用含10%胎牛血清的RPMI 1640培养液培养,2~3 d换液1次。实验所用细胞处于对数生长期,台盼蓝染色拒染率>95%,维持细胞浓度在(2~3)×105/ml。
1.3 实验分组 分为柠檬醛实验组和对照组。柠檬醛实验组:选取处于对数生长期的NB4细胞,分别加入不同浓度的柠檬醛(5、10、20 mg/L,培养基乙醇终浓度5‰)培养。空白对照组:培养基中不加柠檬醛和5‰乙醇进行NB4细胞培养;乙醇对照组:培养基中不加柠檬醛,仅加乙醇至终浓度5‰进行NB4细胞培养。
1.4 采用qPCR法检测mtp53及AIF的表达 收集柠檬醛处理48 h后的细胞,用RNA提取试剂盒提取总RNA,再用反转录试剂盒superscriptⅢ进行反转录反应,反应体系为dNTP 1 μl、DTT 2 μl、5× Buffer 4 μl、RT酶1 μl、RNA 200 ng,补水至10 μl,1 000 r/min离心5 min后,置于42℃水浴箱水浴60 min,85℃孵育10 min。反应结束后置于-20℃保
1.5 统计学处理 应用SPSS 17.0软件进行分析,数据以±s表示。单变量两独立样本的比较采用t检验,多组样本间比较采用单因素方差分析。
2 结果
2.1 细胞生长计数 空白对照组NB4细胞培养呈对数生长状态时,调整细胞浓度均为(2~3)×105/ ml。柠檬醛实验组分别加入不同浓度的柠檬醛(5、10、20 mg/L,培养基乙醇终浓度5‰),乙醇对照组加入乙醇至终浓度5‰,与空白对照组同时进行细胞培养。分别在培养12、24、36、48 h时进行台盼蓝染色,计数活细胞数。乙醇对照组与空白对照组比较细胞计数差异无统计学意义;各实验组与空白对照组比较,细胞计数差异有统计学意义(F= 21.000,P<0.05);不同浓度实验组比较细胞计数差异有统计学意义(F=23.134,P<0.05)。NB4细胞生长计数曲线见图1。
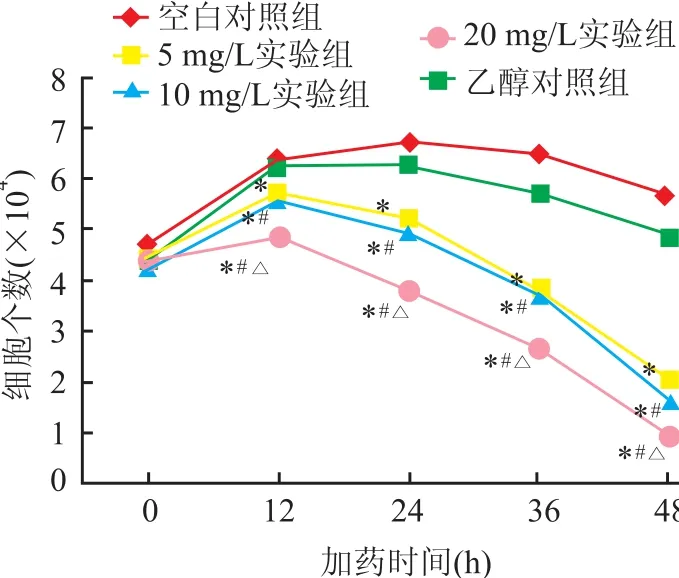
图1 细胞生长计数曲线
2.2 PCR产物的分析 扩增曲线及熔解曲线显示,p53、AIF和内参基因GAPDH的PCR产物呈单峰。熔解温度均一,曲线中没有其他杂峰,扩增产物具有特异性。见图2、3。

图2 不同基因的扩增曲线
图3 不同基因的熔解曲线
2.3 突变型p53(mtp53)mRNA的表达量检测
乙醇对照组和空白对照组比较,mtp53 mRNA的表达量差异无统计学意义;实验组与空白对照组比较,mtp53 mRNA的表达量差异有统计学意义(F= 53.46,P<0.05);各实验组间随柠檬醛浓度递增,mtp53 mRNA的表达量递减,差异有统计学意义(F =71.03,P<0.05)。见表2、图4。

表2 不同浓度柠檬醛作用于NB4细胞48 h后mtp53 mRNA表达量的变化(n=3)
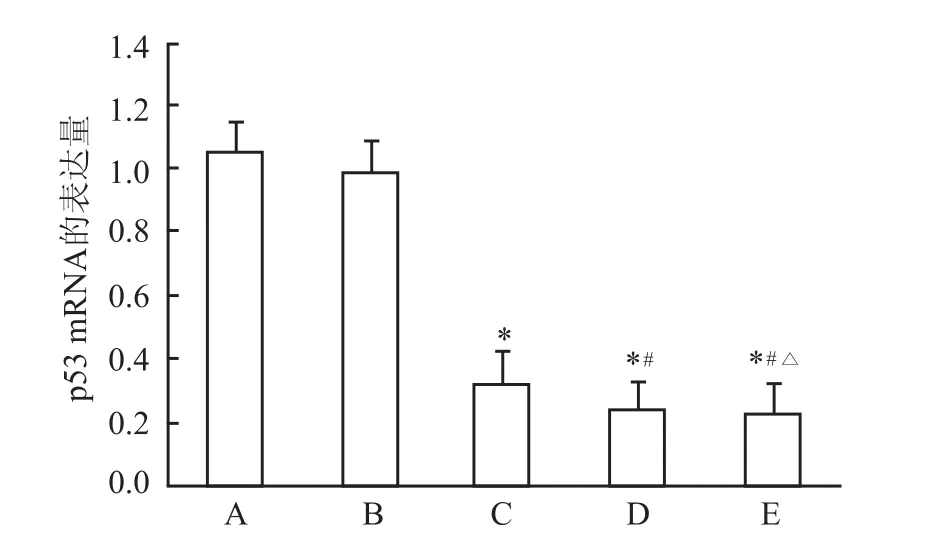
图4 柠檬醛对mtp53基因mRNA表达量的影响
A:空白对照组;B:乙醇对照组;C:5 mg/L实验组;D:10 mg/L实验组;E:20 mg/L实验组;与空白对照组比较:*P<0.05;与5 mg/ L实验组比较:#P<0.05;与10 mg/L实验组比较:△P<0.05
2.4 AIF mRNA的表达量检测 乙醇对照组与空白对照组比较,AIF mRNA的表达量差异无统计学意义;各实验组与空白对照组比较,AIF mRNA的表达量差异有统计学意义(F=50.04,P<0.05);各实验组间随柠檬醛浓度递增,AIF mRNA的表达量递增,差异有统计学意义(F=73.82,P<0.05)。见表3、图5。
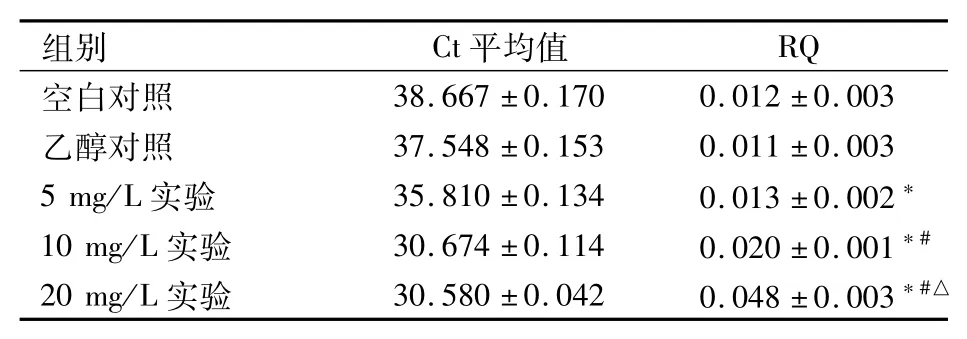
表3 不同浓度柠檬醛作用于NB4细胞48 h后AIF mRNA表达量的变化(n=3)
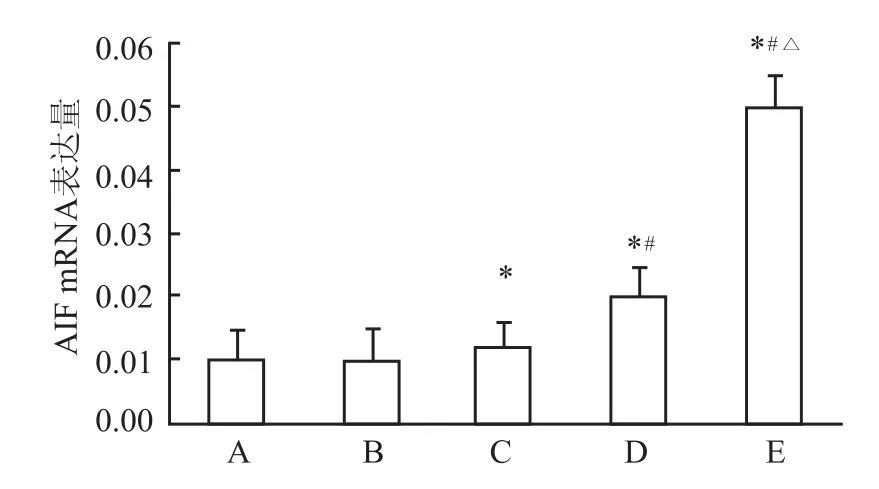
图5 柠檬醛对AIF基因mRNA表达量的影响
3 讨论
APL作为急性髓系白血病的的一种特殊亚型,是高度异质性的血液系统恶性肿瘤。APL有特异性的基因异位t(15;17),形成PML-RARα融合基因[6]。维甲酸和三氧化二砷分别通过不同的途径诱导APL细胞凋亡,使得APL患者达到缓解。维甲酸和亚砷酸治疗APL取得了巨大成就,但在治疗过程中出现一定的不良反应,部分病例对维甲酸、三氧化二砷耐药[7],研发新的治疗药物成为进一步提升APL治疗效果的重要问题。
研究[8]表明柠檬醛能够诱导APL细胞株NB4出现细胞凋亡的典型形态学改变,这种诱导作用在柠檬醛作用48 h时最强。研究[9]表明柠檬醛作用于NB4细胞后,凋亡相关基因Bcl-2的表达量明显下降,BAX基因、Caspase蛋白的表达量明显增加,这些结果表明柠檬醛通过线粒体凋亡相关途径诱导NB4细胞凋亡,但更为详尽的分子信号机制还有待进一步研究。
由于本实验使用的柠檬醛难溶于水,需要用乙醇进行溶解,设计了空白对照组和乙醇对照组,以观察5‰乙醇对正常NB4细胞生长及突变型p53基因、AIF基因表达的影响。结果表明,5‰乙醇对NB4细胞生长、突变型p53基因及AIF基因的表达无明显影响。
本研究表明柠檬醛作用NB4细胞48 h,突变型p53基因mRNA表达量均降低。p53基因可以通过抑制有丝分裂的进程,阻止细胞进入DNA合成期,参与DNA损伤修复或者启动细胞的凋亡,防止细胞向恶性转化;p53基因的突变会导致其正常生物学功能丧失,促进细胞的恶性转化和增殖,抑制细胞凋亡。研究[10]表明恶性肿瘤中,p53基因的突变占50%,细胞系中血液系统肿瘤p53突变率最高,约占17%。本实验细胞株具有典型t(15;17)异位,细胞株中的p53基因属于突变型[11]。野生型p53基因作为BAX/BAK的上游调控基因,可以通过下调BCl-2的表达,改变BCL-2/BCl-xL比例,形成BAX蛋白的寡聚化,上调BAX的表达,改变线粒体通透性诱导细胞凋亡[12-14]。突变型p53基因作用则与之相反,本研究显示NB4细胞中突变型p53基因表达较高,随着柠檬醛浓度的递增,突变型p53基因的表达量呈下降的趋势,提示柠檬醛可能通过下调突变型p53基因的表达,调控与之相关的下游调控因子,改变线粒体通透性,诱导细胞凋亡。
AIF位于染色体Xq25-26,由16个外显子组成,其编码可以产生67 ku、62 ku、57 ku 3种亚型蛋白。正常情况下,AIF蛋白位于线粒体内,当细胞中BAX增多时,BAX形成二聚体并转移到线粒体膜上,线粒体膜的通透性功能发生改变,线粒体通透性转换孔开放,57 ku AIF蛋白可以从线粒体中释放到细胞质并转移到细胞核内,降解DNA导致DNA片段化,从而促进细胞凋亡[15]。本研究结果显示,柠檬醛作用于NB4细胞48 h,AIF基因表达量明显增加,NB4细胞产生过量的57 ku AIF蛋白,有可能通过线粒体途径诱导NB4细胞凋亡。
综上所述,柠檬醛可能通过线粒体途径诱导NB4细胞凋亡。可能机制是:柠檬醛下调mtp53基因的表达,影响下游Bcl-2/BAX的比例,增加BAX的表达,从而改变线粒体膜的通透性,上调AIF等活性物质的释放。柠檬醛是否存在线粒体以外的凋亡通路诱导细胞凋亡,尚需进一步研究。
[1] Porto Mde P,da Silva G N,Luperini B C,et al.Citral and eugenol modulate DNA damage and pro-inflammatory mediator genes in murine peritoneal macrophages[J].Mol Biol Rep,2014,41(11):7043-51.
[2] Lee H J,Jeong H S,Kim D J,et al.Inhibitory effect of citral on NO production by suppression of iNOS expression and NF-kappa B activation in RAW264.7 cells[J].Arch Pharm Res,2008,31(3):342-9.
[3] Chaouki W,Leger D Y,Liagre B,et al.Citral inhibits cell proliferation and induces apoptosis and cell cycle arrest in MCF-7 cells[J].Fundam Clin Pharmacol,2009,23(5):549-56.
[4] 程 歆,夏海龙,陈晓文.柠檬醛抑制NB4细胞生长并诱导凋亡机制的研究[J].安徽医药,2010,14(10):1128-30.
[5] 宋 琴,夏海龙.柠檬醛诱导急性早幼粒细胞白血病细胞株NB4凋亡机制的研究[J].安徽医科大学学报,2012,47(4):404-7.
[6] Gañán-Gómez I,Estañ-Omaña M C,Sancho P,et al.Mechanisms of resistance to apoptosis in the human acute promyelocytic leukemia cell line NB4[J].Ann Hematol,2015,94(3):379-92.
[7] Rubio V,Calviéo E,García-Pérez A,et al.Human acute promyelocytic leukemia leukemia NB4 cells are sensitive to esculetin through induction of an apoptotic mechanism[J].Chem Biol Interact,2014,220:129-39.
[8] 陈晓文,夏海龙.柠檬醛抑制急性早幼粒细胞白血病细胞株NB4增殖并诱导其凋亡的作用[J].安徽医科大学学报,2010,45(2):196-9.
[9] Xia H,Song Q,Chen X,et al.The in vitro study of apoptosis in NB4 cell induced by citral[J].Cytochnology,2013,65(1):49-57.
[10]Bush J A,Li G.Anchorage-independent growth of p53-knockout dermal fibroblasts is reversed by wild-type p53[J].J Cutan Med Surg,2001,5(1):18-24.
[11]Li F,Chen X,Xu B,et al.Curcumin induces p53-independent necrosis in H1299 cells via a mitochondria-associated pathway[J]. Mol Med Rep,2015,12(5):7806-14.
[12]Hu W,Ge Y,Ojcius D M,et al.p53 signalling controls cell cycle arrest and caspase-independent apoptosis in macrophages infected with pathogenic Leptospira species[J].Cell Microbiol,2013,15(10):1642-59.
[13]Jamil S,Lam I,Majd M,et al.Etoposide induces cell death via mitochondrial dependent actions of p53[J].Cancer Cell,2015,15:79-89.
[14]Yu Z,Wu F,Chen L,et al.ETME,a novel β-elemene derivative,synergizes with arsenic trioxide in inducing apoptosis and cell cycle arrest in hepatocarcinoma cells via a p53-dependent pathway[J].Acta Pharm Sin B,2014,4(6):424-9.
[15]Norberg E,Orrenius S,Zhivotovsky B.Mitochondrial regulation of cell death:processing of apoptosis-inducing factor(AIF)[J].Biochem Biophys Res Commun,2010,396(1):95-100.
Mechanisms of apoptosis in NB4 cells induced by citral via regulation of mtp53 gene and AIF gene
Wang Yaping,Wang Juan,Wu Zhonghui,et al
(Dept of Hematology,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
Objective To investigate the mechanism of the apoptosis induced by citral in the acute promyelocyticleukemia cell line NB4.Methods NB4 cells were treated with citral for 48 h at the various concentration,and then the mRNA expression of mutation p53(mtp53)and AIF was detected by method of qPCR.Results The expression of mtp53 gene decreased when the critral groups compared with the control group,the difference between them was statistically significant(P<0.05);the expression of AIF gene was increased when the critral group compared with the control group,the difference between them was statistically significant(P<0.05);ethanol group compared with the control group,mRNA expressions of mtp53 and AIF had no significant difference.With citral concentration(5,10,20 mg/L)increasing,the level of expression of mtp53 mRNA reduced,while the level of expression of AIF mRNA gradually increased,both mtp53 and AIF expression in different concentrations of citral group differences were statistically significant(P<0.05).Conclusion Citral can induce apoptosis in NB4 cells by downregulating the expression of mtp53 and upregulating the expression of AIF.
citral;leukemia;NB4;p53;apoptosis inducing factor
R 733.71;R 979.1
A
1000-1492(2016)08-1101-05
时间:2016-6-22 14:44:58
http://www.cnki.net/kcms/detail/34.1065.R.20160622.1444.012.html
2016-04-19 接收存待用。取2 μl逆转录成的cDNA,进行qPCR反应。以管家基因GAPDH为内参,每份样本设3组平行对照。反应体系为20 μl,条件:95℃、2 min,94℃、20 s,65℃、20 s,72℃、30 s,40个循环。所测基因的表达量RQ=2-ΔΔCt[ΔΔCt=(待测样品的目的基因的Ct平均值-待测样本的看家基因的Ct平均值)-(对照样品的目的基因的Ct平均值-对照样本的看家基因的Ct平均值)],RQ值越大,基因的表达量越大。
安徽省自然科学基金(编号:1308085MH159)
1安徽医科大学第一附属医院血液内科,合肥 230022
2安徽中医药大学第一附属医院,合肥 230022
王亚萍,女,硕士研究生;
夏海龙,男,主任医师,硕士生导师,责任作者:E-mail:xhl1999cn@163.com
柠檬醛通过下调NB4细胞mtp53的表达,上调AIF的表达诱导NB4细胞凋亡。

