单侧肺精确滴注法制作小鼠单侧急性肺损伤模型的研究
姜宝珍,刘泽玉,刘 星,张志红
单侧肺精确滴注法制作小鼠单侧急性肺损伤模型的研究
姜宝珍1,2,刘泽玉1,2,刘 星3,张志红1,2
经导管气管内滴注方法制作一种操作简捷可靠、剂量精确的小鼠单侧肺损伤模型。经导管分别滴注生理盐水(NS组)、0.05%伊文斯兰(EB组)、脂多糖(LPS组)至小鼠左肺,6 h测呼吸功能(Pehn),24 h取肺脏进行病理分析,插管成功率为100%。解剖显示EB组小鼠左肺均匀分布EB,右肺无明显异常;NS组和EB组小鼠Pehn差异无统计学意义,LPS组Pehn与NS组、EB组比较差异有统计学意义(P<0.001);NS组和EB组小鼠双肺病理HE染色均无明显病理学改变,LPS组小鼠肺出现严重肺损伤。
单侧气管滴注;伊文斯兰;脂多糖
近年来随着实用性医学研究的深入,各种疾病的动物模型更能够接近人类疾病临床表现。急性肺损伤是创伤、急救医学不可避免的研究问题,不同类型急性肺损伤的动物模型也应运而生。小鼠易得且廉价,其基因背景99%与人类共享[1],因此科学家多用小鼠来制作各种疾病模型。同样地,小鼠急性肺损伤模型也被广泛应用。而如何精准地制作小鼠急性肺损伤模型是关键。气管滴注方法是建立急性肺损伤模型时经常使用的手术方法之一。而现有的国内外气管滴注方法操作[2-7]误差较大,造成造模显著的不稳定性和病变的不确定性。该研究在总结既往气管滴注方法的基础上,对导管、滴注手法加以改进,并引入指示剂,建立及完善一种更高效、精确、便捷、重复性高的小鼠单侧肺导管滴注方法。为今后呼吸道暴露方法能够更好地应用到临床医学、毒理学和环境医学等相关领域研究提供参考。
1 材料与方法
1.1 材料 18只清洁级雄性C57BL/6J小鼠,18~22 g,购自北京华阜康生物科技股份有限公司。伊文斯兰(E2129,美国Sigma Aldrich公司);脂多糖(LPS 055:B5,美国Sigma Aldrich公司);动脉导管(427401,美国BD公司,图1A);手术器械高压蒸汽灭菌(121℃、20 min)使用、冷光源(ULP-150,苏州ULANP公司);实验动物呼吸功能检测仪(gyd-003,法国EMKA-wbp公司)。实验中涉及动物的操作程序已经得到中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准(批准号:ILAS-PG-2015-017)。各组小鼠体重差异无统计学意义。
1.2 方法 18只小鼠按体重随机分为3组:正常对照(normal saline,NS)组6只,气管滴注无菌医用生理盐水(1 μl/g体重);伊文斯兰(evans blue,EB)组6只,气管滴管无菌0.05%伊文斯兰-生理盐水溶液(1 μl/g体重);脂多糖(lipopolysaccharide,LPS)组6只,气管滴注无菌LPS-生理盐水溶液(3.5 mg/kg体重)。操作步骤:①戊巴比妥钠溶液腹腔注射(50 mg/kg体重)麻醉小鼠,固定四肢于小动物加热板上,丝线固定门牙,使颈部充分暴露;②全部手术造模过程于洁净工作台内完成,小鼠颈前部备皮处理,按手术常规消毒颈前部皮肤,于小鼠气管正前方做5 mm纵行切口并钝性分离气管前肌肉、筋膜,暴露气管(图1B);③将小鼠固定于倾斜60°的小动物固定板上,术者位于小鼠头端,将冷光源对向小鼠的喉咽部,利用器械充分暴露喉部以及声门,清楚可见到光源由声门处透射出并随声门开合呈现闪烁感(图2A);右手持导丝置入后的导管,于声门张开瞬间向前上方平稳插入气管,可有轻微突破感,拔出导丝;于颈部切口处可见插入气管的导管(图2B);调整导管向左侧弯曲,再缓慢向气管深处插入,深至距小鼠上门牙约2.8 cm以确保导管末端置于左主支气管内,末端连接胰岛素注射器,向导管内缓慢推注药物,推注过程大于10 s,再补推注入约30倍液体体积的空气;④轻柔拔出导管并竖直放置小鼠5 min,术后小鼠给予保温措施等待苏醒;⑤6 h后检测小鼠呼吸功能,24 h后麻醉处死分离肺脏,肺组织经固定、脱水、包埋、切片及HE染色后于光学显微镜下观察两组小鼠肺脏组织的病理表现。

图1 操作准备

图2 操作过程
1.3 统计学处理 采用SPSS 17.0软件进行分析,数据以±s表示;经检验计量资料均符合正态分布及方差齐性,多组比较采用单因素方差分析和两样本均数t检验。
2 结果
2.1 状态观察 NS组和EB组小鼠在经导管单侧肺滴注药物过程中保持较平稳呼吸,没有出现窒息或死亡,术后观察咽部无明显充血、红肿,声门无明显损伤;小鼠苏醒后,活动、进食水等无明显异常表现。LPS组小鼠出现活动量及进食、饮水次数减少,呼吸急促、精神萎靡等表现。
2.2 大体观察 EB组小鼠气管滴注24 h后,解剖离体肺脏呈现左肺均匀分布蓝色EB生物指示剂,而右肺为淡粉色。见图3。
2.3 呼吸功能(Pehn) 3组小鼠的呼吸功能(Pehn)程度的方差分析比较差异有统计学意义(NS组:=0.429,σ=0.041;EB组:=0.464,σ= 0.019;LPS组:=5.59,σ=0.349;F=211.480,P =0.000 1);而NS组与EB组小鼠呼吸功能表现无明显差异(t=1.250,P=0.252),表明0.05%伊文斯兰-生理盐水溶液气管滴注对小鼠呼吸功能无明显影响;LPS组呼吸功能分别与NS组、EB组比较明显升高,差异有统计学意义(t=10.699,P= 0.000 1;t=10.794,P=0.000 1)。见图4。
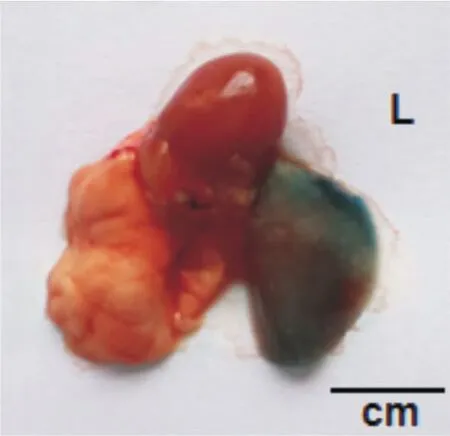
图3 EB组离体肺

图4 小鼠的呼吸功能(Pehn)
2.4 肺组织病理学 NS组与EB组双肺肺组织均无明显组织病理损伤;LPS组右肺未见明显损伤或轻微损伤,肺泡结构完整,左肺肺组织可见弥漫性的出血水肿,肺泡壁增厚、结构紊乱,部分肺泡萎陷不张。见图5。
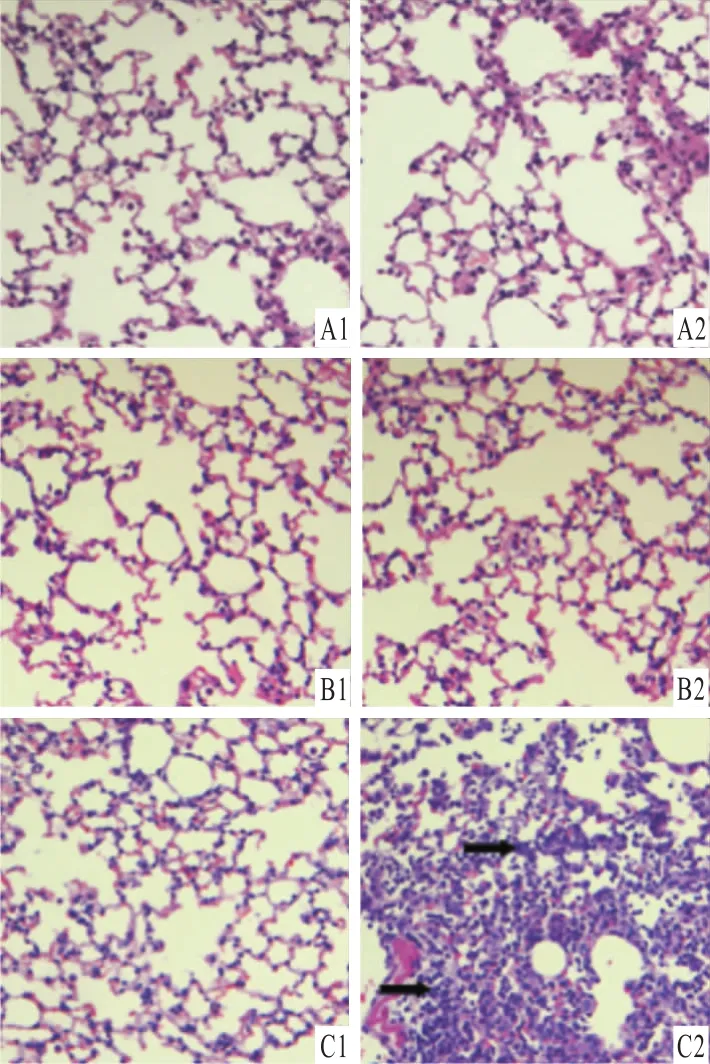
图5 小鼠肺组织病理学改变 HE×400
3 讨论
气管滴注方法是近年来实验人员探索开发出的一种呼吸道给药和染毒方法,如何简单易行、准确和可重复一直是困扰该方法的瓶颈。本研究分别在手术方法和器械等方面进行了相应的改进,手术后的小鼠均状态良好,能正常存活,插管成功率达100%。本实验还采用该研究方法成功地建立了LPS导致小鼠急性肺损伤动物模型。
现有的国内外气管滴注方法主要包括非暴露式和暴露式气管滴注,非暴露式是指滴鼻吸入[2]、咽后壁滴注或导管经咽喉插入气管内滴注[3-4];而暴露式气管滴注法是指经有创操作暴露动物气管,注射器直接刺入气管进行滴注[5]。两种滴注方法仍存在一些不足之处:①无法精确控制给药量及药物的肺内分布;②人为操作误差大,造成造模显著的不稳定性和病变的不确定性。国外也有少数研究者开始探索导管单侧肺滴注[6-7],但还存在如下问题:①实验者大多使用一次性静脉留置针或穿刺针进行气管插管,材料的性质导致导管插入部位随机性较大;②插管接口仅与普通注射器相匹配,给药量精确度控制欠佳[8];③操作无法实时确定导管插入成功与否,导致实验的盲目性,同时增加了实验损耗。
经过改良的气管滴注方法主要有以下优点:方法的改进更便于操作,采用暴露小鼠气管的方式,能直观地明确导管的插入位置;给药范围更明确,由于传统气管滴注方法可导致药物在不同肺叶分布不均,使实验结果具有较大的随机性,本实验方法由导管直接将药物滴注到左主支气管,使药物均匀分布于左肺,减小了个体间药物分布误差,实验结果显示,加入了指示剂组小鼠左肺EB均匀分布,右肺无明显指示剂分布。改良后的手术器械增加了安全性和精准度,实验选用动脉导管替代一次性静脉留置针或穿刺针,并且在导管内加入金属丝既保证了安全性又增加了硬度,最大限度上减小了手术操作对动物可能造成的损伤,可重复操作;相比原有方法所使用的普通医用注射器,给药量控制误差较大[8]的问题,本实验改用胰岛素注射器进行给药,其精确性显著提高[9],给药量更精确。除此之外,改良后的方法操作简捷、高效,仅需一人,每只小鼠约10 min即可完成滴注,极大地提高了滴注手术的效率和成功率。
肺组织病理学和呼吸功能检查在临床诊疗过程中应用广泛,在呼吸系统疾病的诊断、疾病程度和疗效的评估等方面都有十分重要的意义。EB是一种临床常用的测定血浆和血容量的指示剂,本实验表明,EB对小鼠呼吸功能无明显损伤作用,肺组织病理学检查未见明显病理改变,因此EB可作为气管滴注给药的一种指示剂。本研究采用改良后的气管滴注方法制作LPS导致小鼠急性肺损伤动物模型,LPS导致小鼠呼吸功能损伤严重程度较正常对照组明显加重;肺组织病理学显示左肺直接滴注LPS后,出现肺组织弥漫性出血水肿,肺泡壁增厚、结构紊乱,部分肺泡萎陷不张,而右肺仅有轻微损伤。研究表明气管滴注LPS能够严重损伤直接暴露的肺组织,非直接暴露肺组织损伤程度较轻,因此,药物在肺组织内的分布以及局部肺组织的药物浓度直接影响肺部病变。
本实验通过对细节的把握,针对定位不准确的问题通过引入EB指示剂加以完善,规范导管及微量注射器等装置降低实验误差,增加了气管滴注实验操作的可重复性和规范性,避免了造模效果不稳定、造模结果差异显著等问题的发生,并成功应用于LPS导致小鼠急性肺损伤模型建立,为将来进一步实施精准给药、定点染毒奠定了基础。综上所述,本方法是一种简捷可靠、剂量精确、可重复性高的小鼠单侧导管肺滴注方法,将来可广泛应用于小鼠经呼吸道给药、染毒等各项肺损伤相关模型的制作和研究中。
[1] Mouse Genome Sequencing Consortium,Waterston R H,Lindblad-Toh K,et al.Initial sequencing and comparative analysis of the mouse genome[J].Nature,2002,420(6915):520-62.
[2] Yu P J,Li J R,Zhu Z G,et al.Praeruptorin D and E attenuate lipopolysaccharide/hydrochloric acid induced acute lung injury in mice[J].Eur J Pharmacol,2013,710(1-3):39-48.
[3] Kardara M,Hatziantoniou S,Sfika A,et al.Caveolar uptake and endothelial-protective effects of nanostructured lipid carriers in acid aspiration murine acute lung injury[J].Pharm Res,2013,30(7):1836-47.
[4] Zhang Y,Wen Z,Guan L,et al.Extracellular histones play an inflammatoryrole in acid aspiration-induced acute respiratory distress syndrome[J].Anesthesiology,2015,122(1):127-39.
[5] Zhang Y,Zhao Z,Guan L,et al.N-acetyl-heparin attenuates acute lung injurycaused by acid aspiration mainly by antagonizing histones in mice[J].PLoS One,2014,9(5):e97074.
[6] Eickmeier O,Kim S Y,Herrmann E,et al.Altered mucosal immune response after acute lung injury in a murine model of Ataxia Telangiectasia[J].BMC Pulm Med,2014,14:93.
[7] Cornélio Favarin D,Martins Teixeira M,Lemos de Andrade E,et al.Anti-inflammatory effects of ellagic acid on acute lung injury induced by acid in mice[J].Mediators Inflamm,2013,2013:164202.
[8] 彭康琳,周玉庆,周正适.剂量精确的大鼠无创气管滴注方法[J].中国比较医学杂志,2013,23(9):61-3.
[9] 李 琨,王 涛,海 洁,等.注射器类型对胰岛素注射剂量的影响[J].实用医学杂志,2012,28(15):2614-6.
Explore an accurate approach for setting up acute single lung inflammation in mice through intratracheally instillation
Jiang Baozhen1,2,Liu Zeyu1,2,Liu Xing3,et al
(1Dept of Eldery Respiratory Medicine,The First Affiliated Hospital
of Anhui Medical University,Hefei 230022;2Institute of Respiratory Disease,Anhui Medical
University,Hefei 230022;3Institute of Laboratory Animal Science,PUMC&CAMS,Beijing 100021)
To establish a simple,efficient and accurate approach for setting upacute lung inflammation in left lung in mice through intratracheally instillation.3 groups were intratracheally instilled with normal saline(NS group),0.05%Evans Blue(EB group)and lipopolysaccharide(LPS group)into the left lung with a catheter respectively. Mice respiratory functions(Pehn)were measured at 6 hours after administration of the above reagents.Distribution of EB was observed by pathological analysis after mice were sacrificed at 24 hours after instillation.100%of the flexible tube was intubated in the exact site of the left main trachea and EB was distributed evenly in the left lung of all the EB group mice.No differences of the Pehn and histopathological changes were found between the NS and EB groups,however,significantly decreased Pehn and sever acute lung injury under microscope were observed in LPS group(P<0.001).
intratracheal instillation;Evans Blue;lipopolysaccharide
R 563.9
A
1000-1492(2016)08-1221-04
时间:2016-6-22 14:44:59
http://www.cnki.net/kcms/detail/34.1065.R.20160622.1444.070.html
2016-05-12 接收
安徽省学术技术带头人后备人选基金(编号:皖人社秘[2013]228号);安徽省卫生厅青年领军人才项目(编号:皖卫计委[2015]145号);中央级公益性科研院所基本科研业务费项目(编号:DWS201510)
1安徽医科大学第一附属医院老年呼吸内科,合肥 230022
2安徽医科大学呼吸病研究所,合肥 230022
3中国医学科学院医学动物实验研究所,北京 100021作者简介:姜宝珍,女,硕士研究生;
张志红,女,主任医师,硕士生导师,责任作者,E-mail:zhangzhihope@126.com;
刘 星,女,主管技师,责任作者,主管技师,E-mail:xingliu1976@163.com

