肠出血性大肠杆菌效应因子z2151的E3泛素连接酶活性鉴定
陈芳红,李 涛,李 崭,孙超尘,王 慧
◇基础医学研究◇
肠出血性大肠杆菌效应因子z2151的E3泛素连接酶活性鉴定
陈芳红1,2,李 涛2,李 崭2,孙超尘2,王 慧1,2
目的 利用基因工程方法原核表达z2151蛋白,并鉴定其E3泛素连接酶活性。方法 以肠出血性大肠杆菌O157∶H7为模板,PCR扩增目的基因,构建重组表达载体pET22b-z2151,转化BL21(DE3),诱导蛋白表达,采用镍柱亲和纯化获取目的蛋白;通过体外泛素化实验检测蛋白泛素连接酶活性。结果 亲和纯化得到较高浓度和纯度的z2151蛋白,其在体外泛素化反应中能够促使泛素小分子形成多聚泛素链,即有E3泛素连接酶活性;而且对E2泛素结合酶具有一定的选择特异性。结论 原核表达质粒pET22b-z2151构建成功,目的蛋白z2151具有泛素连接酶的体外泛素化能力,并且针对不同的E2酶亲和力不同,这些都为后续功能机制研究奠定了基础。
基因工程;肠出血性大肠杆菌O157∶H7;泛素连接酶;体外泛素化
肠出血性大肠杆菌(enterohemorrhagic Escherichia coli,EHEC)O157∶H7是人和动物重要的肠道致病菌[1],可通过侵染水源、食物等感染宿主导致腹泻、出血性结肠炎等,带来严重的临床危害[2],严重者可导致死亡[3]。2006年PNAS上报道过一些EHEC效应因子,其中z2151属于效应分子之一,存在于细菌前噬菌体上,属于非毒力岛编码的效应因子,是一种含有类似Ring结构域(环指结构)的E3泛素连接酶。E3泛素连接酶发现较晚,数量庞大且功能复杂,是近年来研究的热点,E3泛素连接酶是泛素化途径中决定底物特异性的关键酶,参与细胞周期、信号转导、炎症反应等的介导调控[4]。此外,在底物靶蛋白未知的情况下,E3酶可以调控泛素分子之间形成多聚泛素链或者将泛素链连接在自身蛋白上[5]。该研究利用大肠杆菌表达系统,表达并纯化得到His-z2151蛋白;后续活性检测显示其具有泛素连接酶的体外泛素化能力,初步探究了z2151分子的泛素化作用,为后续其他功能机制研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 肠出血性大肠杆菌O157∶H7菌株EDL933、大肠杆菌DH5α感受态细胞、大肠杆菌BL21(DE3)表达感受态细胞、pEASY-T1 simple载体均购自北京全式金生物技术有限公司;pET22b载体为实验室保存。
1.1.2 主要试剂及仪器 高保真TransStart Taq DNA聚合酶、DNA Marker及蛋白Marker购自北京全式金生物技术有限公司;基因组提取试剂盒购自美国Promega(北京)公司;PCR产物纯化试剂盒、质粒提取试剂盒购自北京康为世纪生物科技有限公司;琼脂糖凝胶回收试剂盒购自北京博迈德科技发展有限公司;限制性核酸内切酶、T4 DNA连接酶购自美国New England Biolab公司;LB培养基(干粉)购自英国OXOID公司;氨苄西林(Amp)、IPTG购自德国Sigma公司;HisTrap FF crude 5 ml预装柱、半干膜电转仪购自美国GE(北京)公司;E1酶(UBE1)、E2酶(UBE2D2、UBE2E3)、抗泛素抗体(anti-Ub)、泛素(Ub)购自美国Boston Biochem公司;PVDF膜购自美国Millipore公司;琼脂糖凝胶电泳仪购自北京六一仪器厂;超声波细胞粉碎机购自宁波新芝生物科技股份有限公司;蛋白电泳仪及凝胶成像分析仪ChemiDocTMXRS购自美国BIO-RAD公司。
1.2 方法
1.2.1 引物设计 PCR引物由中美泰和生物技术有限公司合成,用于扩增z2151基因,其中z2151上游引物:5′-CATATGATGCCTGTAGATTTAACG-3′(下划线标注限制性内切酶酶切位点NdeⅠ),下游引物:5′-CTCGAGATTTTTTAAAACGAAGTTAC-3′(下划线标注限制性内切酶酶切位点XhoⅠ)。
1.2.2 目的基因z2151的克隆 LB培养基过夜培养EHEC O157∶H7,次日提取基因组。然后以EHEC O157∶H7基因组为模板,PCR扩增z2151基因,序列大小为642 bp,PCR扩增条件:95℃、10 min,94℃、30 s,55℃、30 s,72℃、40 s,30个循环;72℃终延伸10 min。纯化回收PCR产物,与克隆载体pEASY-T1 simple连接,转化大肠杆菌DH5α感受态细胞进行克隆。次日挑取克隆,引物z2151F、z2151R进行PCR鉴定,将阳性克隆提取重组质粒。
1.2.3 重组表达载体的构建 NdeⅠ、XhoⅠ双酶切pEASY-z2151和空载体pET22b,并回收目的片段和载体,两者16℃连接过夜。取5 μl连接产物加入到100 μl刚解冻的感受态细胞中(DH5α),冰浴30 min,42℃热激45 s,冰上2 min,加入500 μl常温的LB培养基,37℃摇菌1 h,取100 μl菌液涂匀涂于含氨苄的LB平板,37℃倒置培养过夜。次日挑取克隆,引物z2151F、z2151R进行PCR鉴定,将阳性克隆提取重组质粒,测序正确后转化大肠杆菌BL21(DE3)表达感受态细胞,SDS-PAGE鉴定表达。
1.2.4 目的蛋白的诱导表达及纯化 阳性单克隆培养过夜,次日转接至1 L LB培养基中,37℃、200 r/min,培养至菌液光密度(optical density,OD)值0.6,加入IPTG至终浓度为0.1mmol/L,20℃、110 r/min诱导表达20 h。用缓冲液A(20 mmol/L磷酸钠、500 mmol/L氯化钠、40 mmol/L咪唑,pH 7.4)冲洗菌体,收集菌体并超声破碎,获取细菌蛋白,5 000 r/min、4℃离心取上清液,预装柱纯化目的蛋白步骤如下,取100 ml蒸馏水洗预装柱,小心注射,防止带进气泡;用100 ml缓冲液A平衡柱子,蛋白混合液上清缓慢注入预装柱;再用100 ml A液平衡预装柱;最后用洗脱液B(20 mmol/L磷酸钠、500 mmol/ L氯化钠、400 mmol/L咪唑,pH 7.4)洗脱收集目的蛋白,每管5 ml,收集6管;再用B液80 ml洗预装柱,除去残余蛋白后保存于20%酒精。SDS-PAGE蛋白电泳鉴定目的蛋白,透析蛋白,缓冲液(0.5 mmol/LTCEP、300mmol/LNaCl、10mmol/L HEPES,pH 7.5)透析保存,并检测蛋白纯度和浓度。
1.2.5 目的蛋白z2151泛素连接酶活性的鉴定20 μg反应体系:2 μg His6-z2151蛋白,0.13 μg E1酶,2 μg E2酶(UBE2D2、UBE2E3),4 μg泛素蛋白,反应缓冲液[50 mmol/L Tris-HCl(pH 7.5),100 mmol/L NaCl,10 mmol/L ATP,10 mmol/L MgCl2,0.5 mmol/L DTT],37℃水浴孵育1 h,4×SDSPAGE loading buffer终止反应。将反应混合物和预染Marker进行SDS-PAGE电泳,初始电压110 V、20 min,然后调换电压至180 V、60 min进行分离。将PVDF膜用甲醇浸湿30 s,将分离胶、PVDF膜及滤纸同时浸泡在电转缓冲液中30 min。使PVDF膜位于正极,胶位于负极,65 mA电转1.5 h,使蛋白从胶上转移至PVDF膜上。将电转后的PVDF膜浸泡于脱脂奶粉中,室温封闭2 h后PBST溶液洗膜3次,每次10 min。将PVDF膜置于密封袋,加入稀释好的一抗溶液(anti-Ub),4℃放置过夜。洗膜5次,加入稀释好的二抗,室温震荡40 min,PBST溶液充分洗涤后进行曝光检测。
2 结果
2.1 目的基因z2151的扩增 高保真Taq酶PCR扩增z2151基因,大小642 bp,测序鉴定正确,与Genbank公布序列一致,琼脂糖胶回收并纯化PCR产物,连接克隆载体pEASY-T1 simple进行片段扩增,用于后续酶切。见图1。
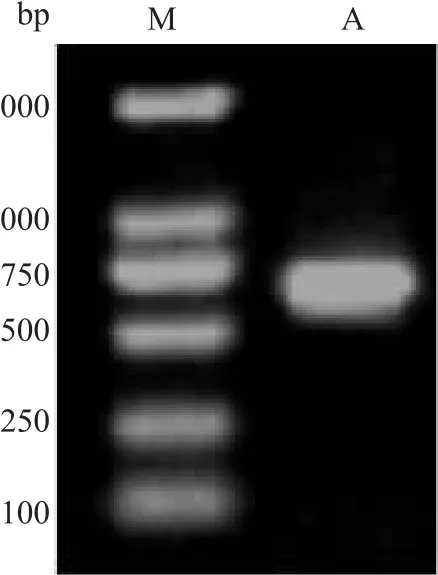
图1 PCR扩增z2151基因M:2 000 bp DNA Marker;A:z2151基因片段
2.2 重组克隆的筛选与鉴定 双酶切基因片段和pET22b载体,T4连接酶连接后转化DH5α感受态细胞,次日挑选氨苄LB平板上的单克隆,以引物z2151F、z2151R鉴定重组菌,片段大小为642 bp,证明表达载体构建成功。见图2。重组质粒pET22bz2151转化BL21(DE3)感受态细胞用于蛋白的表达。
2.3 目的蛋白的诱导表达及鉴定 添加IPTG诱导含有重组质粒的BL21(DE3)表达菌,以5 000 r/min、4℃离心30 min获取菌体沉淀,裂解变性后SDSPAGE鉴定有明显蛋白表达,蛋白大小为24 ku,与预测理论值相同,诱导蛋白表达成功。见图3。
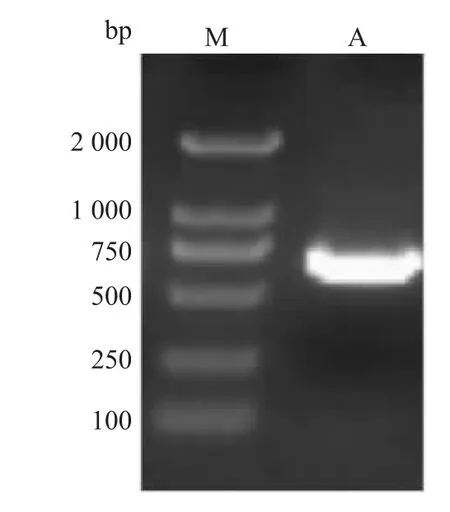
图2 PCR鉴定z2151基因M:2 000 bp DNA Marker;A:PCR扩增的目的基因片段
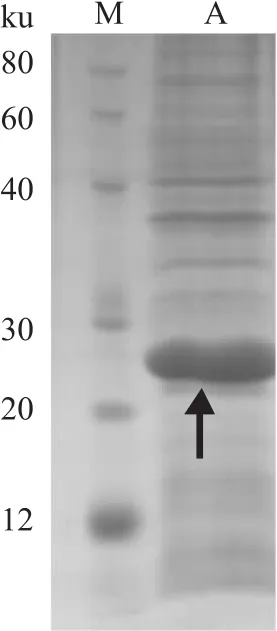
图3 目的蛋白z2151的表达鉴定M:Marker;A:全菌表达鉴定(箭头所示)
2.4 目的蛋白的亲和纯化 大批发酵的菌体蛋白经超声破碎后,8 000 r/min、4℃离心30 min取上清液,利用蛋白带有组氨酸标签这一特性,采用镍柱亲和纯化,洗脱后,对先后洗脱的蛋白液分别进行SDS-PAGE分离鉴定,可见目的蛋白(箭头所示)从第2管开始被洗脱出柱,至第4管仍有大量蛋白出现,杂蛋白较少,纯度达到95%,Bradford定量,蛋白浓度高达0.8 mg/ml。见图4。
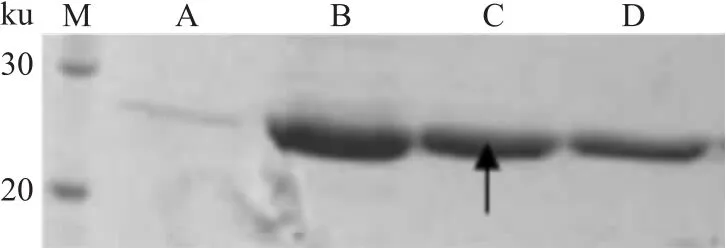
图4 z2151蛋白纯化电泳图M:Marker;A~D:纯化的z2151蛋白(箭头所示)
2.5 目的蛋白的泛素连接酶活性鉴定 在底物靶蛋白未知的情况下,E3泛素连接酶可以自身进行泛素化,抗泛素抗体检测反应复合物会呈现大小不同的蛋白条带。体外泛素化反应体系:E1(UBE1),E2:UBE2D2、UBE2E3,泛素(Ub),z2151蛋白,抗泛素抗体(anti-Ub)检测。蛋白呈现梯形分布,泛素链大小是由泛素分子数量决定的,针对不同的E2酶(UBE2D2、UBE2E3),泛素链形成的大小与数量都有差异,z2151泛素连接酶与UBE2D2亲和力更高,活性更大。分布在35~100 ku甚至更大的条带均为泛素链蛋白。见图5。

图5 z2151蛋白的自身泛素化
3 讨论
泛素化作为一种蛋白的翻译后修饰,调控众多生物进程,启动细胞快速应答周围环境的改变[6]。泛素化最初是在真核细胞中发现的[7],泛素化是一个包括E1(泛素激活酶)、E2(泛素结合酶)、E3(泛素连接酶)蛋白的多酶级联反应[8]。其中,泛素连接酶E3在调节生物过程中起着关键作用,很多疾病的发生都与其异常表达有关。真核生物中已发现近千种E3酶,数量庞大,而且功能复杂各异。然而在细菌中是缺乏这样典型的泛素化系统的,即缺失所有或者部分关键酶,没有完整泛素化必备元件,必须借助外界条件进行泛素修饰。研究[9-10]表明许多细菌病原体利用一些毒力因子破坏并开发宿主泛素化系统,有效触发宿主泛素化系统,使病原菌逃避宿主免疫系统攻击。已有许多证据显示一些病原菌编码分泌的效应因子具有E3泛素连接酶活性。这些E3酶效应物运输进入宿主体内,挟持宿主泛素化途径,使得细菌颠覆宿主防御系统,篡夺宿主细胞功能,操纵宿主信号系统来利于自身生存。如在EHEC中发现了有E3连接酶活性的NleL效应分子[11],其作为一种E3泛素连接酶,在EHEC的定植和侵染扩散细胞过程中扮演重要角色。
EHEC是一种食源性致病菌,也是人和动物重要的肠道致病菌,可引起严重腹泻,其感染还会带来严重的临床危害。在EHEC的效应分子中发现了z2151分子,为了证实z2151分子E3泛素化连接酶活性及后续的功能机制,是否参与细菌的感染与治病等。本研究成功获得z2151的可溶性原核表达,并且体外泛素化实验显示,重组z2151具有E3泛素连接酶活性,并且针对不同的E2酶选择性不同。这为后续深入研究酶的功能机制及可能的底物关系奠定良好的基础。并且有助于丰富细菌调控宿主免疫系统的理论研究。
[1] Piscatelli H,Kotkar S A,McBee M E,et al.The EHEC typeⅢeffector NleL is an E3 ubiquitin ligase that modulates pedestal formation[J].PLoS One,2011,6(4):e19331.
[2] Pacheco A R,Sperandio V.Shiga toxin in enterohemorrhagic E.coli:regulationand novel anti-virulence strategies[J].Front Cell Infect Microbiol,2012,2:81.
[3] Tyler J S,Beeri K,Reynolds J L,et al.Prophage induction is enhanced and required for renal disease and lethality in an EHEC mouse model[J].PLoS Pathog,2013,9(3):e1003236.
[4] Ashida H,Kim M,Sasakawa C.Exploitation of the host ubiquitin system by human bacterial pathogens[J].Nat Rev Microbiol,2014,12(6):399-413.
[5] 李杨,李栋.泛素连接酶-底物选择关系的研究进展[J].生物技术通报,2015,31(1):11-20.
[6] 卢亮,李栋,贺福初.蛋白质泛素化修饰的生物信息学研究进展[J].遗传,2013,35(1):17-26.
[7] 马苗苗,李伟,井勇,等.牛孤雌胚胎发育过程中泛素定位与线粒体分布的相关性[J].西北农林科技大学学报(自然科学版),2013,41(1):33-9.
[8] 杨莉佳,王江,石秋燕,等.SCF E3泛素化连接酶的研究进展[J].四川生理科学杂志,2014,36(3):122-4.
[9] Hicks S W,Galán J E.Hijacking the host ubiquitin pathway:structural strategies of bacterial E3 ubiquitin ligases[J].Curr Opin Microbiol,2010,13(1):41-6.
[10]Collins C A,Brown E J.Cytosol as battleground:ubiquitin as a weapon for both host and pathogen[J].Trends Cell Biol,2010,20(4):205-13.
[11]Lin D Y,Diao J,Zhou D,et al.Biochemical and structural studies of a HECT-like ubiquitin ligase from Escherichia coli O157∶H7[J].J Biol Chem,2011,286(1):441-9.
The E3 ubiquitin ligase activity identification of enterohemorrhagic Escherichia coli z2151 effector
Chen Fanghong1,2,Li Tao2,Li Zhan2,et al
(1Institute of Microbiology and Epidemiology,Academy of Military Medical Sciences,
Anhui Medical University,Hefei 230032;2State Key Laboratory of Pathogens and Biosecurity,Institute of Microbiology and Epidemiology,Academy of Military Medical Sciences,Beijing 100071)
Objective To express z2151 protein in E.coli by genetic engineering methods,and to identify its E3 ubiquitin ligase activity.Methods The full-length z2151 were cloned from EHEC O157∶H7 by PCR and were inserted into plasmid pET22b to construct the recombinant expression vector pET22b-z2151.The recombinant plasmid was transformed into E.coli BL21(DE3)strains which were incubated for expression.And the recombinant protein was purified using Ni2+NTA Sephrose;the in vitro ubiquitination method was used to identify its ubiquitin ligase activity.Results The z2151 protein of high concentration and purity was obtained,and found its E3 ubiquitin ligase activity by which it could help ubiquitin to form polyubiquitin chains in vitro activity;what's more,the z2151 protein selectively interacted with human E2 ubiquitin conjugating enzymes.Conclusion The recombinant expression vector pET22b-z2151 has been constructed,and the protein z2151 shows good ubiquitin ligase activity.The experiments provide reference for the study of the functional mechanism in the future.
genetic engineering;EHEC O157∶H7;ubiquitin ligase;in vitro ubiquitination
R 378.21;Q 78
A
1000-1492(2016)08-1077-04
时间:2016-6-22 14:44:57
http://www.cnki.net/kcms/detail/34.1065.R.20160622.1444.002.html
2016-05-04 接收
国家自然科学基金(编号:81401643)
1安徽医科大学军事医学科学院微生物流行病研究所,合肥 230032
2军事医学科学院微生物流行病研究所病原微生物生物安全国家重点实验室,北京 100071
陈芳红,女,硕士研究生;
王 慧,女,研究员,博士生导师,责任作者,E-mail:Geno0109@vip.sina.com

