环耙明对M1型巨噬细胞分泌iNOS的影响
叶家宝,李 俊,徐晓军,黄 成,孟晓明
◇药学研究◇
环耙明对M1型巨噬细胞分泌iNOS的影响
叶家宝,李 俊,徐晓军,黄 成,孟晓明
目的 研究环耙明在巨噬细胞极化过程中的作用。方法 用100 ng/ml脂多糖(LPS)和20 ng/ml干扰素γ(IFN-γ)处理RAW264.7 24 h刺激成M1型巨噬细胞,用20 ng/ml白介素-4(IL-4)处理RAW264.7 24 h刺激成M2型巨噬细胞,用荧光定量PCR(QPCR)法检测各分型中一氧化氮合成酶(iNOS)、CD86、精氨酸酶-1(Arg-1)、CD206、GLi1、ptch1 mRNA水平的表达;用QPCR法、Western blot法、免疫荧光法检测加入环耙明后对M1型巨噬细胞分泌iNOS的影响。结果 M1型巨噬细胞高分泌iNOS、CD86、M2型巨噬细胞高分泌Arg-1、CD206(P<0.01);40 nmol/L环耙明刺激后,M1型巨噬细胞中ptch1 mRNA水平的表达明显增强且在100 nmol/L时达到最大值(P<0.01);经环耙明1 000 nmol/L刺激后有效降低了iNOS的mRNA和蛋白水平,可能提示环耙明会促进巨噬细胞向M2型巨噬细胞分化。结论环耙明能够明显地降低M1型巨噬细胞中iNOS的分泌。
环耙明;巨噬细胞;RAW264.7;一氧化氮合成酶
巨噬细胞是机体重要的免疫细胞之一,通过免疫监视、免疫清除,清除病原体,维护内环境的稳态[1]。在这个过程中,巨噬细胞可在不同的生理病理状况下表现出不同的表型以调控炎症反应,即定义为不同的极化状态。研究[2]显示,巨噬细胞极化与炎症相关疾病的发生发展有着密切关系,例如类风湿性关节炎、细菌和寄生虫感染等。进一步的研究[3]表明,巨噬细胞极化过程受到多种信号分子的调控。其中NF-κB是巨噬细胞向M1极化过程中的关键分子。寻找内源性NF-κB的调控信号分子,影响巨噬细胞极化,在疾病的防治过程中有重要的作用。研究[4]表明多种通路可调控NF-κB,Hedgehog信号通路可通过调控NF-κB在胰腺癌等疾病中发挥重要作用。并且其与调节NF-κB的多种通路有交叉作用。而环耙明是一种小分子化合物,并且是Hedgehog信号通路特异性拮抗剂,作用于该通路中的Smo受体。该研究旨在探讨Hedgehog通路对巨噬细胞极化的影响,对免疫治疗的分子机制的研究提供实验依据。
1 材料与方法
1.1 细胞系 RAW264.7细胞由美国ATCC细胞库提供。细胞在常规培养基(DMEM高糖+5%胎牛血清+100 kU/L青霉素+100 mg/L链霉素),在含5%CO2、37℃、饱和湿度恒温培养箱里培养。取对数生长期细胞用于实验。
1.2 药品和试剂 环耙明(美国Selleckchem公司);DMEM高糖培养基(美国HyClone公司);PBS、RIPA强裂解液、PMSF(上海碧云天生物技术有限公司);4×Tris×HCl/SDS,pH 8.8、4×Tris×HCl/ SDS,pH 6.8、丙烯酰胺/甲叉双丙烯酰胺(37.5∶1)溶液(40%)(上海生工生物工程技术服务有限公司);二甲基亚砜(美国Sigma公司);胎牛血清、0.25%胰酶(美国Gbico公司);逆转录试剂盒(日本TOYOBO公司);TRIzol、QPCR引物合成、BCA法蛋白浓度定量试剂盒(美国Invitrogen公司);iNOS抗体(美国Cell Signal公司);GLi1抗体(美国Abcam公司);β-actin抗体(美国Santa Cruz公司);辣根过氧化酶标记抗兔和抗鼠IgG(北京中杉金桥生物技术有限公司)。
1.3 主要仪器 生物安全柜、NanoDrop2000超微量分光光度计(ND2000)(美国Thermo公司);冷冻离心机(美国Beckman公司);QPCR扩增仪(美国ABI公司);十二烷基硫酸钠一聚丙烯酰胺凝胶电泳(SDS-PAGE)仪(美国Bio-Rad公司)。
1.4 QPCR法检测 按TRIzol试剂说明书提取经处理后的RAW264.7总RNA,再立即用ND2000测定总RNA浓度。取1 μg RNA逆转录得到的cDNA后进行扩增,以GAPDH作为检测的内参物,QPCR扩增的反应体系为20 μl,包括cDNA 2 μl、上下游引物各0.4 μl、sybrgreen 10 μl、Rox 0.4 μl、无酶水6.8 μl。上机检测。以内参的循环数作为对照,计算2-ΔΔCt,再进行统计学分析。
1.5 Western blot法检测 RAW264.7细胞用预冷的RIPA裂解缓冲液加PMSF在冰上裂解60 min,每10 min振荡1次,收集细胞裂解物,于4℃、13 000 r/min离心30 min,吸取上清液,BCA法测定蛋白浓度。蛋白上样量为30 μg,进行10%聚丙烯酰胺凝胶电泳2 h,再转移到活化的PVDF膜上,非特异性封闭1 h,加入一抗,4℃过夜。次日用含辣根过氧化物酶标记的二抗孵育1 h,后用TBST洗膜4次,每次10 min,最后用ECL发光剂进行显影,以βactin作为内参,分别以目的蛋白与β-actin灰度比值作为该目的蛋白的相对表达量。
1.6 免疫荧光法检测 在传代细胞之时,将经过处理的盖玻片放入培养皿中,让细胞爬片。用4%多聚甲醛处理细胞室温固定30 min。PBS洗3次。0.2%Triton-X 100室温通透30 min,PBS洗3次。3%BSA室温封闭2 h。滴20 μl一抗在封口膜上,放在有水的饭盒中4℃过夜。撬片,放到皿里,PBS洗3次。滴20 μl二抗在封口膜上,放到湿盒里室温1 h。PBS洗3次。稀释DAPI,然后加0.5 ml,室温5 min。PBS洗1次、5 min。在载玻片上滴上封片剂,不要太多且注意不要有气泡,在毛玻璃侧做好标记。正置荧光显微镜观察。
1.7 统计学处理 采用Graphpad 6.01软件进行统计分析,数据以±s表示,组间比较采用独立样本t检验。检验水准α=0.05,所有检验为双侧检验。
2 结果
2.1 Hedgehog信号通路中抑制蛋白ptch1和转运蛋白GLi1在巨噬细胞中的表达 QPCR检测显示:与M2型巨噬细胞相比,M1型巨噬细胞中GLi1 mRNA水平的表达明显增加,差异有统计学意义(t= 10.72,P<0.01),与M1型巨噬细胞相比,M2型巨噬细胞中ptch1 mRNA水平的表达明显增加(t=475.4,P<0.01)。见图1。
2.2 巨噬细胞中iNOS、CD86、Arg-1、CD206的表达 QPCR检测显示,RAW264.7细胞中,与M2型相比,M1型中iNOS、CD86 mRNA水平的表达明显增强(t=23.40,P<0.01;t=16.68,P<0.01),与M1型相比,M2型中Arg-1、CD206 mRNA水平的表达明显增强(t=8.79,P<0.01;t=19.79,P<0.01)。见图2。

图1 Hedgehog信号通路中转运蛋白GLi1和抑制蛋白ptch1在各类型巨噬细胞中的表达

图2 各类型巨噬细胞中iNOS、CD86、Arg-1、CD206 mRNA的水平
2.3 环耙明对M1型巨噬细胞的ptch1表达的影响 QPCR检测显示,与对照组比较,经环耙明40、100、1 000、2 000 nmol/L刺激后,M1型巨噬细胞中ptch1 mRNA水平的表达明显增强,且在100 nmol/L时达到最大值(t=16.68,P<0.01)。见图3。
2.4 环耙明对M1型巨噬细胞iNOS表达的影响
用QPCR法检测加入环耙明后M1型巨噬细胞分泌iNOS mRNA水平明显下调(t=194.9,P<0.01)。见图4。Western blot法、免疫荧光法检测的蛋白水平也明显下调(t=264.7,P<0.01)。见图5、6。
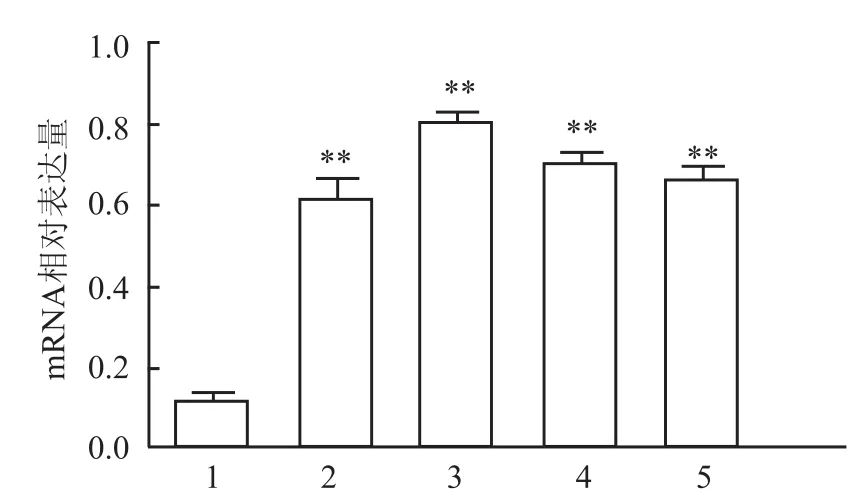
图3 环耙明对M1型巨噬细胞的ptch1在mRNA水平的影响
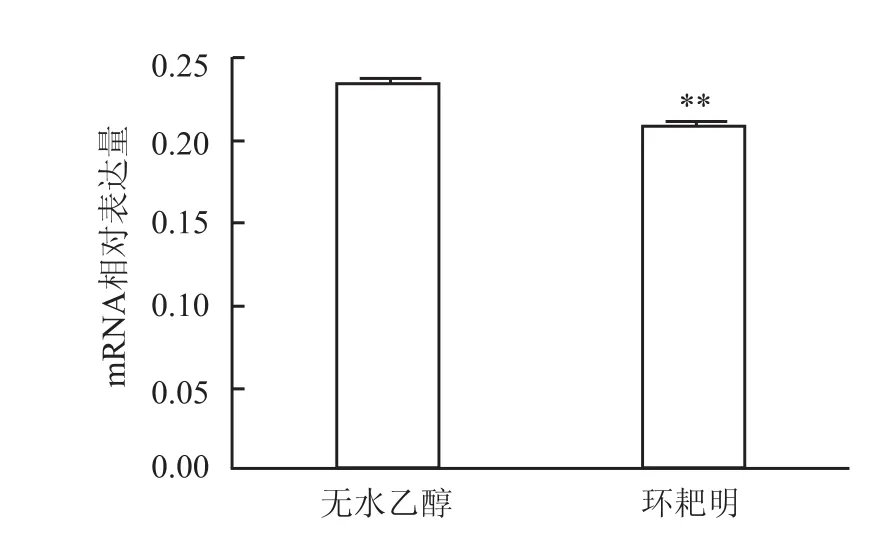
图4 QPCR法检测环耙明对M1型巨噬细胞iNOS表达的影响
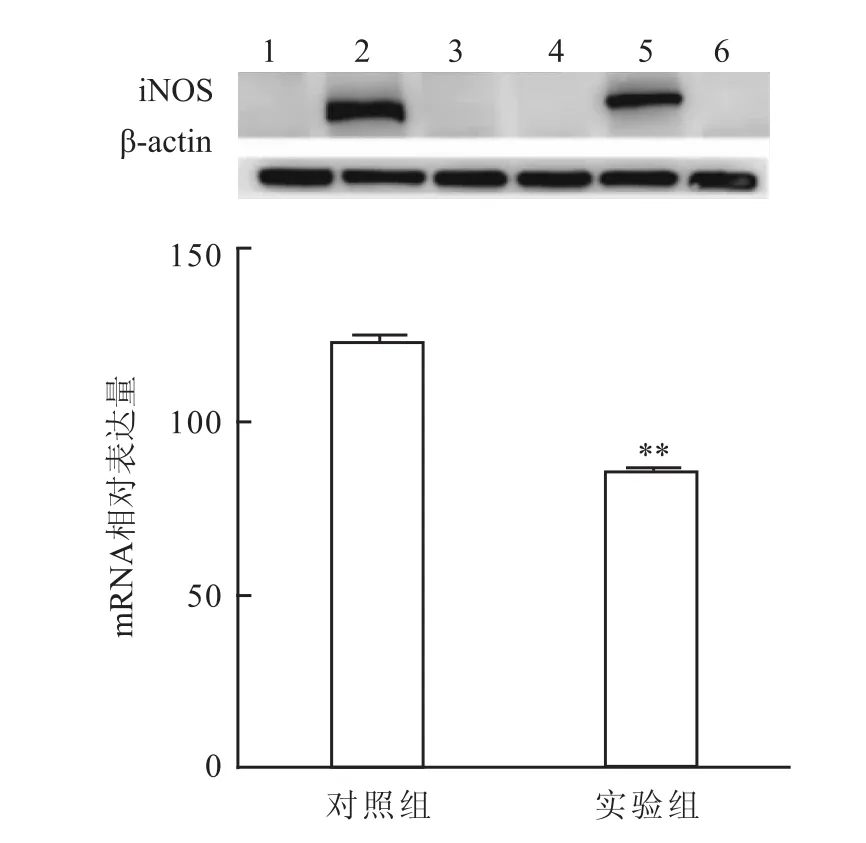
图5 Western blot法检测环耙明对M1型巨噬细胞iNOS表达的影响
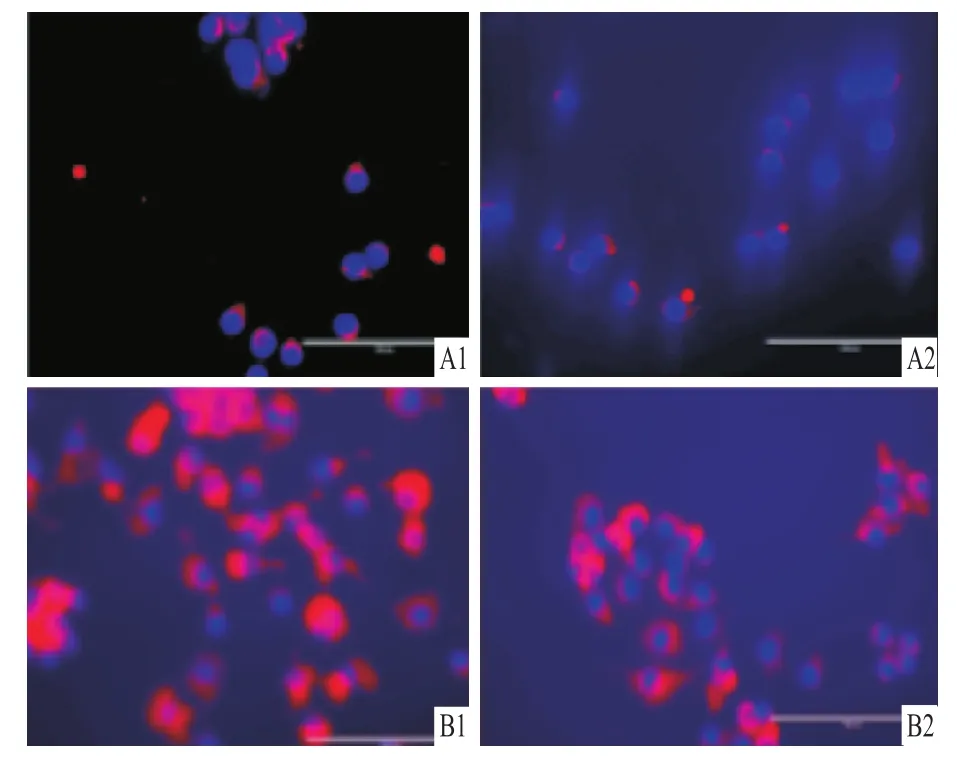
图6 免疫荧光法检测环耙明对M1型巨噬细胞iNOS表达的影响 ×100
3 讨论
巨噬细胞是从单核细胞分化而来,是一类重要的固有免疫效应细胞。在固有免疫应激过程中,组织外的巨噬细胞对于外来抗原起到防御作用,并且能够通过吞噬或者降解从而维持抗原在一定的耐受范围内,其还可以与其他的免疫细胞发生相互作用,比如T细胞和B细胞,相互作用的过程中会释放大量的细胞因子和酶类等。巨噬细胞还可参与机体内许多抗炎或抑炎反应,对于组织细胞的损伤和修复都起到一定的作用。研究[5]表明,巨噬细胞按照TH细胞的分类原理一样,根据其表型和分泌的细胞因子定义为两种极化类型,即经典活化的M1型和选择性活化的M2型。M1型高表达ROS、IL-1、IL-12、IL-23等其他趋化因子,发挥宿主免疫功能,但也会导致机体正常组织的炎症损伤。M2型高表达CD209、CD206、IL-10、CD301等其他趋化因子,发挥降低炎症反应、组织修复功能,但在炎症后期可发挥抗炎作用、促进创伤修复。此外,持久性M1型巨噬细胞及其活性的产品可以诱导组织损伤,M2型巨噬细胞抑制炎症、清除残骸,血管生成和组织愈合。巨噬细胞极化在许多人类炎性疾病治疗中,包括动脉粥样硬化、肥胖和胰岛素抵抗、癌症、类风湿性关节炎、细菌和寄生虫感染发挥了至关重要的作用。其中,信号通路在影响巨噬细胞极化的过程中起到巨大作用。如TLR、MyD88、MAPK、NF-κB[6]、mTOR、STAT6[7]。因为许多信号通路与Hedgehog信号通路存在交叉作用。所以,也许Hedgehog信号通路参与了巨噬细胞的极化过程。
Hedgehog信号通路开始发现其功能,是在胚胎发育、组织分化过程中起到重要的调控作用。然而近年来,研究[8]显示Hedgehog信号通路在肿瘤发生的过程中也发挥着重要作用。Hedgehog信号通路主要由正调控的Shh配体和跨膜蛋白Smo、负调控跨膜蛋白受体Ptch以及下游转录因子Gli蛋白(Gli1、Gli2、Gli3)组成。Smo蛋白是Hedgehog信号通路中重要的传递信使,能够将细胞外的Shh信号转换成细胞内的Gli1信号,从而启动细胞核内基因的转录,对Hedgehog信号通路具有激活作用。其中Ptch蛋白的异常激活也能阻止该过程的发生。为了探究当该通路没有激活时,其对病理生理的影响,运用其抑制剂是个很好的研究方法,其中环耙明是Hedgehog信号通路特异性抑制剂[9],作用于该通路中Smo受体。
目前,许多对于Hedgehog信号通路的研究[9]集中于其在癌症发生发展中的作用。对于其在免疫方面的作用尚未有所研究。本研究从其与NF-κB等重要的炎症信号通路有交叉作用,探讨其对巨噬细胞极化的影响。本研究显示,Hedgehog信号通路在M1型巨噬细胞中是激活的,抑制基因ptch1低表达,其抑制剂环耙明可降低M1型巨噬细胞iNOS的表达,可能促进巨噬细胞向M2型巨噬细胞极化,本研究的意义在于,Hedgehog信号通路的异常激活可促进癌症的发生,通过使用其抑制剂可能会导致其向M2型巨噬细胞极化,而M2型巨噬细胞在炎症后期对癌症细胞起到保护作用,这就提示,小分子化合物对于癌症[10]治疗的副作用可能就是因为其促进巨噬细胞向M2型巨噬细胞极化,尚需进一步深入研究,本研究是第一次探讨该抑制剂对巨噬细胞极化后分泌物的影响,为后来的研究提供基础,也为临床治疗提供一定的理论依据。
[1] Almatroodi S A,McDonald C F,Darby I A,et al.Characterization of M1/M2 tumor-associated macrophages(TAMs)and Th1/Th2 cytokine profiles in patients with NSCLC[J].Cancer Microenviron,2016,9(1):1-11.
[2] Chen J J,Lin Y C,Yao P L,et al.Tumor-associated macrophages:the double-edged sword in cancer progression[J].J Clin Oncol,2005,23(5):953-64.
[3] Ahmad A.Pathways to breast cancer recurrence[J].ISRN Oncol,2013,2013:290568.
[4] Du W,Liu X,Chen L,et al.Targeting the SMO oncogene by miR-326 inhibits glioma biological behaviors and stemness[J].Neuro Oncol,2015,17(2):243-53.[5] 李美玲,李应配,冷银芝,等.双酚A对小鼠腹腔巨噬细胞极化影响的体外研究[J].安徽医科大学学报,2015,50(6):82-5.
[6] Zou J,Shankar N.Roles of TLR/MyD88/MAPK/NF-κB signaling pathways in the regulation of phagocytosis and proinflammatory cytokine expression in response to E.faecalis infection[J].PLoS One,2015,10(8):e0136947.
[7] Tian F,Yu B L,Hu J R,et al.mTOR mediates the cross-talk of macrophage polarization and autophagy in atherosclerosis[J].Int J Cardiol,2014,177(1):144-5.
[8] Genin M,Clement F,Fattaccioli A,et al.M1 and M2 macrophages derived from THP-1 cells differentially modulate the response of cancer cells to etoposide[J].BMC Cancer,2015,15:577.
[9] Xu Y,An Y,Wang X,et al.Inhibition of the Hedgehog pathway induces autophagy in pancreatic ductal adenocarcinoma cells[J]. Oncol Rep,2014,31(2):707-12.
[10]You J,Zhao J,Wen X,et al.Chemoradiation therapy using cyclopamine-loaded liquid-lipid nanoparticles and lutetium-177-labeled core-crosslinked polymeric micelles[J].J Control Release,2015,202:40-8.
Effect of cyclopamine on the secretion of iNOS in M1-type
Ye Jiabao,Li Jun,Xu Xiaojun,et al
(School of Pharmacy,Anhui Medical University,Hefei 230032)
Objective To observe the role of cyclopamine in macrophage polarization.Methods M1-type macrophage was treated with LPS(100 ng/ml)and IFN-γ(20 ng/ml)for 24 h,and M2-type macrophage was stimulated with IL-4(20 ng/ml)for 24 h.The expressions of iNOS,CD86,Arg-1,CD206,GLi1,ptch1 were detected by QPCR in various types;the mRNA level of iNOS was determined by QPCR after joining cyclopamine in the M1-type,the protein expression of iNOS was assessed by western blot and immunofluorescence after joining cyclopamine in the M1-type.Results The relative expression of iNOS,CD86 was significantly higher in M1-type than that in M2-type at mRNA level(P<0.01).The relative expression of Arg-1,CD206 was significantly higher in M2-type than that in M1-type at mRNA level(P<0.01).After 40 nmol/L cyclopamine stimulation,the mRNA level of ptch1 was significantly enhanced in M1 macrophages and reached the maximum at 100 nmol/L treatment of M1-type with cyclopamine at 1 000 nmol/L,which effectively reduced the expression of iNOS at mRNA and protein levels,suggesting that it could promote the macrophages polarization to M2-type.Conclusion Cyclopamine can obviously reduce the secretion of iNOS in M1 macrophages.
cyclopamine;macrophages;RAW264.7;iNOS
R 392.5
A
1000-1492(2016)08-1141-05
时间:2016-6-22 14:44:58
http://www.cnki.net/kcms/detail/34.1065.R.20160622.1444.030.html
2016-05-30 接收
国家自然科学基金(编号:81273526、81473268);安徽省自然科学基金(编号:1308085MH145);安徽省科技专项基金(编号:1301042212);高等学校博士学科点专项科研基金(编号:20123420120001)
安徽医科大学药学院,合肥 230032
叶家宝,男,硕士研究生;
李 俊,男,博士,教授,博士生导师,责任作者,E-mail:lj @ahmu.edu.cn

