PJ34对A549/DDP细胞耐药相关基因表达的影响
韩 柯,郝吉庆
PJ34对A549/DDP细胞耐药相关基因表达的影响
韩 柯,郝吉庆
目的 探讨PJ34对肺腺癌顺铂耐药(A549/DDP)细胞多药耐药相关基因的影响。方法 将A549/DDP细胞分为对照组、顺铂单药组、PJ34单药组、PJ34联合顺铂组,RTPCR法检测细胞内肺耐药蛋白(LRP)、多药耐药蛋白(MRP)、P-糖蛋白(P-gp)、谷胱甘肽-S-转移酶-π(GST-π)、拓扑异构酶Ⅱα(TOPO-Ⅱα)mRNA转录水平。结果 除了TOPO-Ⅱα外,其余四种耐药相关基因mRNA在A549/DDP细胞内的转录水平明显高于A549细胞(P<0.05)。经PJ34处理后的A549/DDP细胞内MRP、P-gp mRNA转录水平下降(P<0.05),且呈浓度及时间依赖性。结论 LRP、MRP、P-gp、GST-π可能参与了A549/DDP细胞对顺铂的继发耐药,PJ34可能通过下调MRP、P-gp mRNA转录水平而间接增加顺铂对DNA的损伤。
肺腺癌;PARP-1抑制剂;顺铂;耐药性;多药耐药基因
中晚期肺癌患者无法行根治性切除术,以铂类为主的联合化疗成为主要治疗手段,仅有25%患者生存达到5年[1],多药耐药的产生是治疗失败的主要原因。聚腺苷酸二磷酸核糖聚合酶-1[Poly(ADP-ribose)merase-1,PARP-1]是存在于多数真核细胞内的蛋白核酶,其维持基因组稳定,调节基因转录[2]。课题组前期研究[3]表明,PARP-1在肺腺癌顺铂耐药细胞株中表达明显上调,第三代PARP-1抑制剂PJ34可诱导细胞凋亡、抑制DNA损伤修复、增强肺腺癌顺铂耐药细胞对顺铂的敏感性。研究[4-5]显示肺耐药蛋白(LRP)、多药耐药相关蛋白(MRP)、P-糖蛋白(P-gp)、谷胱甘肽S-转移酶-π(GST-π)和拓扑异构酶Ⅱ(TOPOⅡ)在肿瘤的耐药中发挥重要作用。该研究探讨耐药相关基因在肺腺癌顺铂耐药株与野生株间的表达差异及PJ34对其表达的影响。
1 材料与方法
1.1 细胞株 肺腺癌顺铂耐药细胞(A549/DDP)株购自南京凯基生物科技发展有限公司;A549细胞株由安徽医科大学基础医学院惠赠,均培养于37℃、5%CO2培养箱中,隔天换液,细胞长至80%~90%传代。A549/DDP细胞初始加入含500 ng/ml DDP的药物培养液,两代后加入终浓度为2 000 ng/ ml的顺铂维持其耐药表型。
1.2 试剂及器材 RPMI 1640培养基购自美国Hyclone公司;PJ34购自美国Sigma公司;胎牛血清购自杭州四季青公司;顺铂注射液购自山东齐鲁制药有限公司;RNA提取TRIzol、cDNA逆转录试剂盒、SYBR Select Maser Mix均购自美国Thermo公司;PCR基因扩增仪MJ Research PTC-100购自美国BIO-RAD公司;实时荧光定量PCR仪StepOne Plus购自美国Applied Biosystem公司。
1.3 方法
1.3.1 实验分组及处理 A549/DDP细胞分为对照组、PJ34单药组、PJ34联合顺铂组,PJ34组分为0、3、6、12、24 mg/L 5个浓度梯度,分别处理24 h,另取浓度为3 mg/L的PJ34分别处理24、48、72 h;PJ34联合顺铂组给予3 mg/L PJ34+11 mg/L顺铂处理24 h,A549细胞作为对照组。每个处理组实验重复3次。
1.3.2 RNA提取和定量测定 步骤包括:①取处理完毕后各组细胞,吸出培养液,6孔板每孔内加入1 ml TRIzol消化,然后移入无RNA酶的EP管中,室温孵育5 min;②1 ml TRIzol中加入0.2 ml氯仿,剧烈晃动15 s,室温孵育2~3 min;③4℃、12 000 r/ min离心15min,溶液分为无色上清水相、中间层(膜状蛋白)、下层红色苯酚氯仿层;④吸取上层无色水相至另一无RNA酶的EP管中,加入500 μl异丙醇,4℃、12 000 r/min离心10 min(RNA,附着于管底);⑤移除上清液,加入1 ml 75%乙醇溶液,简单振荡,4℃、7 500 r/min离心5 min,弃上清液;⑥空气干燥5~10 min,加入20~50 μl ddH2O重悬RNA;⑦55~60℃水浴10~15 min;⑧测RNA浓度及纯度;⑨直接进行逆转录或储存于-80℃冰箱中备用。
1.3.3 逆转录合成cDNA 依据试剂盒说明书进行操作,总RNA量为1.5 μg,总反应体积20 μl,反应条件;25℃、10 min,37℃、120 min,85℃、5 min,逆转录产物直接进行PCR扩增或储存于-20℃的冰箱内备用。
1.3.4 PCR扩增 GAPDH、LRP、MRP、P-gp、GST-
π、TOPO-Ⅱα引物由上海生工生物公司合成,GAPDH作为内参,其基因序列见表1。QRT-PCR反应体系20 μl,包括SYBR Select Master Mix 10 μl,上下游引物各1 μl,cDNA模板1 μl,ddH2O 7 μl。反应参数设置:50℃保温2 min,95℃预热2 min,95℃变性15 s,60℃退火延伸1 min,40个循环。通过2-ΔΔCT法分析基因的相对表达量。

表1 基因引物序列
1.4 统计学处理 采用SPSS 17.0软件进行分析,上述数据均重复3次,试验数据均以±s表示。计量资料组间比较采用t检验,多组间比较采用单因素方差分析。图表在GraphPad Prism 5.0中生成。
2 结果
2.1 A549/DDP细胞耐药相关基因PCR反应PCR反应扩增曲线见图1。
2.2 A549与A549/DDP细胞间耐药相关基因表达 A549/DDP及A549细胞内LRP、MRP、P-gp、GST-π、TOPO-Ⅱα均有表达,但LRP、MRP、P-gp、GST-π在A549/DDP细胞内的表达水平明显高于A549细胞,差异有统计学意义(t=69.282,P<0.01;t=110.177,P<0.01;t=323.916,P<0.01;t =258.287,P<0.01),TOPO-Ⅱα在两种细胞内的表达差异无统计学意义(F=4.117,P>0.05),见图2。
2.3 PJ34对A549/DDP细胞内耐药相关基因表达的影响

图1 PCR扩增曲线
2.3.1 PJ34对A549/DDP细胞内耐药相关基因表达的量效关系 取对数生长期的A549/DDP细胞,加入不同浓度(0、3、6、12、24 mg/L)PJ34处理24 h后,A549/DDP细胞内MRP表达水平下降,差异有统计学意义(F=1 756.279,P<0.05),P-gp表达水平下降,差异有统计学意义(F=1 865.031,P<0.05),且二者呈明显的浓度依赖性,而LRP、GST-π、TOPO-Ⅱ表达量随PJ34浓度的增加未见明显变化,见图3。
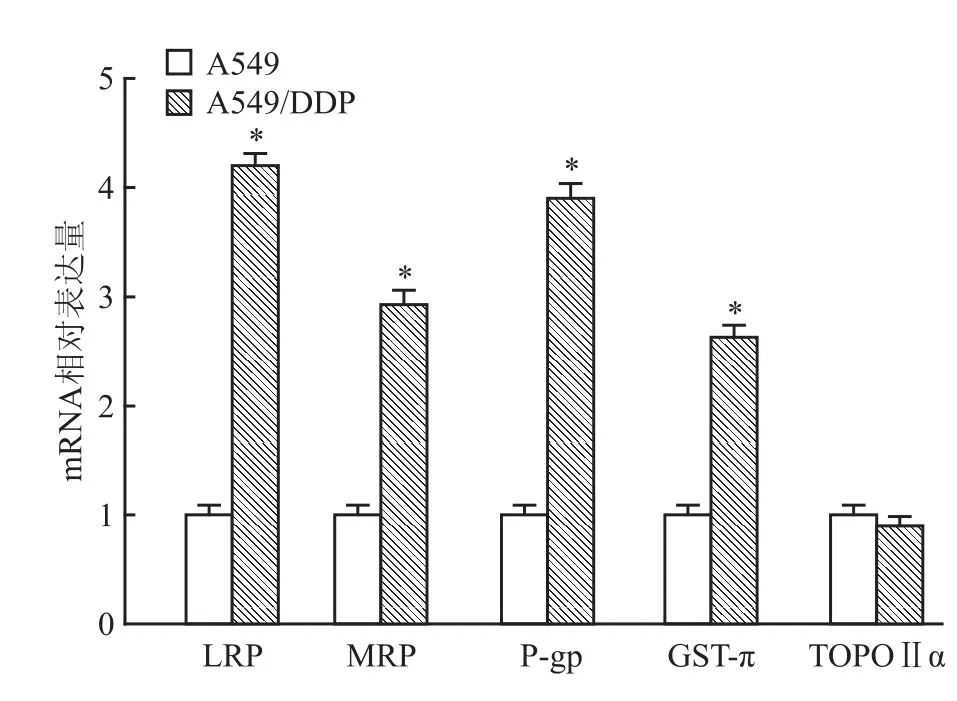
图2 A549细胞与A549/DDP细胞耐药相关基因表达的差异

图3 PJ34对A549/DDP细胞内耐药相关基因表达的量效关系
2.3.2 PJ34对A549/DDP细胞内耐药相关基因表达的时效关系 取对数生长期的A549/DDP细胞,加入3 mg/L的PJ34分别处理24、48、72 h后,A549/DDP细胞内MRP表达量随给药时间的延长逐渐下降,差异有统计学意义(F=2 119.237,P<0.05),P-gp表达量随给药时间的延长逐渐下降,差异有统计学意义(F=2 639.624,P<0.05),呈明显的时间依赖性,而LRP、GST-π、TOPO-Ⅱα表达量随时间延长未见明显变化,见图4。

图4 PJ34对A549/DDP细胞内耐药相关基因表达的时效关系
2.3.3 PJ34联合顺铂后A549/DDP细胞内MRP、P-gp mRNA水平的变化 取对数生长期的A549/ DDP细胞,分为对照组、顺铂(11 mg/L)单药组、PJ34(3 mg/L)单药组及PJ34(3 mg/L)联合顺铂(11 mg/L)组,结果显示:PJ34单药组较对照组MRP mRNA水平降低,差异有统计学意义(t=83.563,P<0.05),P-gp mRNA水平降低,差异有统计学意义(t=79.315,P<0.05);PJ34联合顺铂组较顺铂单药组MRP mRNA水平降低,差异有统计学意义(t= 74.253,P<0.05),P-gp mRNA水平降低,差异有统计学意义(t=69.969,P<0.05),PJ34单药组较PJ34联合顺铂组MRP、P-gp mRNA水平未见明显变化。见图5。
3 讨论
LRP是人类穹窿体的重要组成部分,其参与阿霉素、长春新碱、顺铂等多种药物的耐药。研究[6]显示LRP高表达的非小细胞肺癌患者较低表达患者对顺铂的敏感性降低。MRP是一种ATP依赖性膜转运蛋白,其在肺癌的继发耐药中起重要作用,参与非小细胞肺癌对顺铂的继发耐药[7]。P-gp是ATP结合转运蛋白家族的主要成员之一,其可作为肺腺癌对顺铂产生耐药性的一个预测因子[8]。GST-π属于Ⅱ相代谢酶,与多种肿瘤的化疗耐药密切相关。非小细胞肺癌细胞株GST-π mRNA水平高于小细胞肺癌细胞株,导致小细胞肺癌比非小细胞肺癌细胞株对顺铂更敏感,对顺铂耐药的非小细胞肺癌患者中GST-π的表达明显增高[9]。TOPO-Ⅱ是催化DNA结果的基本核酶,细胞内TOPO-ⅡmRNA水平及活性与以其为靶点的相关药物的耐药密切相关,TOPO-Ⅱ的表达增加可增加肺癌细胞对表柔比星的敏感性,TOPO-Ⅱ表达下降,肺癌细胞对VP-16的敏感降低。本实验研究显示LRP、MRP、P-gp、GST-π mRNA在A549/DDP细胞内的水平明显高于A549细胞,提示LRP、MRP、P-gp、GST-π在肺腺癌对顺铂的继发耐药中发挥重要作用,这与上述研究结果一致,而TOPO-ⅡαmRNA在两种细胞内未见明显差异,与肺腺癌对顺铂的继发耐药无关,这可能因为顺铂为非TOPO-Ⅱ靶点药物。
PARP-1是PARP家族中含量最多、功能最重要的亚型。目前,国内外将PARP-1作为疾病治疗的新靶点,已研制出多种PARP-1抑制剂,并显示出良好的治疗效果。PARP-1抑制剂增强ERCC1低表达的非小细胞肺癌对顺铂的敏感性,在顺铂耐药的睾丸生殖细胞肿瘤中也显示出来良好的治疗效果[10-11]。PJ34是新一代选择性PARP-1抑制剂,较传统PARP抑制剂,无论口服还是注射都显示出较高的生物利用度。研究[12]显示在急性创伤性脑损伤,PJ34维持血脑屏障的完整性,减轻脑组织水肿及炎症反应。PJ34还可通过降低FANCD2、BRCA2和RAD51蛋白和mRNA表达水平,下调FA/BRCA通路活性增加对骨髓瘤细胞的杀伤作用,部分逆转对美法兰的耐药[13]。本研究结果显示,PJ34可降低多药耐药相关基因MRP、P-gp的表达水平,并且具有浓度及时间依赖性。PJ34联合顺铂组与单药顺铂组比较表现出协同降低MRP、P-gp的表达水平,差异有显著性,而与单药PJ34比较未见明显差异,推测其可能原因为顺铂作为细胞周期非依赖性化疗药物其主要作用机制为直接诱导细胞DNA的损伤,对细胞内MRP、P-gp的表达无影响。
综上所述,本研究提示A549细胞顺铂继发耐药与LRP、MRP、P-gp、GST-π过表达相关,PJ34可通过下调MRP、P-gp mRNA的水平,部分逆转A549/ DDP对顺铂的耐药。这为PJ34在铂类耐药非小细胞肺癌患者的应用提供一定的理论基础。
[1] Torre L A,Bray F,Siegel R L,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] Rajesh M,Mukhopadhyay P,Godlewski G,et al.Poly(ADP-ribose)polymerase inhibition decreases angiogenesis[J].Biochem Biophys Res Commun,2006,350(4):1056-62.
[3] 姚圆圆,郝吉庆.PJ34对肺腺癌顺铂耐药细胞增殖及耐药性的影响[J].中国药理学通报,2015,31(6):865-70.
[4] Wang J,Zhang J,Zhang L,et al.Expression of P-gp,MRP,LRP,GST-π and TopoIIα and intrinsic resistance in human lung cancer cell lines[J].Oncol Rep,2011,26(5):1081-9.
[5] 喻龙姗,张开光.胃癌多药耐药机制的研究进展[J].安徽医科大学学报,2013,48(4):449-52.
[6] Zurita A J,Diestra J E,Condom E,et al.Lung resistance-related protein as a predictor of clinical outcome in advanced testicular germ-cell tumours[J].Br J Cancer,2003,88(6):879-86.
[7] Ikuta K,Takemura K,Sasaki K,et al.Expression of multidrug resistance proteins and accumulation of cisplatin in human nonsmall cell lung cancer cells[J].Biol Pharm Bull,2005,28(4):707-12.
[8] Inoue Y,Gika M,Abiko T,et al.Bcl-2 overexpression enhances in vitro sensitivity against docetaxel in non-small cell lung cancer[J].Oncol Rep,2005,13(2):259-64.
[9] Hirano T,Kato H,Maeda M,et al.Identification of postoperative adjuvant chemotherapy responders in non-small cell lung cancer by novel biomarker[J].Int J Cancer,2005,117(3):460-8.
[10]Cheng H,Zhang Z,Borczuk A,et al.PARP inhibition selectively increase sentivity to cisplatin in ERCC1-low non-small cell lung cancer[J].Carcioenesis,2013,34(4):739-49.
[11]Cavallo F,Graziani G,Antinozzi C,et al.Reduced proficiency in homologous recombination underlies the high sensitivity of embryonal carcinoma testicular germ cell tumors to Cisplatin and poly(adp-ribose)polymerase inhibition[J].PLoS One,2012,7(12):e51563.
[12]Tao X,Chen X,Hao S,et al.Protective actions of PJ34,a poly(ADP-ribose)polymerase inhibitor,on the blood-brain barrier after traumatic brain injury in mice[J].Neuroscience,2015,291:26-36.
[13]Xiong T,Wei H,Chen X,et al.PJ34,a poly(ADP-ribose)polymerase(PARP)inhibitor,reverses melphalan-resistance and inhibits repair of DNA double-strand breaks by targeting the FA/ BRCA pathway in multidrug resistant multiple myeloma cell line RPMI8226/R[J].Int J Oncol,2015,46(1):223-32.
Effect of PJ34 on the expression
of multidrug resistance related gene in A549/DDP cells
Han Ke,Hao Jiqing
(Dept of Oncology,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
Objective To investigate the impact of PJ34 on human pulmonary carcinoma cell line A549/DDP-related multiple drug resistance genes.Methods A549/DDP cells were divided into 3 groups:negative control,DDP-treated group,PJ34-treated group,PJ34 and DDP-treated group.The mRNA transcription levels of LRP,MRP,P-gp,GST-π,TOPO-Ⅱα were quantified in each group by RT-PCR.Results The mRNA transcription levels of LRP,MRP,P-gp,GST-π in A549/DDP cells were significantly higher than those in the A549 cells(P<0.05). The mRNA transcription levels of MRP,P-gp in A549/DDP cells dramatically decreased in a time and dose-dependent manner after PJ34 treatment(P<0.05).Conclusion LRP,MRP,P-gp,GST-π are probably involved in secondary drug resistance of DDP in A549/DDP cells.PJ34 sensitizes DNA to DDP damage by indirectly downregulating mRNA levels of MRP and P-gp.
pulmonary adenocarcinoma;PARP-1 inhibitors;cisplatin;tolerance;multidrug resistance gene
R 734.2
A
1000-1492(2016)08-1128-05
时间:2016-6-22 14:44:58
http://www.cnki.net/kcms/detail/34.1065.R.20160622.1444.024.html
2016-04-19 接收
安徽省自然科学基金(编号:1308085MH142);安徽省对外科技合作计划项目(编号:1503062023)
安徽医科大学第一附属医院肿瘤内科,合肥 230022作者简介:韩 柯,男,硕士研究生;
郝吉庆,女,博士,副教授,主任医师,硕士生导师,责任作者,E-mail:ayfy_hjq@163.com111

