紫色红曲霉Mp-24高产Monacolin K发酵工艺响应面优化
Bedelkhan Almagul, 任 浩, 章 婷, 郑婕施, 韩肖飞, 蒋冬花
浙江师范大学 化学与生命科学学院,浙江 金华 321004
紫色红曲霉Mp-24高产Monacolin K发酵工艺响应面优化
Bedelkhan Almagul, 任 浩, 章 婷, 郑婕施, 韩肖飞, 蒋冬花*
浙江师范大学 化学与生命科学学院,浙江 金华 321004
将单因素实验结果与响应面法相结合,对高产Monacolin K的紫色红曲霉Mp-24菌株进行发酵工艺条件优化。通过摇瓶发酵对碳源、氮源、碳源含量、氮源含量、培养时间等进行单因素优化,确定Mp-24菌株摇瓶发酵适宜条件:乳糖为碳源、酵母膏为氮源、碳源含量7%、氮源含量2%、培养时间12 d,Monacolin K产量为167 mg/L。应用Box-Behnken中心组合试验设计建立数学模型,进行响应面分析优化发酵条件,结果显示最佳发酵工艺条件为:碳源(乳糖)8%,氮源(酵母膏)3%,培养时间11 d,在此条件下Monacolin K的含量达到247.8 mg/L,比优化前提高1.5倍。
紫色红曲霉; Monacolin K; 发酵工艺; 应面优化
莫纳可林K(Monacolin K)是控制胆固醇合成的抑制剂,是红曲霉菌种的次级代谢产物;它能抑制3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶(EC1.1.1.34)在胆固醇生物合成中转化为甲羟戊酸[1]。Monacolin K已经被描述为降低血清胆固醇含量的最有效的一类药物,并已报道可以减少心血管疾病和冠状动脉疾病患者的死亡率[2]。与传统固态发酵法相比,液态发酵法具有规模大、自动化程度高、人力成本低及生产过程中可以控制杂菌染菌的显著优点,近年来国内在 Monacolin K的研究和生产取得了一些进展,但是生产水平仍较低[3],目前Monacolin K市场价格居高不下也源于此。因此,如何提高Monacolin K的产量是目前国内外相关科研工作者解决的重要问题。响应面法(response surface methodology,RSM)可用于优化培养基配方和培养条件[4,5],提升发酵产品的产量;响应面法中的Box-Benhken实验设计已广泛地应用于发酵工艺优化,其中包括 Monacolin K的液态发酵工艺[6,7]。本文利用响应面中的Box-Benhken实验设计法,回归分析法对紫色红曲霉(Monascuspurpureus)Mp-24菌株液态发酵产Monacolin K的工艺条件进行了优化。
1 材料与方法
1.1 实验材料
1.1.1 菌株
紫色红曲霉(Monascuspurpureus)Mp-24菌株(以下称Mp-24菌株):为本实验室前期从红曲米中筛选到的高产Monacolin K的优良菌株。
1.1.2 培养基[8]
PDA培养基(%):马铃薯20、葡萄糖2、琼脂1.5,pH 5.5~6.0。用于Mp-24菌株的常规培养和活化。
麦芽汁琼脂培养基(%):麦芽汁2、琼脂2、蔗糖2、蛋白胨1,pH 5.5~6.0。用于Mp-24菌株的常规培养。
种子培养液(%):葡萄糖6、蛋白胨2、NaNO30.2、MgSO4.7H2O 0.1、KH2PO40.2,pH 5.5~6.0。用于Mp-24菌株的种子培养。
发酵培养液(%):乳糖7、酵母膏2、NaNO30.2、MgSO4.7H2O 0.1、KH2PO40.2,pH 5.5。用于Mp-24菌株的发酵培养。
1.2 实验方法
1.2.1 Mp-24菌株的培养[9]
菌株的活化培养:将所保存的菌种接种到PDA培养基上,28 ℃恒温活化培养6 d~7 d。再将PDA培养基上的菌种转接到麦芽汁琼脂培养基上,28 ℃恒温培养7 d~8 d。
菌株的种子液培养:500 mL三角瓶装200 mL种子培养液,将在麦芽汁琼脂培养基上培养7 d~8 d的菌落用打孔的方法取4个菌饼(直径0.6 cm)接入种子培养液中,26 ℃、100 r/min旋转式摇床上培养4 d,用作种子液。
菌株的液体发酵培养:250 mL 三角瓶装100 mL发酵培养液,将种子液按5%的体积接种到发酵培养液中,26 ℃、180 r/min旋转式摇床上培养12 d。
这个设备利用晶体管取代开关。与上述的装置一样,开启和关闭电压用来检测传感器的工况。与利用开关的装置一样,由发动机ECU提供一个5V电压给传感器,当晶体管打开或关闭时会产生端子电压的变化,ECU使用端子电压的变化来检测传感器的工况。另外,有些装置使用12V的电源。
1.2.2 Monacolin K含量测定
(1)样品处理:取发酵液1 mL,煮沸10 min,4 ℃,8 000 r/min离心10 min,上清液用HPLC法检测Monacolin K产量[10]。
(2)高效液相色谱法测定Monacolin K含量[11]:配制梯度浓度的Monacolin K标准品用下述色谱条件测定产量并绘制标准曲线。色谱条件:Agilent TC-C18液相色谱柱(250×4.6 mm,5 μm),A溶液为乙腈(0.45 μm有机相滤膜过滤),B溶液为pH 2.5的磷酸溶液(0.45 μm水相滤膜过滤)。检测波长λ=237 nm,流速1 mL/min,流动相为乙腈∶磷酸缓冲液(pH 2.5)=75∶25,进样体积20 μL,柱温27 ℃。得出相关系数高的标准曲线,HPLC法检测Monacolin K的标准曲线为:y=58.61x,相关系数R2=0.999 4,符合要求(图1)。发酵上清液用相同的色谱条件测定Monacolin K产量。
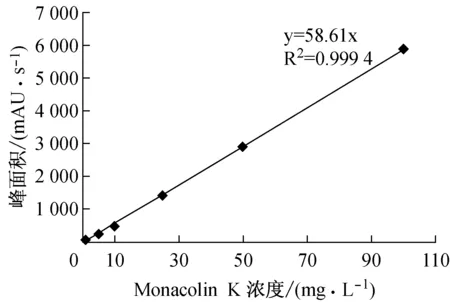
图1 Monacolin K标准曲线
1.2.3 单因素对Monacolin K产量影响的优化实验
Mp-24菌株26 ℃、180 r/min液体培养12 d,探讨培养基配方和培养条件对Mp-24菌株产Monacolin K的影响。① 碳源:葡萄糖、甘油、乳糖和蔗糖;② 氮源:黄豆粉、玉米粉、蛋白胨、酵母膏、硝酸钠和硫酸铵;③碳源含量:3%、4%、5%、6%、7%和8%;④氮源含量:1%、2%、3%、4%和5%;⑤ 培养时间:6 d、8 d、10 d、12 d和14 d。
实验设3次重复,发酵液用HPLC法检测Monacolin K产量。
1.2.4 Box-Behnken实验设计
在单因素优化实验的基础上选择碳源含量(%),氮源含量(%),培养时间(d)等因素作为考察对象,Monacolin K的产量为响应值,通过Box-Behnken[12]实验设计法筛选出产Monacolin K最高的条件因素。
1.2.5 响应面优化
本实验采用Stat-Ease Design-Expert 8.0.0中的Box-Bennken实验设计法。
2 结果与分析
2.1 红曲霉Mp-42菌株的鉴定
2.1.1 形态特征
Mp-24红曲霉菌株在麦芽汁琼脂培养基上30 ℃培养10 d的菌落见图2.A,表面平坦,菌丝短小,丝绒状,起初大部分呈浅红色,边缘呈淡黄色;培养10 d以后颜色变为深红色,背面无辐射纹(图2.B),中间为深红色,边缘为橘黄色,菌落直径达50 mm;显微镜观察下菌丝光滑,有隔膜(图2.C);分生孢子直径(7~8) μm近球形,单生或链状(图2.D);闭囊壳呈球形(图2.E),囊内孢子可见,直径(6~8) μm,无色或者淡黄色。
2.1.2 ITS基因序列和系统发育树
Mp-24菌株的ITS 基因序列分析结果见图3,其长度为556 bp,基于红曲霉属ITS序列建立的系统发育树如图4,与紫色红曲霉(Monascuspurpureus)的相似度最高,为99%。
2.1.3 Mp-24菌株鉴定结果

图2 Mp-24菌株的菌落(A,B)、菌丝(C)、分生孢子(D)及闭囊壳和子囊孢子(E)

图3 Mp-24菌株ITS基因序列(556 bp)

图4 基于14株红曲霉属ITS基因序列建立的
2.2 单因素优化Mp-24菌株发酵条件
以Monacolin K产量为指标,经单因素优化Mp-24菌株适宜的发酵条件为:碳源为乳糖、氮源为酵母膏、碳源含量7%、氮源含量2%、培养时间12 d,Monacolin K产量最高为167 mg/L(图5)。
2.3 响应面优化Mp-24菌株发酵条件
2.3.1 Box-Behnken试验设计和结果
实验中自变量为碳源含量(%)、氮源含量(%)和培养时间(d),分别用X1、X2、X3代表,每个自变量又有低、中、高水平编码值分别为-1、0、+1,发酵液中Monacolin K的产量为响应值。试验因素水平见表1,试验结果见表2。
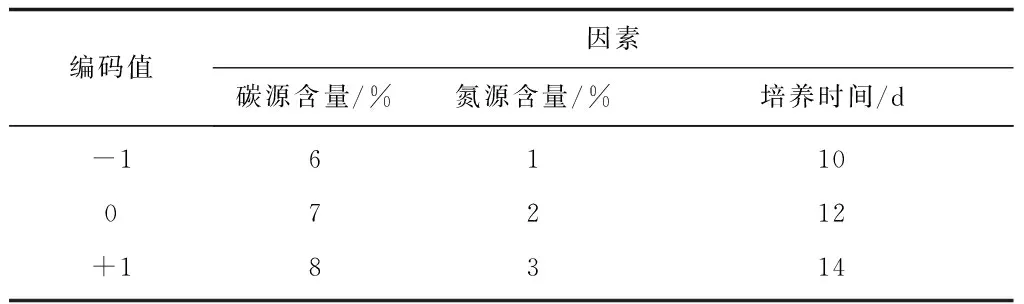
表1 Box-Behnken试验设计因子编码水平与取值表
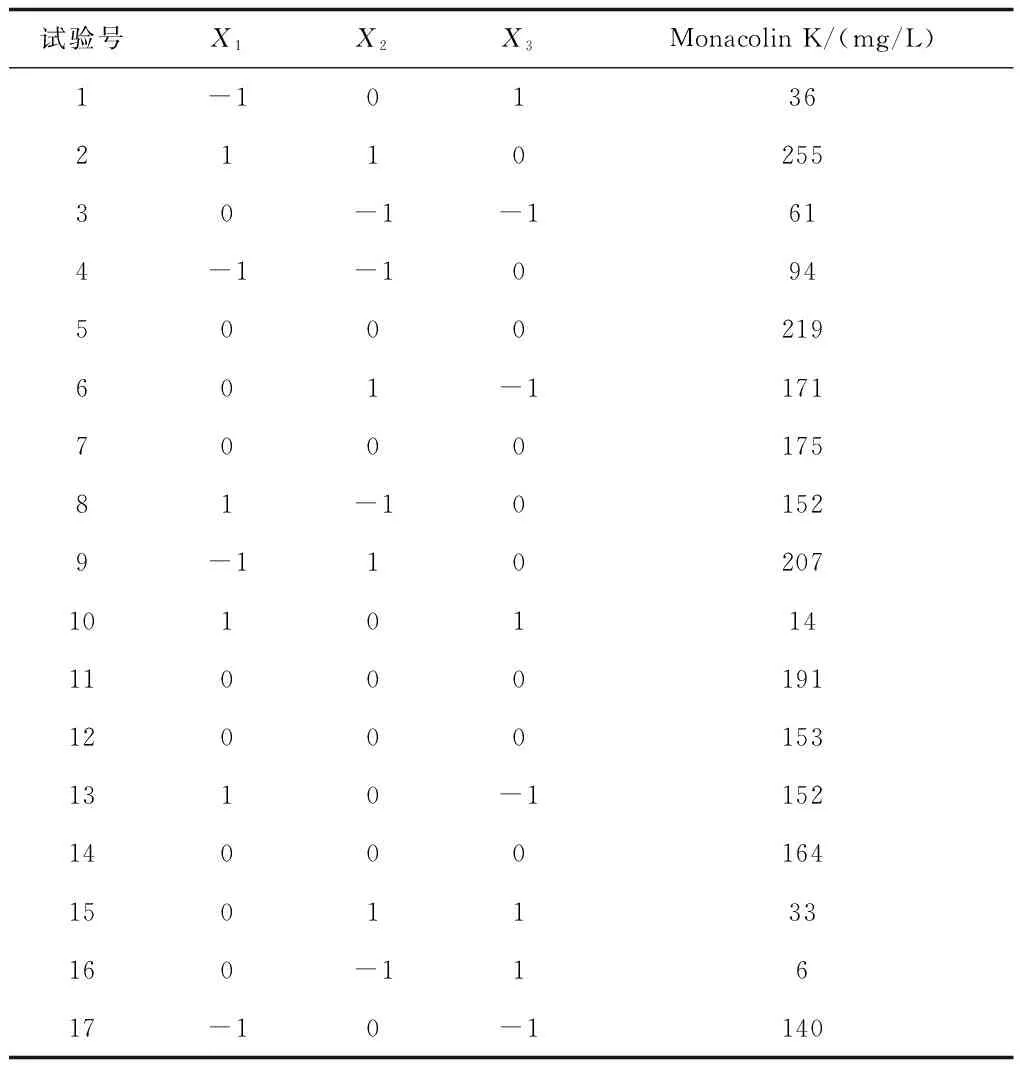
表2 Box-Behnken试验设计与结果

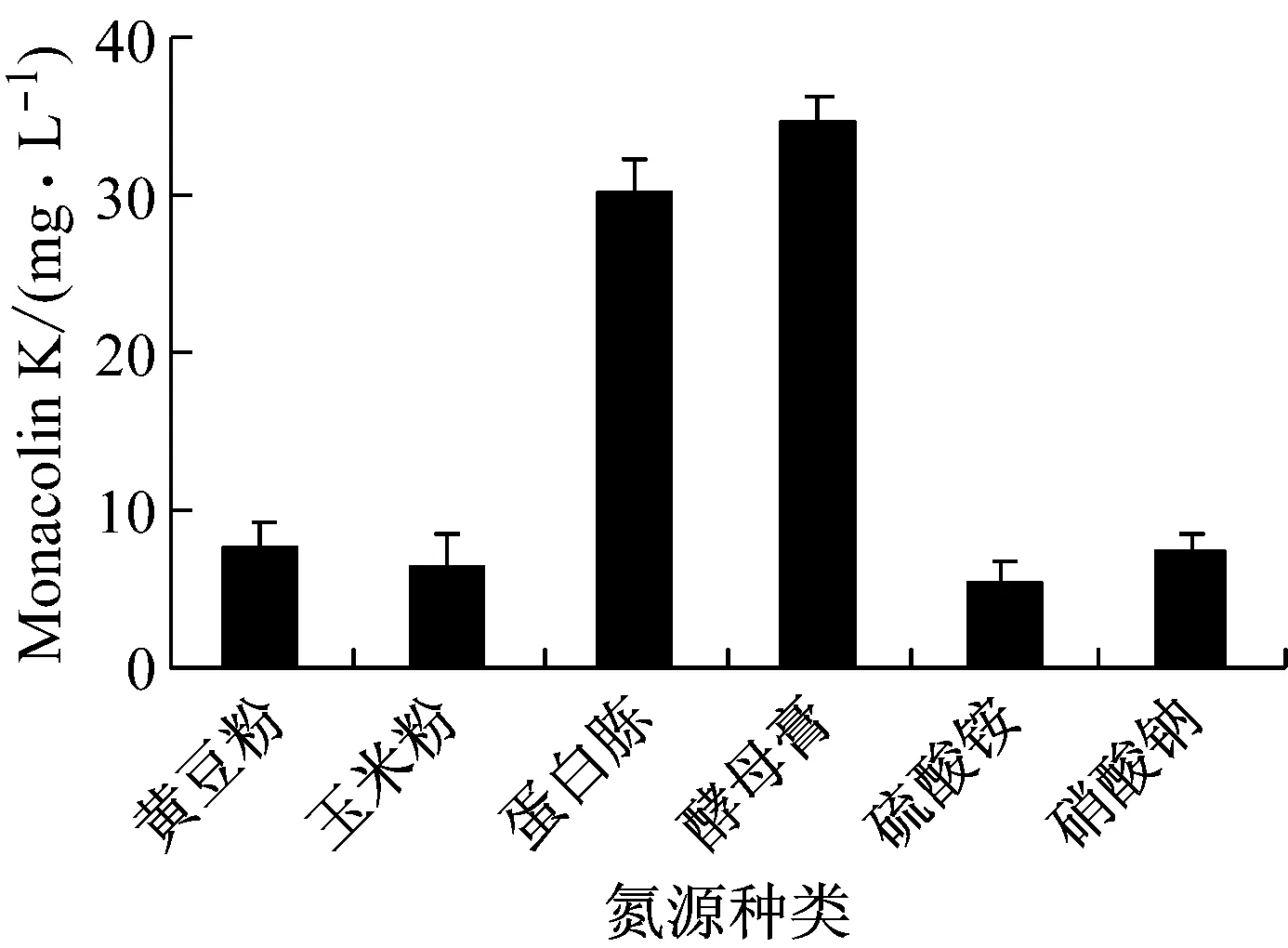



图5 培养基配方和培养时间对Mp-24菌株Monacolin K产生的影响
2.3.2 模型方程的建立与显著性检验
利用SAS8软件对表2中的试验结果进行二次线性回归拟合,得到数学模型:
Y1=180.4+12X1+44.13X2-54.38X3-2.50X1X2-8.50X1X3-20.75X2X3+7.18X12-10.57X22-102.07X32
由表3可知,该模型极显著(P<0.01),从表可知R2=0.941 7,说明该模型能解释94%响应值的变化,复相关系数R2Adj=0.866 6,进一步说明该模型拟合度较好,失拟合不显著(P>0.05),说明二次线性回归方程高度显著,对响应值能很好的进行预测[14]。一次项X2、X3表现为极显著,(P<0.01),说明它们对响应值有影响。从响应值F值可知,发酵条件对 Monacolin K质量浓度影响因素显著性顺序为:培养时间>氮源含量>碳源含量。
2.3.3 响应面分析图
响应图和等高线图由SAS8.1软件分析得出,可以直观反映出各个因素与响应值的交互作用,等高线图的形状可以反映出效应的强弱,如果高线图形状为椭圆形的,则证明自变量之间交互作用显著,圆形则为相反效应[15]。具体的响应图结果见图6~8。
从图6的响应面图与等高线图中可以看出,当固定培养时间为12 d,在1%~3%的氮源(酵母膏)含量试验水平范围内,Mp-24菌株中Monacolin K含量随着碳源(乳糖)浓度的增加呈先较少后增加趋势,当碳源(乳糖)浓度在7.5%~8%时Monacolin K的浓度为最高。在6%~8%碳源(乳糖)浓度试验水平范围内,Monacolin K含量随氮源(酵母膏)浓度的升高而先较少后增加,氮源的最适浓度区间在2.5%~3%。添加不同碳源与氮源含量从低到高时,Monacolin K的浓度则先较少后增加,从等高线图中因素轴向等高线变化密集度可知,氮源含量(%)对Monacolin K的影响高于碳源含量(%)。

表3 回归方程统计分析结果
注:**极显著(P<0.01); *显著(0.01 图6 碳源含量(X1)与氮源含量(X2)之间相互作用的响应面和等高线图 从图7的响应面图与等高线图中可以看出,当固定氮源(酵母膏)含量为2%,在6%~8%的碳源含量(乳糖)试验水平范围内,Mp-24菌株中Monacolin K含量随着培养时间的增加呈先上升后下降趋势,最适的培养时间在11 d~12 d。在10 d~14 d培养时间试验水平范围内,Monacolin K含量随碳源(乳糖)浓度的升高而先较低后增加,碳源的最适浓度区间在7.5%~8%。添加不同碳源与不同培养时间从低到高时,Monacolin K 的浓度则先上升后下降,从等高线图中因素轴向等高线变化密集度可知,培养时间对Monacolin K的影响高于碳源含量。 从图8的响应面图与等高线图中可以看出,当固定碳源(乳糖)含量为7%,在1%~3%的氮源含量(酵母膏)试验水平范围内,Mp-24菌株中Monacolin K含量随着培养时间的增加呈先上升后下降趋势,最适的培养时间在11 d~12 d。在10 d~14 d培养时间(d)试验水平范围内,Monacolin K含量随氮源(酵母膏)含量的增加而先较低后增加,氮源的最适含量区间在2.5%~3%。添加不同氮源含量与增加培养时间从低到高时,Monacolin K 的浓度则先较少后增加,从等高线图中因素轴向等高线变化密集度可知,培养时间对Monacolin K的影响高于氮源含量。 图7 碳源含量(X1)与培养时间(X3)之间相互作用的响应面和等高线图 图8 氮源含量(X2)与培养时间(X3)之间相互作用的响应面图与等高线图 2.3.4 模型结论 为确定最佳点,再对数学回归模型求一阶偏导,得出优化条件:X1=+12﹑X2=+44.13、X3=-54.38,此时Y1=260。利用编码公式将上述编码值转变为实际参数为:碳源含量8%、氮源含量3%、培养时间11.18 d,考虑实际操作性,调整确定优化工艺为:碳源含量8 g/mL(100 mL)、氮源含量3 g/mL(100 mL)、培养时间11 d,经验证实验,在此条件下发酵液的Monacolin K 质量浓度达到247.8 mg/L。在本实验条件下建立数学模型准确可靠,试验实际值和预测值拟合度较好。 通过对红曲霉发酵过程中各种条件进行优化,可以促进 Monacolin K产量的增加。国内外学者在这方面做了较多研究,从发酵过程中的培养基的组成到培养条件,均有相关报道。在培养基的配方上,国内外学者多从碳源、氮源、碳氮含量等因素进行研究;在培养条件的优化上,从发酵时间、初始 pH、摇瓶转数、装液量等因素进行研究,Monacolin K的产量均有提高。 本实验通过单因素试验获得适宜发酵条件为:乳糖7%,酵母膏2%,培养时间12 d,通过单因素实验与响应面法结合可以进一步有效的优化Mp-24菌株液态发酵产Monacolin K 的工艺条件。响应面优化后的发酵条件为:乳糖8%、酵母膏3%、培养时间11 d,在此条件下Monacolin K的质量浓度达到:247.8 mg/L,比优化前提高1.5倍。方春玉等[16]的研究结果:最佳发酵条件碳源(甘油)为7%,氮源含量(酵母膏)为3%,培养时间为14 d,Monacolin K 产量达到了245 mg/L;张朝晖等[17]对1株不产桔霉素的紫色红曲霉菌株,在2 L的发酵罐中,利用添加了酵母膏的葡萄糖-甘油培养基,在第13 d的Monacolin K产量可达104 mg/L。胡文效等[18]对1株红曲霉菌株MS-12进行三次诱变,结合液态发酵各因素的优化结果,当碳源为甘油7%+大米粉2%和氮源为0.5%的蛋白胨,培养时间则为12 d,Monacolin K的质量浓度为264.7 mg/L。 本实验获得最佳发酵条件为:碳源(乳糖)含量8%,氮源(酵母膏)含量为3%,培养时间为11 d,在此条件下得到的Monacolin K的质量浓度与方春玉[16]等和胡文效等[18]的研究结果相接近。本实验应用Box-Behnken中心组合试验设计和响应面分析优化发酵条件获得最佳发酵工艺条件为:碳源8%,氮源3%,培养时间11 d,在此条件下Monacolin K的含量达到了247.8 mg/L,丰富了Monacolin K生产的菌株资源。 [1] Seraman S, Rajendran A, Thangavelu V,etal. Statistical optimization of anticholesterolemic drug lovastatin production by the red moldMonascuspurpureus[J]. Food and bioproducts processing, 2010, 88(2-3): 266-76. [2] Veillard NR, Mach F. Statins: the new aspirin?[J]. Cellular & Molecular Life Sciences Cmls, 2002, 59 (11):1771-1786. [3] 杨超. 产Monacolin K红曲霉的诱变选育及发酵条件的研究[D]. 芜湖: 安徽工程大学, 2014, 15-25. [4] Xiao ZJ, Liu PH, Qin JY,etal. Statistical optimization of medium components for enhanced acetoin production from molasses and soybean meal hydrolysate[J]. Applied Microbiology & Biotechnology, 2007, 74(1): 61-68. [5] 王永菲, 王成国. 响应面法的理论与应用[J]. 中央民族大学学报(自然科学版), 2005, 14(3): 236-240. [6] 童振宇, 周立平, 陈旭峰. 响应面法优化红曲霉菌株MonacuspurpureusWX液态发酵产Monacolin K工艺条件[J]. 浙江工业大学学报, 2007, 35 (1): 35-40. [7] 邱源, 周立平, 嘉晓勤. 红色红曲菌液态发酵产Monacolin K重要影响因素的研究[J]. 酿酒科技, 2010 (5): 47-50. [8] 黄群, 麻成金, 余佶. 产Monacolin K红曲霉筛选及响应面法优化发酵条件[J].食品科学, 2011, 32 (21): 177-182. [9] Yu LJ, Zhang HX, Xie YH,etal. Optimazation of fermentation conditions for higher Monacolin K production byMonascuspurpureus[J]. Advanced Materials Research, 2013, 784(1): 397-402. [10] Feng YL, Shao YC, Zhou YX,etal. Monacolin K production by citrinin-freeMonascuspilosusMS-1 and fermentation process monitoring[J]. Enginnering in Life Sciences, 2014, 14(5): 538-545. [11] Tsukahara M, Shinzato N, Tamaki Y,etal. Red yeast rice fermentation by selectedMonascussp. with deep-red color, lovastatin production but no citrinin, and effect of temperature-shift cultivation on lovastatin production[J]. Applied Biochemistry and Biotechnology, 2009, 158(2): 476-482. [12] Feng YL, Shao YC, Zhou YX,etal. Production and optimization of monacolin K by citrinin-freeMonascuspilosusMS-1 in solid-state fermentation using non-glutinous rice and soybean flours as substrate[J]. European Food Research and Technology, 2014, 239(4): 629-636. [13] 李钟庆, 郭芳. 红曲菌的形态与分类学[M]. 北京: 中国轻工业出版社, 2003, 45-48. [14] Lu LP, Zhang BB, Xu GR,etal. Efficient conversion of high concentration of glycerol to monacolin K by solid-state fermentation ofMonascuspurpureususing bagasse as carrier[J]. Bioprocess and Biosystems Engineering, 2013, 36(3): 293-299. [15] Panda BP, Javed S, Ali M,etal. Optimization of fermentation parameters for higher lovastatin production in red mold rice through co-culture ofMonascuspurpureusandMonascusruber[J]. Food and Bioprocess Technology, 2010, 3(3): 373-378. [16] 方春玉, 周健, 黄丹等. 红曲霉液态发酵产Monacolin K发酵条件的优化[J]. 中国调味品, 2016, 41(6): 44-49. [17] 张朝晖, 王圆, 周立平等. 不产桔霉素的红曲霉菌种深层发酵生产莫纳可林K[J]. 工业微生物, 2005, 35(4): 1-5. [18] 胡文效, 魏彦峰, 蒋锡龙等. 高产Monacolin K红曲霉菌种的诱变选育及液态发酵工艺优化[J]. 食品工业科技, 2013, 34(24): 296-301. Optimizing fermentation conditions of high-yielding Monacolin K byMonascuspurpureusstrain Mp-24 using response surface methodology Bedelkhan Almagul, REN Hao, ZHANG Ting, ZHENG Jie-shi, HAN Xiao-fei, JIANG Dong-hua College of Chemistry and Life Science, Zhejiang Normal University, Jinhua 321004 Response surface methodology and single factor experiment were combined to optimize the submerged culture conditions for the production of Monacolin K usingMonascuspurpureusstrain Mp-24. Through analyzing the influence of carbon sources, nitrogen sources, carbon content, nitrogen content and culture time, the results showed that optimal fermentation conditions were as follows: lactose(carbon source), yeast extract(nitrogen source), carbon content of 7%, nitrogen content of 2% and culture time of 12 d. Monacolin K yield was 167 mg/L. After using Box-Behnken central composite design and response surface analysis, the optimum conditions were: carbon (lactose) of 8%, nitrogen (yeast extract) of 3% and culture time of 11 d. Under the optimized conditions, the content of Monacolin K reached 247.8 mg/L. The optimized fermentation conditions resulted in 1.5 times increase of Monacolin K yield in comparison with that of the original conditions. Monascuspurpureus; Monacolin K; fermentation conditions; response surface methodology 国家自然科学基金项目(NO. 31270061; NO. 31570013)。 Bedelkhan Almagul(1989~), 女, 哈萨克斯坦人, 在读研究生,研究方向为应用微生物。 *通讯作者:蒋冬花(1964~),女,教授。E-mail: jdh@zjnu.cn。





3 讨论与结论

