产共轭亚油酸菌株的筛选及其等离子体诱变
孙丽慧, 王庆山, 赵淑艳, 修志龙
1. 大连理工大学食品与环境学院, 辽宁盘锦 124221;2. 大连理工大学生命科学与技术学院, 辽宁大连 116024
产共轭亚油酸菌株的筛选及其等离子体诱变
孙丽慧1, 王庆山1, 赵淑艳1, 修志龙2
1. 大连理工大学食品与环境学院, 辽宁盘锦 124221;2. 大连理工大学生命科学与技术学院, 辽宁大连 116024
本实验从东北酸菜汁中筛选获得了一株产共轭亚油酸能力较好的菌株SC-05,特别是气相色谱分析结果表明,合成的CLA产物构型为单一构型,仅为c9, t11-18:2-CLA,经鉴定该菌为乳杆菌属Lactobacillussp.。菌株SC-05经低温等离子体处理后,筛选出突变株A-08,其共轭亚油酸产量达到119.24 μg/mL,比出发菌株增加了83.0%,且突变株A-08具有较好的遗传稳定性。
共轭亚油酸; 筛选; 乳杆菌属; 等离子体诱变
共轭亚油酸(Conjugated linoleic acid, CLA)是一系列含有共轭双键的十八碳脂肪酸的总称[1]。CLA的立体异构体多达几十种,其中c9, t11-18:2和t10, c12-18:2两种异构体被认为最具有生物活性,如抗癌、抗动脉粥状硬化和促进细胞分裂、阻止肌肉退化、延缓机体免疫力衰退等[2-4],而且c9, t11-18:2是唯一能被动物细胞吸收进入磷脂层的异构体[5]。
目前工业上普遍采用化学法合成CLA,如碱异构化法、过渡金属元素催化法和羟基脂肪酸脱水法等[6]。然而化学合成法虽然转化率高、产量高,但是合成的产物是十几种CLA异构体的混合物,特别是其中的 t, t 异构体对人体有害。相比而言,利用微生物合成CLA具有较好的选择性,产物构型多为c9, t11-18:2和t10, c12-18:2两种异构体的混合物,产品的安全性较高,因此近年来备受关注[7-9]。
本实验从东北酸菜汁中筛选得到一株能够合成CLA的微生物菌株,对产物采用气相色谱法进行分析,结果表明产物构型仅存在c9, t11-18:2-CLA,经16S rDNA基因序列分析,确定该菌株为乳杆菌属Lactobacillus,将其命名为Lactobacillussp. SC-05,并利用低温等离子体对该菌株进行诱变,提高了CLA产量。
1 材料与方法
1.1 材料
1.1.1 菌株
Lactobacillussp. SC-05,由本实验室从东北酸菜汁中分离得到。
1.1.2 培养基
增殖培养基(%):牛肉膏 2,蛋白胨 2,酵母膏 1,葡萄糖 5,麦芽糖 2,调节pH至6.8。MRS液体培养基(%):牛肉膏 1,蛋白胨 1,酵母膏 0.5,葡萄糖 2,乙酸钠 0.5,磷酸氢二钾 0.2,柠檬酸铵 0.2,硫酸镁 0.02,硫酸锰 0.02,吐温80 0.05,调节pH至6.8。MRS固体培养基(%):在MRS液体培养基中加入琼脂 1.5。平板筛选培养基(%):在MRS固体培养基中加入溴甲酚紫 0.04。
1.1.3 主要试剂
亚油酸、共轭亚油酸、亚油酸甲酯、共轭亚油酸甲酯(c9, t11-CLAMe和t10, c12-CLAMe)标准品(纯度≥99.9%)美国圣路易斯Sigma公司;亚油酸(纯度≥95),安庆市中创生物工程有限公司;酵母膏、牛肉膏、蛋白胨、琼脂为生化试剂,北京奥博星生物技术公司;其它试剂为分析纯。
1.2 菌株的分离与筛选
从酸奶、鲜牛奶、东北酸菜汁、四川泡菜汁、活性污泥浸出液中取样适量,分别加入至增值活化培养基中37 ℃培养24 h。采用梯度稀释后将适宜浓度的菌悬液涂布于溴甲酚紫平板筛选培养基上,37 ℃培养48 h。分选出黄色菌圈较大的菌落并将其接种于MRS液体培养基中培养24 h。发酵结束后,发酵液用2倍体积正己烷萃取并用蒸馏水洗涤2次,无水硫酸钠吸水干燥得到待测样品,以未接入菌种且其他步骤和条件一致所得的正己烷萃取液为参比,利用紫外分光光度计测定波长在233 nm下吸光度,根据CLA-吸光度标准曲线方程求出CLA产量,筛选高产CLA菌株。
1.3 分析测定
产物的测定:将脱水后的脂肪酸萃取物加入体积分数3%的硫酸-甲醇溶液,70 ℃反应2 h,再用2倍体积正己烷萃取脂肪酸甲酯,正己烷层水洗3次,无水硫酸钠干燥,氮气吹干,采用气相色谱(Agilent 7890A)检测;色谱条件如下:色谱柱:安捷伦HP-5MS毛细管柱(30 m×250 μm×0.25 μm);柱温程序:100 ℃保持2 min,以10 ℃/min升至300 ℃,保持5 min;进样量0.6 μL;分流比50∶1;进样口温度300 ℃。
菌株的鉴定:挑取培养基上的菌体于50 μL TaKaRa Lysis Buffer for Microorganism to Direct PCR(Code No.9164)中变性后离心取上清作为模板,反应条件:80 ℃,15 min;然后使用TaKaRa 16S rDNA Bacterial Identification PCR Kit(Code No.RR176)进行PCR扩增目的片段;经琼脂糖凝胶电泳后,切胶回收目的片段;由大连宝生物工程有限公司进行测序,在NCBI数据库中BLAST检索已有菌株的16S rDNA序列,用MEGA4.0软件构建进化树。
1.4 低温等离子体诱变
对筛选获得的菌株SC-05采用多功能诱变系统(MPMS-MANDELA,北京伟恩思技术有限公司)进行低温等离子体处理。首先将菌体培养至指数生长期,然后用无菌生理盐水稀释至OD600为1.0,吸取菌悬液15 μL均匀覆盖于无菌皿槽底面,制成菌膜,然后用低温等离子体诱变系统处理适当时间。诱变条件:载气流量12 SLM(Standard liters per minute),射频功率100 W,处理距离5 mm,处理温度为室温。诱变处理后的载片用1.5 mL无菌生理盐水彻底洗下菌体,经适当稀释后均匀涂布到MRS固体培养基平皿中,37 ℃培养48 h。
2 结果与讨论
2.1 CLA产生菌株的分离与筛选
按照1.2中的方法,从几种样品中分离纯化菌株,共分离出78株菌株。利用紫外分光光度计测定发酵液样品在波长233 nm下吸光度。经过初筛,共获得10株能够转化亚油酸生成CLA的菌株,采用摇瓶发酵对菌株进行复筛,并利用1.3中的气相色谱的分析方法检测发酵液中CLA的组成和含量,最终筛选获得4株产CLA的能力较好的菌株,其中3株来自酸菜样品(SC-05、SC-07、SC-13),1株来自鲜牛乳样品(XR-04),其中菌株SC-05产CLA的能力最好,产量为65.16 μg/mL,特别是气相色谱分析结果表明,SC-05合成的CLA产物构型为单一构型,仅为c9, t11-18:2-CLA。c9, t11-18:2是唯一能被动物细胞吸收进入磷脂层的异构体,也是与人类和动物营养最为相关、最具有生物活性的异构体[5]。而目前文献报道的利用微生物合成CLA产物构型多为c9, t11-18:2和t10, c12-18:2两种异构体的混合物[7,8,10-12]。利用生物合成法得到相对单一异构体的 CLA,产品的安全性更高,其作用的保健功能和适用人群更有针对性,有着更为重要的研究价值和意义。因此,本实验后续以菌株SC-05为进一步研究的对象。
2.2 细胞形态特征
溴甲酚紫MRS固体培养基菌落培养特征:菌落较小、凸起、呈圆形、边缘整齐、湿润光滑、黄色不透明(图1a所示)。光学显微镜下观察细胞形态特征:细胞呈杆状,单个、成对或成链状,G+(图1b所示)。

图1a SC-05菌落照片
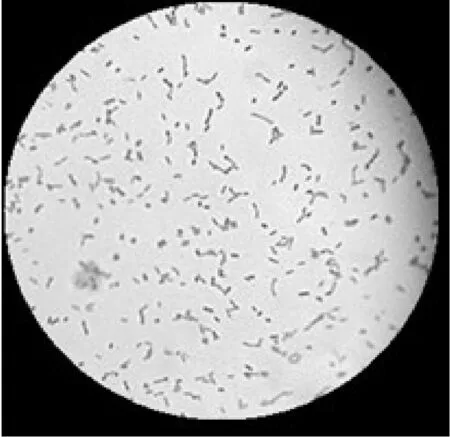
图1b SC-05菌株显微镜照片(1 000×)
2.3 菌种鉴定
测序结果表明,菌株SC-05的16S rDNA全长为1 451 bp,该序列已提交至Genbank,登记号为No. KT159284。将该序列与Genbank中相关数据进行相似性分析,用MEGA4.0软件构建系统发育树(图2)。基于16S rDNA序列分析和构建系统发育树分析可以看出,菌株SC-05与乳杆菌属Lactobacillus亲缘关系较近,序列相似性达到99%。

图2 基于16S rDNA全序列的系统发育树
2.4 低温等离子体诱变选育
2.4.1 低温等离子体处理存活曲线的测定
按照1.4的方法对菌株SC-05进行低温等离子体处理,以时间为变量,测定其存活曲线,结果如图3所示。当处理时间在80 s之前菌体存活率一直在下降,90 s、100 s时存活率出现增加的现象,100 s之后存活率再次下降,整个存活曲线呈现先降后升再降的“马鞍型”曲线变化,这与文献报道的现象一致[13,14]。“马鞍型”曲线产生的机理可能是由于等离子体中的大量自由基和射线对胞内蛋白和核酸产生破坏作用,从而导致细菌逐渐死亡,但当存活率下降到一定程度时,细菌机体启动自身的修复机制,如SOS系统,导致存活率回升,随着等离子体的继续作用,其破坏作用超过细胞的自身修复速率,存活率再次下降,直至存活率为零[14-16]。通常理论认为当致死率为70%~80%时最有利于菌株发生较大的正突变率,因此确定30 s作为最佳诱变时间。

图3 植物乳杆菌SC-05在等离子体处理不同
2.4.2 共轭亚油酸高产菌株的筛选
共挑取SC-05的诱变单菌落60个分别进行发酵转化实验,结果出现正突变的菌株有23株,其中A-08、A-22、B-06和B-11四个菌株的正突变幅度大于20%,如图4所示,共轭亚油酸产量最高的突变株是A-08,其产量达到119.24 μg/mL,比出发菌株增加了83.0%。

图4 正突变菌株产量
2.4.3 突变株A-08遗传稳定性实验
诱变选育的突变菌株在连续传代过程中可能会出现遗传不稳定的现象[17]。为考察突变株A-08的遗传稳定性,对菌株进行12代传代培养,结果如图5所示。结果表明,突变株A-08具有较高的遗传稳定性。

图5 突变株A-08的遗传稳定性
3 结论
本实验从东北酸菜汁中筛选获得1株产CLA能力较好的菌株SC-05,特别是GC结果表明,SC-05合成的CLA产物构型为单一构型,仅为c9, t11-18:2-CLA。利用生物合成法得到相对单一异构体的 CLA,产品的安全性更高,其作用的保健功能和适用人群更有针对性。通过对其16S rDNA序列测序及分析,发现与乳杆菌属Lactobacillus亲缘关系较近,序列相似性达到99%。菌株SC-05经低温等离子体处理后,筛选出突变株A-08,其共轭亚油酸产量达到119.24 μg/mL,比出发菌株增加了83.0%,且突变株A-08具有较好的遗传稳定性。该菌株可以通过进一步菌种选育及经过发酵工艺优化,预计共轭亚油酸产量会有较大的提升潜力。
[1] Irmak S, Dunford NT, Gilliland SE,etal. Biocatalysis of linoleic acid to conjugated linoleic acid [J]. Lipids, 2006, 41 (8): 771-776.
[2] Whigham LD, Cook ME, Atkinson RL. Conjugated linoleic acid: implications for human health [J]. Pharmacological Research, 2000, 42 (6): 503-510.
[3] Zhao HW, Lv JP, Li SR. Production of conjugated linoleic acid by whole-cell ofLactobacillusplantarumA6-1 [J]. Biotechnology and Biotechnological Equipment, 2011, 25(1):2266-2272.
[4] 熊向峰, 陈朝银, 赵声兰. 亚油酸异构酶及其性质 [J]. 工业微生物, 2002, 32(4):51-58.
[5] 陈杭君, 陈丽敏, 郜海燕等. 共轭亚油酸的制备、纯化及检测方法研究进展 [J]. 中国食品学报, 2012, 12(5):137-143.
[6] Paiza MW, Yang XY. Method of production conjugated fatty acids [P]. US, 5856149. 1999-01.
[7] Wang LM, Lv JP, Chu ZQ,etal. Production of conjugated linoleic acid byPropionibacteriumfreudenreichii[J]. Food Chemistry, 2007, 103: 313-318.
[8] Lara G, Katleen R, Stefan W,etal. Production of conjugated linoleic acid and conjugated linolenic acid isomers byBifidobacteriumspecies [J]. Applied Microbiology and Biotechnology, 2010, 87: 2257-2266.
[9] 张中义, 胡锦蓉, 刘萍等. 一株产共轭亚油酸乳酸菌的鉴定及其特性 [J]. 工业微生物, 2004, 34(2):5-9.
[10] Ogawa J, Kishino S, Ando A,etal. Production of conjugated fatty acids by lactic acid bacteria [J]. Journal of Bioscience and Bioengineering. 2005, 100(4): 355-364.
[11] 陈海琴, 许庆炎, 叶强等. 植物乳杆菌 ZS2058 生物转化共轭亚油酸的反应动力[J]. 微生物学报, 2009, 49 (2) : 174-179.
[12] 许庆炎,陈卫,陈海琴等. 植物乳杆菌 ZS2058 生物转化产物共轭亚油酸的分析方法的研究 [J]. 食品与发酵工业, 2008, 34(1): 110-115.
[13] Montie TC, Wintenberg KK, Roth JR. An overview of research using the one atmosphere glow discharge plasma for sterilization of surfaces and materials [J]. IEEE Transactions on Plasma Science, 2000, 28(1): 41-50.
[14] 董晓宇, 李爽, 侯英敏等. 大气压冷等离子体诱变产1,3-丙二醇菌株Klebsiellapneumoniae[J].过程工程学报, 2008,8(3):555-560.
[15] 宋道军, 姚建铭, 邵春林等. 离子注入微生物产生“马鞍型”存活曲线的可能作用机制 [J]. 核技术, 1999, 22(3): 129-132.
[16] 沈萍, 陈向东. 微生物学(第2版) [B]. 北京: 高等教育出版社, 2006. pp223.
[17] Li HG, Luo W, Wang Q,etal. Direct fermentation of gelatinized cassava starch to acetone, butanol, and ethanol usingClostridiumacetobutylicummutant obtained by atmospheric and room temperature plasma [J]. Applied Biochemistry and Biotechnology, 2014, 172(7): 3330-3341.
SUN Li-hui1*, WANG Qing-shan1, ZHAO Shu-yan1, XIU Zhi-long2
1. School of Food and Environment, Dalian University of Technology, Panjin 124221, China;2. School of Life Science and Biotechnology, Dalian University of Technology, Dalian 116024, China
Screening and plasma mutagenesis of conjugated linoleic acid high-producing strain
The strain SC-05 with the ability of synthesize conjugated linoleic acid (CLA) was isolated from sauerkraut juice samples. According to gas chromatography analysis, c9, t11-CLA was the only product in the fermentation broth. This strain was identified asLactobacillussp., based on full-length 16S rDNA. The strain SC-05 was induced by low temperature plasma, and the mutant strain A-08 was obtained. The results revealed that the CLA production by the mutant strain A-08 could reach 119.24 μg/mL, raised 83.0% compared with that by the original strain. And the mutant strain A-08 also exhibited its good genetic stability.
conjugated linoleic acid; screening;Lactobacillus; plasma mutagenesis
大连理工大学基本科研业务费专项项目(DUT16QY31)。
孙丽慧(1977~),女,博士,副教授。Email:sunlihui@dlut.edu.cn。

