一种不对称水解(R,S)-2,6-二甲基苯基氨基丙酸甲酯的新酯酶基因的克隆表达和酶学性质研究
董剑鸣, 张利坤, 卢亚南, 姚星超, 杨玉莹, 陆跃乐, 张朝晖
浙江工业大学生物工程学院,杭州 310014
一种不对称水解(R,S)-2,6-二甲基苯基氨基丙酸甲酯的新酯酶基因的克隆表达和酶学性质研究
董剑鸣, 张利坤, 卢亚南, 姚星超, 杨玉莹, 陆跃乐, 张朝晖*
浙江工业大学生物工程学院,杭州 310014
本文将来自反硝化无色杆菌Achromobacterdenitrificans1104的酯酶基因EHest,转化大肠杆菌中,成功表达了具有不对称水解农药甲霜灵的中间体(R,S)-2,6-二甲基苯基氨基丙酸甲酯(MAP)活性的酯酶EHesterase。用重组酯酶EHesterase催化MAP的水解,底物浓度50 g/L,反应1h的转化率29.5%,产物(R-酸)的eep是85.1%。该酶的最适反应pH和温度分别为9.0和50 ℃,在50 ℃以下和pH5~9之间具有较好的稳定性。该酶水解MAP的米氏动力学参数Vm、Km分别是0.733 g/(L·min)和7.49 g/L。加入10%DMSO对酶EHesterase的立体选择性和催化速度有一定的促进作用。Cu2+、Fe3+对酶活有明显抑制作用。该酶水解MAP的活性与水解p-对硝基苯乙酸酯的活性数量级相当,是水解橄榄油活性的333倍。
反硝化无色杆菌; 酯酶; 克隆表达; (R,S)-2,6-二甲基苯基氨基丙酸甲酯; 酶学性质
利用生物催化剂生产手性物质具有条件温和、选择性高、污染少的优点。目前,利用脂肪酶/酯酶催化酯水解或羧酸酯化是常用的制备手性醇、酸和酯的方法,其中用脂肪酶催化的生物拆分法已发展为生产手性化学品的重要方法之一[1]。
(R,S)-2,6-二甲基苯基氨基丙酸甲酯(MAP)是甲霜灵、氯霜灵、呋霜灵、异霜灵和苯霜灵等杀菌剂的中间体。甲霜灵是典型的旋光活性农药[2],在体内,R-(-)-对映体的活性比S-(+)-对映体高3~10倍[3]。在国内市场上,甲霜灵的手性产品称为精甲霜灵(R体为主),它由化学法生产。
近年来,国内外报道的生物拆分法生产手性纯甲霜灵的方法,主要是对它的中间体(R,S)-2,6-二甲基苯基氨基丙酸甲酯(MAP)进行拆分,如图1所示。选择性拆分MAP的主要有:脂肪酶,如Lipase PS、Lipase OF、Lipase QLM[4]、Lipase CRL[5,6]、PSL[7,8]、CAL-B[8];碱性蛋白酶Alcalase以及酰基转移酶Acylase Amano[4];微生物催化剂,如Burkhloderiasp. MC16-3和99-2-1[9]。这些催化剂对底物的立体选择性有R型的(如Lipase PS),也有S型(如PSL)。上述催化剂中,对Lipase PS的研究比较透彻[4,10]。

图1 生物催化剂水解拆分(R,S)-2,6-二甲基苯基氨基丙酸甲酯(MAP)
在前期研究中,本实验室获得了一株对MAP具有较好的对映体选择性和催化活性的新菌株,鉴定为反硝化无色杆菌(Achromobacterdenitrificans),命名为Achromobacterdenitrificans1104。又通过基因文库法找到了该菌酯酶基因(命名为EHest)序列。本文利用基因工程技术将该基因在大肠杆菌中表达,并研究了重组酯酶EHesterase的酶学性质。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
反硝化无色杆菌Achromobacterdenitrificans1104由本实验室筛选得到,E.coliBL21Gold(DE3)plysS和pET-28a(+)由本实验室保藏。
1.1.2 试剂
限制性内切酶BamH I、XhoI 购于NEB;Ligation high Ver.2、KOD FX购于TOBOYO;DNA Marker DL2000、DNA Marker DL10000购于Takala;基因组抽提试剂盒,DNA凝胶回收试剂盒、PCR清洗试剂盒、质粒DNA小量提取试剂购于AxyPrep;(R,S)-2,6-二甲基苯基氨基丙酸甲酯(98%)由浙江某公司赠送。除非特别说明,其它试剂均为分析纯。
1.2 方法
1.2.1 酯酶基因的克隆及表达载体的构建
PCR扩增引物分别为:上游引物(GGAATTCATGCTGGCGCACGGCTCCT,EcoRI)和下游引物(CCCAAGCTTTCAGGACAGGCCCAGCAAC,HindⅢ)。
以Achromobacterdenitrificans1104基因组为模板,PCR扩增目的条带。PCR条件为:94 ℃ 5 min,98 ℃ 10 s,65 ℃ 30 s,68 ℃ 1 min,30个循环,68 ℃ 10 min。PCR扩增的条带和pET-28a(+)用限制性内切酶进行酶切,并用Ligation high Ver.2连接酶连接,转化于E.coliBL21Gold(DE3)plysS,重组大肠杆菌命名为EHest-pET28a(+)-BL21Gold(DE3)plysS。
1.2.2 重组酯酶的诱导表达与表达产物SDS-PAGE电泳分析
将重组菌EHest-pET28a(+)-BL21Gold(DE3)plysS在含卡那霉素抗性和氯霉素抗性的LB液体培养基中,37 ℃培养至菌液OD600约为0.5~0.8,分别标记为诱导组和未诱导组。在宿主菌(单独)组,空载体菌组和诱导组中添加500 mmol/L IPTG至终浓度为1.0 mmol/L,未诱导组加等量的无菌水,25 ℃,180 r/min培养10 h。分别取宿主菌组,空载体菌组,未诱导组和诱导组菌液,4 ℃,10 000 r/min离心10 min后弃上清液,细胞悬浮于100 mmol/L的pH 8.0 Tris-HCl缓冲液中,菌体浓度大约为0.05 g/mL,冰浴条件下超声破碎。4 ℃、10 000 r/min离心30 min,取上清液(酶液),进行SDS-PAGE电泳分析。
1.2.3 重组菌与原始菌的表达酶活测定
分别取原始菌和诱导培养后的重组菌湿菌体各15 g,用50 mL磷酸盐缓冲液(100 mmol/L,pH 7.0)悬浮,经超声破壁后,离心,上清液即为酶液。取适量的酶液(EHesterase酶液取10 μL,原始菌株酶液取50 μL),0.25 g(R,S)-2,6-二甲基苯基氨基丙酸甲酯为底物,0.1 g吐温80作为乳化剂,一定量的磷酸盐缓冲液(100 mmol/L,pH 7.0),总反应体系为5 mL,37 ℃摇床中反应1 h,转速180 r/min,用6M盐酸终止反应。
1.2.4 重组酯酶对(R,S)-2,6-二甲基苯基氨基丙酸甲酯的水解拆分效果
取100 μL的酶液,反应1 h,反应条件同1.2.3。乙酸乙酯萃取,取一定量,用氮气吹干,加入流动相溶解,正相手性HPLC检测。
1.2.5 酶的最适温度和热稳定性
取适量的酶液,分别在20 ℃、30 ℃、40 ℃、50 ℃、60 ℃和70 ℃下测定酶活,反应10 min,其它条件同1.2.3。
将酶液分别放在30 ℃、40 ℃、50 ℃、60 ℃和70 ℃水浴中保温2 h,每隔30 min取适量酶液测定酶活,反应10 min。
1.2.6 酶的最适pH和酸碱耐受性
将酶液在不同的pH(pH 3.0、pH 4.0、pH 5.0为100 mmol/L柠檬钠缓冲液;pH 6.0、 pH 7.0、pH 8.0为100 mmol/L磷酸盐缓冲液;pH 9.0为100 mmol/L Tris-HCl缓冲液;pH 10.0、pH 11.0为Na2CO3-NaHCO3缓冲液)测定酶活,反应10 min。
将酶液放于100 mmol/L pH为3.0、5.0、7.0、9.0和11.0的缓冲液中,缓冲液∶酶液=4∶1(体积比),30 ℃下放置2 h,每隔30 min取取适量酶液测定酶活,反应10 min。
1.2.7 底物浓度对酶反应速率的影响暨米氏方程参数的测定
取适量酶液,(R,S)-2,6-二甲基苯基氨基丙酸甲酯的浓度分别为4 g/L、8 g/L、12 g/L、16 g/L、20 g/L、40 g/L、60 g/L、80 g/L和100 g/L,反应时间10 min,其它条件同1.2.3。
1.2.8 金属离子对酶活的影响
含1 mmol/L 的K+、Fe2+、Fe3+、Ca2+、Zn2+、Co2+、Mn2+、Ni2+、Cu2+、Ba2+、Mg2+、Li+的酶液,测定酶活,反应10 min。
1.2.9 有机溶剂对酶活性和立体选择性的影响
含10%和50%(v/v)有机溶剂(二甲基亚砜等)催化反应体系分别用于拆分(R,S)-2,6-二甲基苯基氨基丙酸甲酯,反应体系为5 mL,以没加有机溶剂作为对照,反应条件同1.2.3。
1.2.10 酶对不同底物的活性测定
以p-硝基苯酚酯为底物测定酶活:配制10 mmol/L的p-硝基苯酚酯的乙腈溶液,取0.03 mL与2.05 mL磷酸缓冲液溶液(pH 7.0)混合,加入20 μL酶液启动反应,37 ℃下测定p-硝基苯酚酯在 410 nm处吸光度随时间的变化。以不加酶为对照。产物p-硝基苯酚的摩尔消光系数为17 500 M-1cm-1。酶活单位1U:在上述条件下,每分钟催化底物产生1 μmol的产物p-硝基苯酚所需的酶量。
以橄榄油、乙酸丁酯、乙酸乙酯为底物测定酶活[11],反应在37 ℃、pH 7.0下进行。
1.2.11 (R,S)-2,6-二甲基苯基氨基丙酸甲酯及其产物(酸)的分析检测
正相HPLC用于检测R型和S型底物和产物(酸)。流动相为正己烷∶异丙醇=98∶2(加入0.1%的三氟乙酸),流速0.5 ml/min,检测紫外波长220 nm,柱温30 ℃,进样量10 μl,大赛璐手性OD柱250 mm×4 mm。色谱仪Waters。
反相HPLC用于检测总底物和总产物(酸)。流动相是乙腈∶水=60∶40(加入0.1%三氟乙酸),流速1 ml/min,检测紫外波长220 nm,柱温25 ℃,进样量10 μL,C18柱250 mm×4 mm,色谱仪岛津LC-20AT。
对映体过量值(ee)和底物总转化率(C)按以下计算:

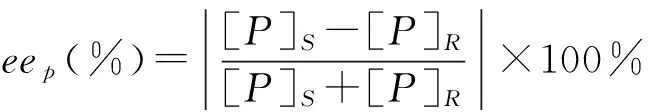

式中,[S]s和 [S]R分别为样品中S和R型底物的含量,[P]s和 [P]R分别是S和R型产物(酸)的含量,ees和eep分别为底物和产物对映体过量值。
2 结果与讨论
2.1 酯酶基因EHest的克隆表达
2.1.1 酯酶基因的扩增和基因工程菌的构建
以反硝化无色杆菌Achromobacterdenitrificans1104基因组为模板,PCR扩增目的条带,扩增后琼脂糖凝胶电泳检测,如图2。从图中可以看出,在(500~1 000) bp左右都有明亮的条带,无非特异性扩增,与预期大小相符。使用AxyPrepTMDNA Gel Extraction G Kit切胶回收目的片段。目的基因和pET-28a(+)经双酶切,连接后得到重组质粒,然后全部转化到E.coliBL21Gold(DE3)plysS宿主菌,获得EHest-pET28a(+)-BL21Gold(DE3)plysS。随机挑取平板上的4个单菌落,LB液体培养基(50 μg/mL卡那霉素抗性和35 μg/mL氯霉素抗性)过夜富集培养。提取重组质粒,做质粒PCR验证,琼脂糖电泳检测,EHest基因序列大小约为700 bp,与预期基因相符。取该克隆子送上海生工生物工程有限公司测序,测序结果表明,重组大肠杆菌构建成功。

图2 EHest基因PCR扩增的琼脂糖电泳
2.1.2 重组酯酶的表达与表达产物SDS-PAGE电泳分析
分别取宿主菌组,空载体菌组,未诱导组和诱导组菌液蛋白粗提液(即超声破碎后的上清液)进行SDS-PAGE电泳分析,如图3可知,经IPTG诱导,重组大肠杆菌有目的蛋白含量的表达,EHest酯酶目的蛋白约为30KDa,说明基因在EHest-pET28a(+)-BL21Gold(DE3)plysS成功异源表达。

M,蛋白Marker;1,诱导组;2,未诱导组;3,空载体菌株对照;
2.1.3 重组菌与原始菌的表达酶活的测定
原始菌株的表达酶活为17.6 U/mL。而重组菌EHest-pET28a(+)-BL21Gold(DE3)plysS的表达酶活为476 U/mL,是原始菌株的27.1倍。
2.1.4 重组酯酶对(R,S)-2,6-二甲基苯基氨基丙酸甲酯的水解拆分效果
用重组酯酶EHesterase(来自重组湿菌体)对MAP进行拆分,折算后的湿菌体与底物的质量比为1∶2.4(g/g)。经过1 h反应,底物的转化率达到了29.5%,产物的eep达到了85.1%,对映体选择性为R型。
Oh-Jin等[4]用Lipase PS催化MAP的水解,酶粉和底物用量之比为1∶2(g/g),反应3 h,转化率为17.1%,eep达到96.6%,选择性为R型。王岩等[7]利用南极假丝酵母脂肪酶CAL-B,酶粉和底物用量之比为1∶5.5(g/g),反应2 h,转化率为48.2%,产物的eep为69.2%,选择性是R型。与上述报道相比,EHesterase的活性高于Lipase PS和CAL-B,但酶的选择性低于前者,与后者相当。
2.2 重组酯酶EHest的酶学性质
2.2.1 酶的最适温度和热稳定性
分别测定不同温度下的酶活,以最高酶活为100%,结果如图4,酯酶在50 ℃酶活最高,在40 ℃和60 ℃酶活仍保持最高酶活的80%以上,但高于70 ℃,酶的活性迅速下降。酯酶热稳定性实验的结果如图5,30 ℃、40 ℃和50 ℃处理的酶液的残留酶活在90%以上。当温度在60 ℃及以上时,酯酶的稳定性迅速下降,70 ℃处理30 min后,酶的活性几乎丧失。

图4 温度对重组酯酶EHesterase活性的影响

图5 温度对重组酯酶EHesterase稳定性的影响
2.2.2 酶的最适pH及酸碱稳定性
分别测定不同pH下的酶活,以最高酶活为100%,结果如图6,酯酶在pH为9.0时活性最高, pH达到11时,依然保持相当高的活性;而在酸性条件下,酶的活性迅速下降,尤其pH为3和4时,酶的活性很低。pH对酶稳定性实验的结果如图7,酶在pH 5~9之间保持了良好的稳定性,但过酸过碱时,重组酯酶的稳定性大大下降。

图6 pH对重组酯酶EHesterase酶活的影响

图7 pH对重组酯酶EHesterase稳定性的影响
2.2.3 底物浓度对重组酯酶反应速率的影响
测定了不同MAP浓度下的初始酶反应速率,见图8。MAP的初始水解近似一级不可逆反应,应该符合米氏方程。由图可知,随着MAP浓度的增加,反应速率呈抛物线增加,确是典型的米氏方程曲线。通过对初始反应速率和底物浓度作双倒数图(图9),求得米氏方程参数Vm=0.733 g/(L·min),Km=7.49 g/L。由于所用酶液未经纯化,我们无法测出酶液中重组酯酶的确切浓度[E],因此无法算出米氏方程的参数k2(k2=Vm/[E])。

图8 底物(R,S)-2,6-二甲基苯基氨基丙酸甲酯
2.2.4 金属离子对酶活性的影响
分别测定加入金属离子后的酶活,以不加金属离子时的酶活(control)为100%,结果如图10。K+、Ba2+和Li+能轻微促进酶活;Ca2+、Co2+、Fe2+、Mn2+、Ni2+和Mg2+轻微抑制酶活。但Cu2+和Fe3+存在时,出现了对酶活的明显抑制。

图9 酶反应速率和底物浓度的双倒数图

图10 金属离子(1 mmol/L)对重组酯酶EHesterase
2.2.5 有机溶剂对重组酯酶活性和立体选择性的影响
含10%和50%有机溶剂(DMSO等)的反应体系分别用于拆分(R,S)-2,6-二甲基苯基氨基丙酸甲酯,以不加任何有机溶剂体系作为对照,结果如表1所示。10%DMSO对酶的立体选择性和催化速度有促进作用;50%DMSO情况下,重组酯酶EHest依然保持了较高的催化速率,说明酶对DMSO的耐受性较好。10%其他的有机溶剂对重组酯酶EHest酶活性出现了的不同程度的抑制作用,当达到50%有机溶剂含量,酶活更低(数据未列出)。
2.2.6 重组酯酶对不同底物的活性
从表2知,重组酯酶水解MAP(酯)的活性是水解橄榄油(脂肪)活性的333倍,但它对其它两种酯(乙酸乙酯和乙酸丁酯)的水解活性不高。MAP是芳香氨基酸的酯,该酶可能对芳香氨基酸残基的选择性大于脂肪酸残基。在用p-硝基苯酚酯作底物测定酯酶/脂肪酶的活性时,由于这些底物的特殊性,不能在底物过量的情况下测定它们的酶活。p-硝基苯酚酯的典型测试浓度是0.14 mmol/L,用2.2.3节的米氏公式计算了MAP在此浓度下的酶活性,与之进行比较。从表2中可知,酶水解MAP的活性(相对活性0.40)与水解p-硝基苯乙酸酯的活性(相对活性1.0)数量级相当。由于MAP是甲醇酯,而p-硝基苯乙酸酯是芳香醇(p-硝基苯酚)的酯,所以酶对芳香醇残基还是脂肪醇残基的选择性不明显。随着p-硝基苯酚酯脂肪酸残基链长的增加,酶对它们的水解活性下降。丁酸酯的活性只有乙酸酯活性的12%,链再加长,活性趋向于0。

表1 有机溶剂对重组酯酶活性和

表2 重组酯酶对不同底物的相对活性*
*在计算相对活性时,将酶浓度均校正为一个相同的浓度水平。
**MAP指(R,S)-2, 6-二甲基苯基氨基丙酸甲酯。
***为了和p-硝基苯酚酯进行比较,用2.2.3节的米氏公式计算MAP在此浓度下的酶活性。
3 结论
本研究将来自反硝化无色杆菌Achromobacterde-nitrificans1104的酯酶基因EHest,与表达载体pET28a(+)连接后,成功在E.coliBL21Gold(DE3)plysS中表达,IPTG诱导后重组菌的表达酶活为476 U/mL,比原始菌株高27.1倍。用重组酯酶EHesterase催化拆分(R,S)-2,6-二甲基苯基氨基丙酸甲酯,底物浓度50 g/L,反应1 h,底物转化率达到29.5%,产物(R-酸)的对映体过量值eep达到85.1%。
重组酯酶EHesterase的最适反应pH和温度为9.0和50 ℃,在50 ℃以下和pH 5~9之间具有较好的稳定性。该酶水解MAP的米氏动力学参数Vm、Km分别是0.733 g/(L·min)和7.49 g/L。加入10%DMSO对酶EHesterase的立体选择性和催化速度有一定的促进作用。Cu2+和Fe3+对酶活有明显抑制作用。该酶水解MAP的活性与水解p-对硝基苯乙酸酯的活性数量级相当,是水解橄榄油活性的333倍。
[1] Chikusa Y, Hirayama Y, Ikunaka M,etal. There’s no industrial biocatalyst like hydrolase: development of scalable enantioselective processes using hydrolyticenzymes. Organic Process Research & Development,2003, 7(3): 289-296.
[2] 刘西莉,马安捷,林吉柏. 精甲霜灵与外消旋体甲霜灵对掘氏疫霉菌的抑菌活性比较.农药学学报,2003, 5(3): 45-49.
[3] Zadra C, Marucchini C, Zazzerini A. Behavior of metalaxyl and its pure R-enantiomer in sunflower plants (Helianthusannus). Journal of Agricultural and Food Chemistry, 2002, 50(19): 5373-5377.
[4] Park OJ, Lee SH, Park TY,etal. Enzyme-catalyzed preparation of methyl (R)-N-(2,6-dimethylphenyl) alaninate: a key intermediate for (R)-metalaxyl. Tetrahedron: Asymmetry, 2005, 16(6):1221-1225.
[5] 黄丽琴,陈道文,杨红. 酶法拆分(±)-N-(2,6-二甲苯基)-丙氨酸甲酯.有机化学, 2005, 25(12):1575-1579.
[6] 黄丽琴,杨红. (±)-N-(2,6二甲苯基)-丙氨酸甲酯的脂肪酶酶促水解拆分方法. 南京农业大学学报, 2007, 30(4):135-139.
[7] 王岩.精甲霜灵的合成研究[D]. 长春:吉林大学,硕士学位论文. 2008.
[8] 王世辉.微胶囊法固定脂肪酶及拆分手性胺的研究[D]. 长春:吉林大学,硕士学位论文,2010.
[9] Park OJ, Lee SH. Stereoselective lipases fromBurkholderiasp., cloning and their application to preparation of methyl (R)-N-(2,6-dimethylphenyl) alaninate, a key intermediate for (R)-Metalaxyl. Journal of Biotechnology, 2005, 120(2):174-182.
[10] Park OJ, Lee SH, Park TY,etal. Development of a scalable process for a key Intermediate of (R)-Metalaxyl by Enzymatic Kinetic Resolution. Organic Process Research & Development, 2006,10(3): 588-591.
[11] 周晓云.酶技术[M].北京: 石油工业出版社, 1995, 287
DONG Jian-ming, ZHANG Li-kun, LU Ya-nan, YAO Xing-chao, YANG Yu-ying,LU Yue-le, ZHANG Zhao-hui
College of Biological Engineering, Zhejiang University of Technology, Hangzhou 310014
Cloning and expression of a novel esterase capable of enantioselective hydrolysis of methyl (R,S)-N-(2,6-dimethylphenyl) alaninate and its enzymatic properties
The esterase gene (EHest) fromAchromobacterdenitrificans1104 was ligated with plasmids pET28a(+), transformed intoE.coliBL21Gold(DE3)plysS. The resulting recombinants successfully expressed the esterase (EHesterase) capable of catalyzing enatioelective hydrolysis of methyl (R,S)-N-(2,6-dimethylphenyl) alaninate (MAP), a key intermediate for the synthesis of metalaxyl. Catalyzing the hydrolysis of MAP(5% m/v) by EHesterase for 1 h at 37 ℃, the substrate conversion was 29.5% andeepof the product acid (major in R configuration) was 85.1%.The optimum reaction pH and temperature of EHesterase were 9.0 and 50 ℃ respectively. The enzyme was stable at below 50 ℃ and between pH 5 and pH 9. The Michaelis-Menten kinetics parameters Vmand Kmfor MAP’s hydrolysis catalyzed by EHesterase were 0.733 g/(L·min) and 7.49 g/L respectively. 10% DMSO somewhat increased the enantioselectivity and activity of the enzyme. 1 mmol/L of Cu2+, Fe3+significantly inhibited its activity. Using MAP as substrate, the hydrolysis activity of EHesterase was the same order as that usingp-nitrophenyl acetate as substrate and was 333 times as high as that using olive oil as substrate.
Achromobacterdenitrificans; esterase; gene cloning and expression; methyl(R,S)-N-(2,6-dimethylphenyl) alaninate; enantioselective hydrolysis; enzymatic properties
国家自然科学基金(21447005)。
董剑鸣(1989~),男,硕士研究生。E-mail:dongjianming1231@163.com。
*通讯作者:张朝晖(1968~),男,博士,副教授,主要从事酶工程的研究。E-mail:zzh@zjut.edu.cn。

