传染性囊病病毒(IBDV)VP3蛋白单克隆抗体的制备与鉴定
王彬,李淑芹,李晓齐,曹红,王永强,郑世军
(中国农业大学动物医学院农业生物技术国家重点实验室,北京海淀100193)
传染性囊病病毒(IBDV)VP3蛋白单克隆抗体的制备与鉴定
王彬,李淑芹,李晓齐,曹红,王永强,郑世军
(中国农业大学动物医学院农业生物技术国家重点实验室,北京海淀100193)
为制备抗IBDV VP3蛋白的单克隆抗体,以VP3-His蛋白免疫BALB/c小鼠,经4次免疫、融合、亚克隆,筛选出1株能够稳定分泌抗VP3蛋白单克隆抗体的细胞株,命名为4H8F7C10。经间接ELISA方法检测,小鼠的腹水效价为2.05× 106,单克隆抗体的解离常数(kD)为9.67×10-8,此株抗体亚类为IgG3。通过Western Blot和间接免疫荧光试验检测,该株单克隆抗体可以识别IBDV感染DF-1细胞产生的VP3蛋白。初步确定此株单克隆抗体的抗原识别区位于VP3蛋白N端的第50-90位氨基酸。此株单克隆抗体的制备为IBDV临床检测方法的建立以及致病分子机制的研究奠定了基础。
IBDV;单克隆抗体;VP3蛋白
传染性囊病(IBD),是一种危害3~8周龄雏鸡的烈性、高度接触性传染病,主要侵害腔上囊等淋巴组织。腔上囊的损伤导致免疫抑制,使其他疾病的发生率明显升高。IBD往往为突然暴发,死亡率高达20%~30%,并经常发展为隐性感染。IBD在全世界范围内广泛传播。
传染性囊病病毒(IBDV)属于双RNA病毒科双RNA病毒属,无囊膜的病毒。该病毒基因组由A、B两个片段组成[1]。IBDV B片段大约为2 800 bp,编码VP1蛋白,该蛋白为病毒的RNA聚合酶;A片段大约为3 200 bp,由两个重叠的开放阅读框构成,较大的ORF编码pVP2-VP3-VP4多聚蛋白前体,该蛋白前体由VP4蛋白剪切为pVP2、VP3和VP4三个蛋白[2],pVP2被进一步剪切成VP2和若干个短肽,较小的ORF编码病毒的非结构蛋白VP5[3]。
VP3具有脚手架蛋白的作用[4],在病毒的形态结构上具有不可替代的功能。在病毒粒子的组装过程中,与VP1和病毒的双链RNA结合,招募VP1进入衣壳[5],包裹着病毒的双链RNA[6],并且与VP1、病毒双链RNA形成核糖核蛋白复合体,形成病毒样粒子。VP3在病毒与宿主细胞相互作用上有一定联系,王笑梅等的研究表明,VP3蛋白C端一个氨基酸的突变就可影响病毒的复制[7];同时VP3与pVP2、VP4形成的多聚蛋白可以抑制B淋巴细胞的细胞增殖和有丝分裂的刺激[8];VP3蛋白还可以抑制PKR和elF2α的磷酸化,进而抑制PKR介导的细胞凋亡,并且这种功能的实现是借助VP3蛋白的双链RNA结合区[9];VP3形成的核糖核蛋白复合体可以借助内吞途径定位于近核区域,高尔基体在病毒的形成过程中有重要作用[10]。因此,VP3蛋白参与病毒粒子的形成,并在病毒与宿主细胞的相互作用中具有重要的位置,本试验成功制备了抗VP3蛋白单克隆抗体,为IBDV致病机理的研究奠定了基础。
1材料与方法
1.1质粒、菌株、毒株、细胞与实验动物pET-28a-VP3、pGEX-6P-1-VP3质粒,DH5α、BL21菌株,鸡传染性贫血症病毒(CAV)、禽白血病病毒(ALV)、禽呼肠孤病毒(ARV)、禽网状内皮组织增殖病病毒(REV),骨髓瘤细胞SP2/0为本实验室保存,BALB/c小鼠,购自北京维通丽华实验动物技术有限公司;IBDV毒株Lx由北京市农林科学院畜牧兽医研究所刘爵研究员馈赠。
1.2主要试剂与仪器限制性内切酶、LA Taq酶和DNA连接酶,购自TaKaRa公司;dNTPs,购自CNS公司;山羊抗小鼠IgG二抗,购自北京鼎国昌盛生物技术有限责任公司;标准胎牛血清,购自Hyclone公司;弗氏完全佐剂、弗氏不完全佐剂、HAT、HT和Mouse Monoclonal Antibody Isotyping Reagents,均购自Sigma公司;KoDak医学X线显影机102型,购自美国KoDak公司;Sunrise 96孔酶标仪,购自TECAN公司;XDS-1B倒置显微镜,购自重庆光学仪器厂。
1.3抗VP3单克隆抗体的制备用纯化得到的VP3-His蛋白免疫小鼠。小鼠血清效价大于1:10 000时,无菌状态下取免疫小鼠的脾脏,分离脾细胞与SP2/0细胞融合,随后进行阳性克隆筛选、亚克隆[11]。
1.4抗VP3单克隆抗体特性鉴定
1.4.1单克隆抗体亚类鉴定按照Sigma公司的Mouse Monoclonal Antibody Isotyping Reagents鉴定试剂盒说明书进行亚类鉴定。
1.4.2单克隆抗体特异性鉴定以ALV、CIAV、REV、IBDV、ARV感染宿主细胞获取的总蛋白进行SDS-PAGE电泳,以制备的抗VP3单抗为一抗,进行Western Blot检测。
1.4.3单克隆抗体亲和力鉴定参照文献[12]进行亲和力解离常数(kD)的测定。
1.4.4Western Blot鉴定将DF-1细胞以1×105/孔接种于24孔板中,待细胞密度达到70%~90%时,以IBDV(MOI=1)接种细胞,并设置相应的阴性对照。24 h后收取细胞裂解总蛋白,进行Western Blot鉴定。
1.4.5间接免疫荧光试验(IFA)鉴定按照1.4.4所述方法进行病毒感染,并设置相应的阴性对照。培养24 h后,用1%多聚甲醛进行固定和0.2%Triton X-100透化处理,1%BSA封闭后加入抗VP3单克隆抗体作为一抗,以FITC标记的IgG为二抗,置于荧光显微镜下进行观察。
1.4.6抗原识别区分析将VP3基因按150个碱基的间距分别从N端和C端进行截短,构建到pEGFP-N1载体上,转染HEK-293T细胞。收取细胞总蛋白用Western Blot方法鉴定单抗抗原表位识别区域。
2试验结果
2.1单克隆抗体的制备和亚类鉴定小鼠经3次免疫,用间接ELISA方法测定小鼠血清效价为1:12 800。加强免疫后,取免疫小鼠的脾细胞与SP2/0细胞进行融合,经过3次亚克隆,获得1株能稳定分泌抗VP3的杂交瘤细胞株,命名为4H8F7G8。将杂交瘤细胞注射到经产BALB/c母鼠腹腔内制备腹水,间接ELISA测定小鼠腹水效价为2.05×106,用Sigma公司的ELISA亚类鉴定试剂盒检测表明,此株单克隆抗体的亚类为IgG3。
2.2抗VP3单克隆抗体特异性检测与亲和力鉴定抗VP3单克隆抗体可以识别IBDV VP3蛋白,不识别ALV、REV、ARV感染DF-1细胞,CIAV感染MSB1细胞收取的细胞总蛋白(图1A),表明获得的单克隆抗体具有良好的特异性。亲和力检测结果表明,此株单抗的亲和力解离常数(kD)为9.67×10-8(图1B),属于高亲和力的单抗。
2.3抗VP3单克隆抗体识别IBDV VP3蛋白用Western Blot方法检测IBDV感染DF-1细胞(图2A),试验结果表明,该株单克隆抗体能够特异性识别IBDV病毒感染细胞产生的VP3蛋白;以间接免疫荧光试验检测,结果同样表明,该株单克隆抗体可以特异性识别IBDV感染DF-1细胞产生的VP3蛋白(图2B)。以上试验结果表明,4H8F7G8株单抗能较好的识别IBDV VP3蛋白。

图1抗VP3单克隆抗体特异性和亲和力测定
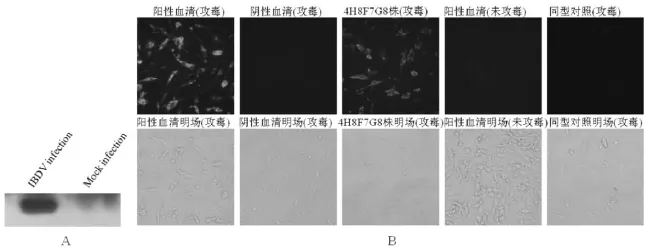
图2单抗4H8F7C10株识别IBDV感染产生的VP3蛋白
2.4单克隆抗体抗原识别区的确定用抗GFP标签抗体作为一抗,Western Blot检测表明VP3-GFP截短蛋白均可以表达(图3B)。以4H8F7G8单克隆抗体为一抗,通过Western Blot分析株抗体识别的抗原表位所在区域为VP3蛋白N端第50-90位氨基酸(图3C、3D)。
3讨论
传染性囊病是急性、高度接触性传染病,主要引起鸡淋巴器官的伤害,尤其是腔上囊的损伤。耐过鸡由于免疫器官的损伤,体液免疫和细胞免疫功能下降,引起免疫抑制,造成对其他疾病易感和免疫程序的失败。传染性囊病发病迅速、发病率高,有明显的尖峰死亡曲线,5~7 d后随即康复;目前传染性囊病有效的治疗方法是在鸡发病初期注射卵黄抗体,减轻症状。疾病的早期诊断对于IBD的防控就尤为重要。IBDV编码5个病毒蛋白,其中VP3蛋白为病毒结构蛋白,在血清1型病毒中占病毒蛋白的40%[13]。IBDV VP3单克隆抗体的制备为IBDV快速检测方法的建立提供了有效途径,同时VP3单克隆抗体也是IBDV致病机理研究的有利工具。
本研究成功制备了1株针对IBDV VP3蛋白的单克隆抗体,通过与CIAV、ALV、REV、ARV等其他禽类病毒的特异性试验发现,该株抗体具有良好的特异性。我们在抗原识别区的确定过程中,分别从VP3蛋白的N端和C端进行截短表达,可以确定单克隆抗体更精确的识别区,也可以排除一株单克隆抗体在VP3蛋白上有多个识别区的可能。目前国内很多实验室都已成功制备了VP3单克隆抗体[14-16],但这些抗体的亲和力还不十分明确,不同亲和力抗体的生物学功能是不同的,这就决定了其使用范围与目的的不同。我们获得的VP3单克隆抗体为高亲和力抗体,这将在IBDV的检测以及VP3功能研究中得到广泛应用。

图3单抗抗原表位识别区分析
综上所述,本研究成功制备了1株针对IBDV VP3蛋白的单克隆抗体,并对所制备的抗VP3单克隆抗体的亚型、特异性、亲和力和抗原表位作了详细分析,为IBDV致病机理的研究以及快速检测试剂盒的研发奠定了基础。
[1]Azad A A,Barrett S A,Fahey K J.The characterization and molecular cloning of the double-stranded RNA genome of an Australian strain of infectious bursal disease virus[J].Virology,1985,143(1):35-44.
[2]Spies U,Muller H,Becht H.Nucleotide sequence of infectious bursal disease virus genome segment A delineates two major open reading frames[J].Nucleic Acids Res,1989,17(19):7982.
[3]Mundt E,Beyer J,Muller H.Identification of a novel viral protein in infectious bursal disease virus-infected cells[J].J Gen Virol,1995,76(Pt 2):437-443.
[4]Maraver A,Oña A,Abaitua F,et al.The oligomerization domain of VP3,the scaffolding protein of infectious bursal disease virus,plays a critical role in capsid assembly[J].J Virol,2003,77(11):6438-6449.
[5]Lombardo E,Maraver A,Castón J R,et al.VP1,the putative RNA-dependent RNA polymerase of infectious bursal disease virus,forms complexes with the capsid protein VP3,leading to efficient encapsidation into virus-like particles[J].J Virol,1999,73(8):6973-6983.
[6]Kochan G,Gonzalez D,Rodriguez J F.Characterization of the RNA-binding activity of VP3,a major structural protein of Infectious bursal disease virus[J].Arch Virol,2003,148(4):723-744.
[7]Wang Y,Qi X,Kang Z,et al.A single amino acid in the C-terminus of VP3 protein influences the replication of attenuated infectious bursal disease virus in vitro and in vivo[J].Antiviral Res,2010,87(2):223-229.
[8]Peters M A,Lin T L,Wu C C.Infectious bursal disease virus polyprotein expression arrests growth and mitogenic stimulation of B lymphocytes[J].Arch Virol,2004,149(12):2413-2426.
[9]Busnadiego,I.Maestre AM,Rodríguez D,et al.The infectious bursal disease virus RNA-binding VP3 polypeptide inhibits PKR-mediated apoptosis[J].PLoS One,2012,7(10):e46768.
[10]Delgui,L R,Rodriguez J F,Colombo M I.The endosomal pathway and the Golgi complex are involved in the infectious bursal disease virus life cycle[J].J Virol,2013,87(16):8993-9007.
[11]Yokoyama W M.Current protocols in Immunology[M].JohnWiley& Sonc,Inc,1995:2.5.1-2.6.9.
[12]罗正,刘若尘,郑世军.单核增生性李氏杆菌溶血素的原核表达及其单克隆抗体的制备[J].生物工程学报,2009,25(10):1652-1657.
[13]Dobos P,Hill B J,Hallett R,et al.Biophysical and biochemical characterization of five animal viruses with bisegmented doublestranded RNA genomes[J].J Virol,1979,32(2):593-605.
[14]胡伯里.传染性法氏囊病病毒结构蛋白VP2和VP3调控细胞自噬的分子机制研究[D].杭州:浙江大学,2014.
[15]邓小芸,高玉龙,高宏雷,等.传染性腔上囊病病毒VP3蛋白模拟表位的筛选[J].中国兽医科学,2006,36(10):791-794.
[16]程宇,邓小芸,高玉龙,等.抗鸡传染性法氏囊病病毒VP3单克隆抗体制备及抗原表位的初步分析[J].畜牧兽医学报,2006,37(12):1323-1327.
Development and identification of monoclonal antibodies against Infectious Bursal DiseaseVirus(IBDV)VP3
WANG Bin,LI Shu-qin,LI Xiao-qi,CAO Hong,WANG Yong-qiang,ZHENG Shi-jun
(State Key Laboratory of Agrobiotechnology,College of Veterinary Medicine,China Agricultural University,Beijing 100193,China)
To develop antibodies against IBDV VP3,BALB/c mice were vaccinated with VP3-His.After four times immunization,fusion,and subcloning,a hybridoma cell clone that stably secreted McAbs against VP3 was obtained and named 4H8F7C10. Antibody titers were 2.05×106as examined by indirect ELISA in ascite fluid of mice inoculated intraperitoneally with monoclonal antibody-producing hybridoma cells.The dissociation constant(kD)of the monoclonal antibody was determined to be 9.67×10-8and the isotype was IgG3.The McAb specifically bound to VP3 in IBDV-infected DF-1 cells was validated by Western Blot and indirect Fluorescence Antibody assay.The epitope in VP3 that was recognized by 4H8F7C10 was located between 50 to 90 aa as demonstrated by Western Blot.The McAb will be useful for the examination of IBDV antigen and to elucidate the molecular mechanism of IBDV infection.
IBDV;monoclonal antibody;VP3
ZHENG Shi-jun
S852.4
A
0529-6005(2016)08-0025-04
2015-06-10
国家自然科学基金(31430085;31272543);现代农业产业技术体系建设专项资金(NYCYTX-41)
王彬(1988-),男,博士生,主要从事病原与宿主相互作用机制的研究,E-mai:6942362@163.com
郑世军,E-mail:sjzheng@cau.edu.cn

